Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна
Содержание
- 2. Цели урока Дать понятие о составе атома и составе атомного ядра Раскрыть взаимосвязь понятий: протон; нейтрон;
- 3. Самостоятельная работа 1.В предложение вставьте слова „атом” и „молекула” а)…водорода образована … водорода. б)…углекислого газа образована
- 4. Основные положения атомно-молекулярного учения Вещества состоят из молекул, а молекулы из атомов. Молекула –мельчайшая частица вещества,
- 5. Атом - сложная частица Введение понятия „электрон” (Стони) Открытие катодных лучей. Катодные лучи- поток электронов.(Томсон и
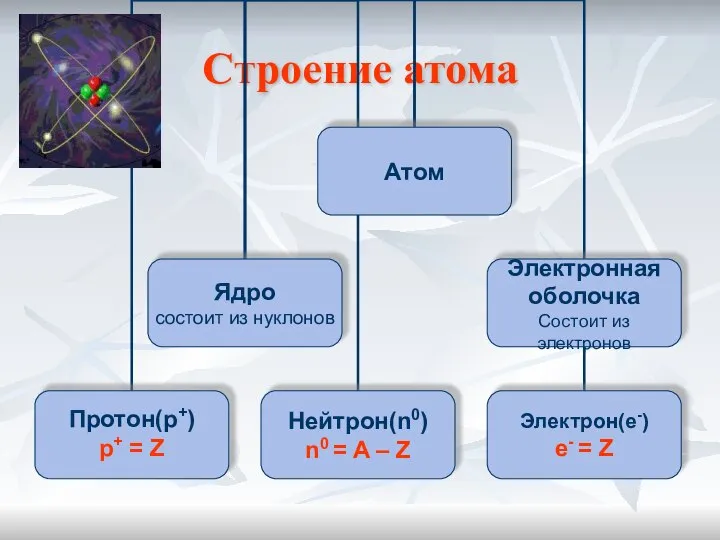
- 6. Строение атома
- 7. Планетарная модель атома Атом –это микрочастица, которая имеет форму шара. Атом –сложная система, состоящая из ядра
- 8. Самостоятельная работа Укажите состав атома железа 2656Fe (26p++30n0) 26e- Укажите состав ядра атома железа 2656Fe (26p++30n0)
- 9. Что произойдет с атомом элемента, если в его ядре изменить число протонов? Например, в ядро атома
- 10. Что произойдет с атомом элемента, если в его ядре изменить число нейтронов? Например, в ядро атома
- 11. Изотопы Укажите состав изотопов хлора:35Сl и37Сl 1735Сl(17p++18n0) 17е- А=35 1737Сl(17p++20n0) 17е- А=37 Атомы изотопов одного элемента
- 12. Задачи. Символ изотопа элемента1939Э.Определите, какой это элемент, состав атома этого элемента. Z=19. Элемент - калий. 1939К
- 13. Задачи. Природный хлор состоит из 75% изотопа с массовым числом 35 и из 25% изотопа с
- 14. Задачи. Относительная атомная масса хлора 35,5.Хлор существует в природе в виде двух изотопов:35Cl и 37Cl. Рассчитайте
- 16. Скачать презентацию












 Тема: «Самородные металлы».
Тема: «Самородные металлы». Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть
Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть  Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Коллоидные растворы поверхностно-активных веществ (ПАВ)
Коллоидные растворы поверхностно-активных веществ (ПАВ) Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Стеклообразное состояние полимеров. (Лекция 5)
Стеклообразное состояние полимеров. (Лекция 5) SNAP i.d. Workflow Value Proposition
SNAP i.d. Workflow Value Proposition Оксигеновмісні сполуки Підготувала учениця 11-Б класу Нововолинського ліцею-інтернату Волинської обласної ради Федина Вале
Оксигеновмісні сполуки Підготувала учениця 11-Б класу Нововолинського ліцею-інтернату Волинської обласної ради Федина Вале Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Оксидтер, жіктелуі, аталуы, алу жолдары, химиялық қасиеттері
Оксидтер, жіктелуі, аталуы, алу жолдары, химиялық қасиеттері «Строение атома и периодическая система» Химический диктант в 8 классе
«Строение атома и периодическая система» Химический диктант в 8 классе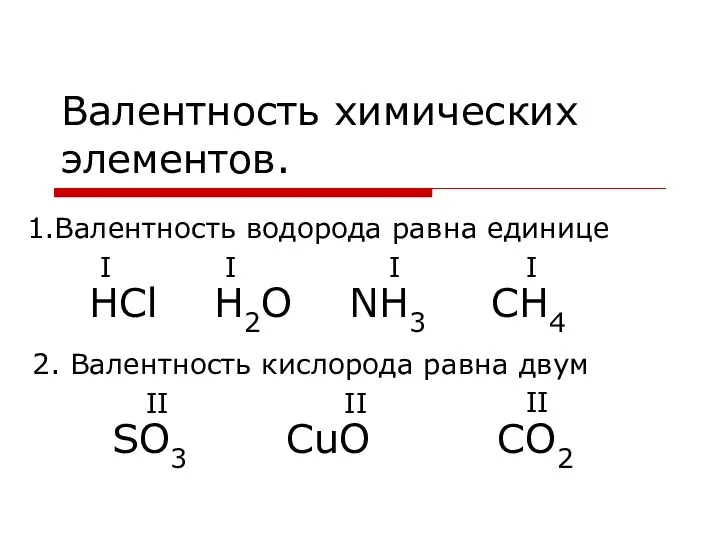 Валентность химических элементов
Валентность химических элементов Электролиттік диссоциация
Электролиттік диссоциация Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения
Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения Біографія Д. І. Менделєєва
Біографія Д. І. Менделєєва  Почему вода в море солёная
Почему вода в море солёная Полимеры
Полимеры Металлокомплексный катализ. (Лекция 16)
Металлокомплексный катализ. (Лекция 16) Химический состав свежих плодов и овощей
Химический состав свежих плодов и овощей Крахмал. Строение вещества
Крахмал. Строение вещества Моноядерні арени
Моноядерні арени Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Явище ізомерії. Структурна ізомерія Виконав Пивоварчук Вадим
Явище ізомерії. Структурна ізомерія Виконав Пивоварчук Вадим