Содержание
- 2. Когда-нибудь настанет время – и это время не за горами, – когда мерилом ценности станет не
- 3. 1. Взаимодействие с активными металлами. При комнатной температуре 2K+H2→2KH (гидрид калия) Ca+H2→CaH2 (гидрид кальция) При нагревании
- 4. Вывод: В соединениях с металлами, водород образует гидриды – бинарные соединения, твердые вещества. (KH, CaH2, AlH3)
- 5. 2. Взаимодействие с неметаллами. При комнатной температуре водород реагирует с фтором F2+H2→2HF↑ (фтороводород), реакция протекает со
- 6. при нагревании водород взаимодействует с серой: Н2 + S→Н2S↑ (сероводород) при высокой температуре, давлении и в
- 7. Вывод: В результате реакций образуются газообразные вещества ( HF↑ , HCl ↑, Н2S↑, NH3↑ ).
- 8. 3. Реакция горения: При взаимодействии водорода с кислородом образуется вода. Водород без примесей сгорает спокойно. 2
- 10. Гремучая смесь Наиболее взрывчата смесь, состоящая из двух объёмов водорода и одного объёма кислорода - гремучая
- 12. 4.Взаимодействие с оксидами не активных металлов ОксидыОксиды восстанавливаются до металлов: СuO + H2 = H2O +
- 14. Вывод: Водород восстанавливает металлы из их оксидов, поэтому водород является восстановителем. H2 восстановитель
- 15. Выводы: 1). В обычных условиях молекулярный водород взаимодействует лишь с наиболее активными веществами - фтором, натрием
- 16. Практическая работа «Обнаружение водорода.»
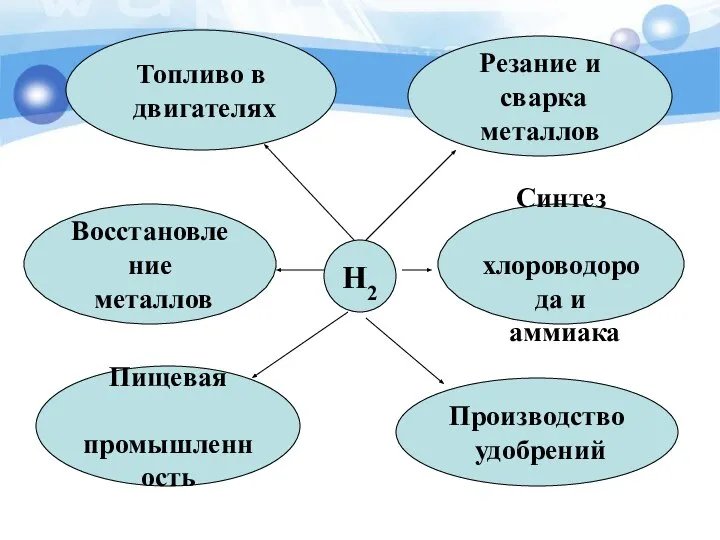
- 17. Применение водорода в промышленности.
- 18. Использование водорода в качестве топлива автомобилей. При сгорании водорода в кислороде образуется экологически чистый продукт –
- 19. Использование водорода в ракетных двигателях. Жидкий водород является распространенным компонентом ракетных топлив.
- 20. Использование водорода в металлургической промышленности Водород как восстановитель, для получения металлов и неметаллов (кремния, вольфрама)
- 21. Сварка металла Смесь кислорода с водородом используют при сварке и резке металлов.
- 22. Производство стекла Водород является активным газом и в соединениях с азотом может использоваться в производстве листового,
- 23. В пищевой промышленности Превращение растительных масел в твердые жиры – маргарин.
- 24. H2 Резание и сварка металлов Синтез хлороводорода и аммиака Пищевая промышленность Восстановление металлов Топливо в двигателях
- 25. Задачи: Какая масса водорода потребуется для его взаимодействия с 64г серы. Какой объём водорода израсходуется на
- 27. Скачать презентацию























 Каталитикалық риформинг
Каталитикалық риформинг Определение валентности элементов
Определение валентности элементов Тест по теме «Альдегиды и кетоны»
Тест по теме «Альдегиды и кетоны» 9 класс (обязательный минимум по химии) ПОЛИМЕРЫ
9 класс (обязательный минимум по химии) ПОЛИМЕРЫ  Альдегиды и кетоны
Альдегиды и кетоны Место и роль химии при изучении Естествознания в системе школьного образования
Место и роль химии при изучении Естествознания в системе школьного образования Алкалоиды. Классификация алкалоидов:
Алкалоиды. Классификация алкалоидов: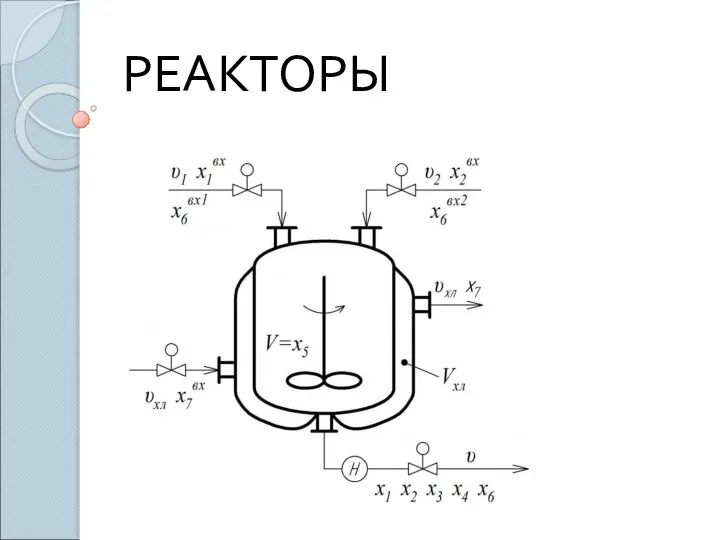 Реакторы. Основные требования к промышленным реакторам
Реакторы. Основные требования к промышленным реакторам Биотехнология туралы түсінік
Биотехнология туралы түсінік Общие свойства металлов МАОУ Домодедовский лицей №3 Разинькова Н.М.
Общие свойства металлов МАОУ Домодедовский лицей №3 Разинькова Н.М.  Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар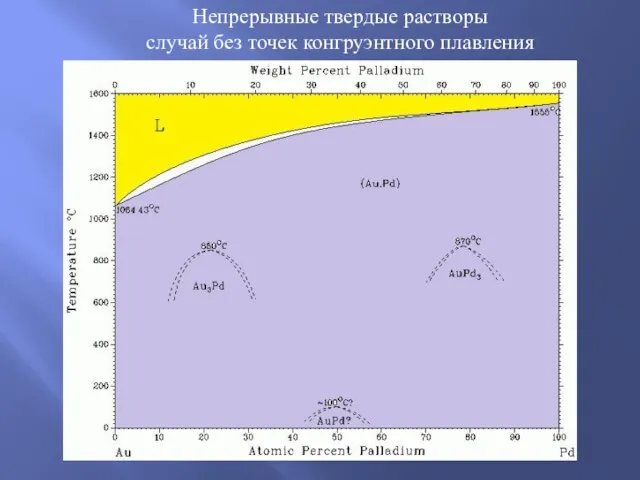 Непрерывные твердые растворы случай без точек конгруэнтного плавления
Непрерывные твердые растворы случай без точек конгруэнтного плавления Электрохимические методы обработки металлов
Электрохимические методы обработки металлов Круговорот веществ Лекции по экологии Каф.ХиЭ ТТИ ЮФУ Доц.,к.х.н. Е.В.Воробьев
Круговорот веществ Лекции по экологии Каф.ХиЭ ТТИ ЮФУ Доц.,к.х.н. Е.В.Воробьев Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері
Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері Физические и химические свойства воды
Физические и химические свойства воды Неравновесные явления в растворах электролитов
Неравновесные явления в растворах электролитов Сравнительный анализ качества пакетированного чёрного чая разных торговых марок. Химический анализ, органолептический анализ
Сравнительный анализ качества пакетированного чёрного чая разных торговых марок. Химический анализ, органолептический анализ Химические волокна
Химические волокна Буландырғыш аппараттарының құрылымдары
Буландырғыш аппараттарының құрылымдары Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Томский
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Томский Аттестационная работа. Мини-проекты на уроках химии. 8 класс
Аттестационная работа. Мини-проекты на уроках химии. 8 класс Эффект Зеемана
Эффект Зеемана Ферромагнитная жидкость – «умная» жидкость
Ферромагнитная жидкость – «умная» жидкость Липиды. Классификация, строение, свойства, биологическая роль
Липиды. Классификация, строение, свойства, биологическая роль Алюминий и сплавы на его основе
Алюминий и сплавы на его основе Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Моющие средства
Моющие средства