Содержание
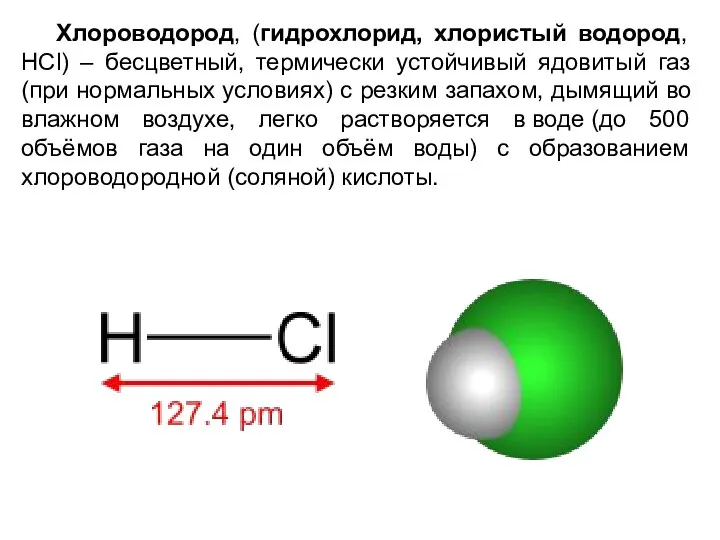
- 2. Хлороводород, (гидрохлорид, хлористый водород, HCl) – бесцветный, термически устойчивый ядовитый газ (при нормальных условиях) с резким
- 3. Физические свойства Тяжелее воздуха. Соединение хорошо растворяется в воде. Раствор хлороводорода в воде называют соляной кислотой.
- 4. Химические свойства Раствор хлороводорода в воде называют соляной кислотой. Процесс растворения можно описать с помощью следующего
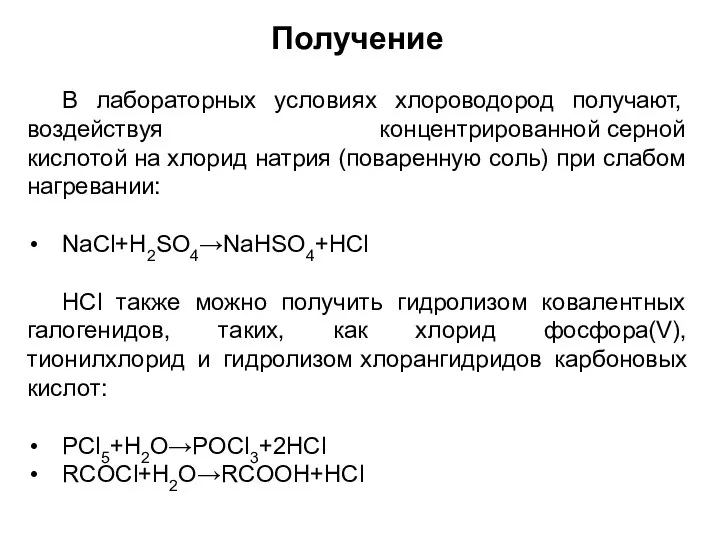
- 5. Получение В лабораторных условиях хлороводород получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при
- 6. В промышленности для получения хлороводорода обычно используют прямой синтез из простых веществ: H2+Cl2⇄2HCl+184,7кДж В производственных условиях
- 7. Применение Газообразный хлороводород практически не используется из-за его физических и химических характеристик. Широкое применение находит соляная
- 8. Токсичность Хлороводород (Гидрохлорид, хлористый водород, HCl) особо токсичен, числится в списке сильнодействующих ядовитых веществ, относится к
- 9. При отравлении нужно немедленно вынести пострадавшего на свежий воздух, освободить от стесняющей дыхание одежды и дать
- 10. При работе с соляной кислотой и хлористым водородом необходимо носить шерстяную защитную одежду, прошитую нейлоновыми или
- 11. Список информационных источников Википедия – Хлороводород – https://ru.wikipedia.org/wiki/Хлороводород Свойства хлороводорода – https://wika.tutoronline.ru/himiya/class/9/svojstva-hlorovodoroda-sposoby-polucheniya Техника безопасности при работе
- 13. Скачать презентацию








 Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов принцип работы, применение в технике и быту
принцип работы, применение в технике и быту Хроматографические методы в радиохимии
Хроматографические методы в радиохимии Физико-химические свойства сырья, продукции, реагентов и материалов (ЧАСТЬ 3)
Физико-химические свойства сырья, продукции, реагентов и материалов (ЧАСТЬ 3) IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Углеводы
Углеводы Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата Сложные эфиры
Сложные эфиры Евгений Шварц «Сказка о потерянном времени»: «… ты помни: человек, который понапрасну теряет время, сам не замечает, как стареет»
Евгений Шварц «Сказка о потерянном времени»: «… ты помни: человек, который понапрасну теряет время, сам не замечает, как стареет» Технология получения сплавов с заданными свойствами
Технология получения сплавов с заданными свойствами Презентация Удобрения и их классификация
Презентация Удобрения и их классификация Способы и системы культивирования микроорганизмов. (Тема 3)
Способы и системы культивирования микроорганизмов. (Тема 3) Гидролиз
Гидролиз Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные ? ___________
? ___________ Элементы нелинейного функционального анализа
Элементы нелинейного функционального анализа Липиды
Липиды Электролиты и неэлектролиты
Электролиты и неэлектролиты Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение
Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение  Магматичні родовища
Магматичні родовища Откуда ты, химия ?
Откуда ты, химия ? Биологическое окисление при участии кислорода
Биологическое окисление при участии кислорода Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері Тест по теме «КИСЛОТЫ»
Тест по теме «КИСЛОТЫ» Алюминий. Интересные факты
Алюминий. Интересные факты Окислительно-восстановительные реакции (ОВР). Часть 2
Окислительно-восстановительные реакции (ОВР). Часть 2 Сложные реакции
Сложные реакции