Содержание
- 2. «Лужні, лужноземельні метали та магній». Урок в 10 класі КЗ Верхівцевського НВК Учитель Кукса Н.М.
- 3. 1.Узагальнити і систематизувати знання про лужні та лужноземельні метали. 2.Вміти характеризувати елементи за положенням в періодичній
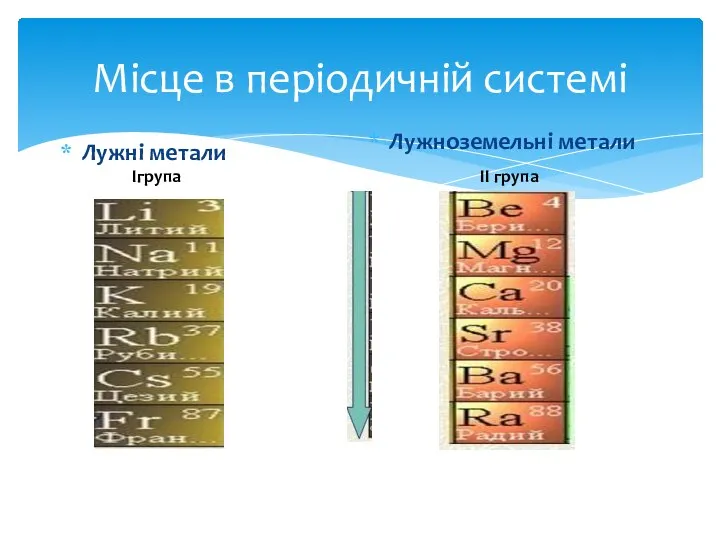
- 4. Місце в періодичній системі Лужні метали Лужноземельні метали Ігрупа ІІ група
- 5. 1Чим пояснити активність металів? 2.Чому на вашу думку їх називають лужні та лужноземельні?
- 6. Фізичні властивості Лужні метали Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи
- 7. Физичні властивості Mg
- 8. Хімічні властивості Лужні метали 1. Легко реагують із киснем повітря. Літій при окисленні утворює оксид Li2O,
- 9. Відмінні властивості магнію. 4Mg + Fe3O4 = 4MgO + 3Fe 3Mg + Al2O3 = 3Mg O
- 10. Основний характер оксидів та гідроксидів металів. Ме―Ме2О―МеОН―сіль Ме―МеО―Ме(ОН)2―сіль Складіть будь ласка ланцюжки для Li,та Mg
- 11. Поширення в природі У природі лужні елементи трапляються лише у вигляді солей. Найважливішими мінералами Натрію є
- 12. Поширення в природі У зв'язку з високою хімічною активністю у вільному стані в природі він не
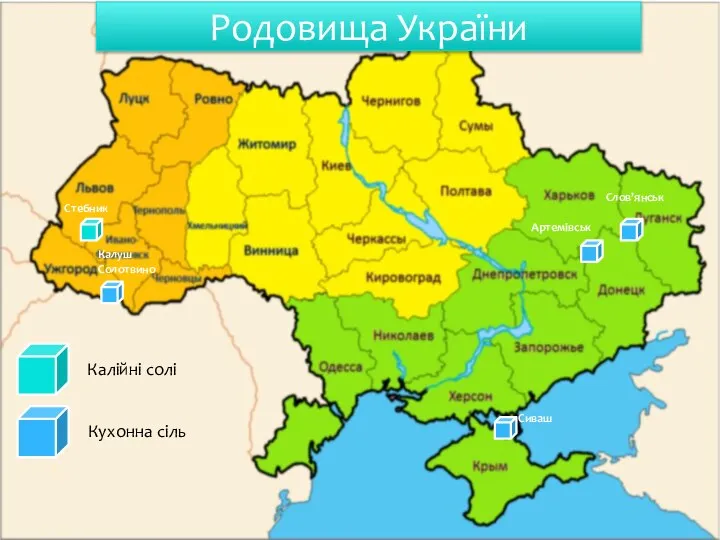
- 13. Родовища України
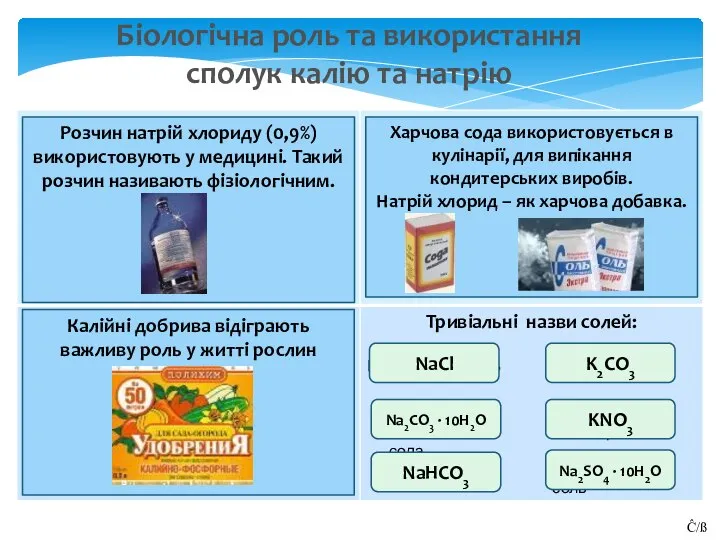
- 14. Біологічна роль та використання сполук калію та натрію ответ ответ ответ NaCl Кристалли-ческая сода Na2CO3 ·
- 15. Поширення в природі лужноземельних металів. У зв'язку з високою хімічною активністю у вільному стані в природі
- 16. Поширення Магнию в природі Брусит Доломит Магнезит Каинит Карналлит
- 17. Біологічна роль та використання магнію Ĉ/ß
- 18. Так як у лужному середовищі гинуть мікроорганізми,то речовини з цим середовищем є добрими антисептиками: мило, СМС.
- 19. Користь,та шкода лужного середовища. Тому, регулярне миття рук з милом , захистить вас від хвороб Але
- 20. Тож давайте дамо відповідь на наше проблемне питання.
- 21. Перевірка знань Порівняйте атоми елементів, поставивши знаки або = замість *: а) заряд ядра: Mg *
- 22. Рефлексія: Продовжіть ланцюжок: Я знаю ….. Я вмію ….. Я використовую …… Мені це буде необхідно
- 24. Скачать презентацию


















 Гидролиз солей
Гидролиз солей Генетическая связь между основными классами органических соединений
Генетическая связь между основными классами органических соединений Химический состав растений
Химический состав растений Chimie bioorganique
Chimie bioorganique Энергетическое топливо
Энергетическое топливо Реферат по химии на тему
Реферат по химии на тему Интересные свойства редких металлов
Интересные свойства редких металлов Презентация по Химии "Д.И.Менделеев" - скачать смотреть
Презентация по Химии "Д.И.Менделеев" - скачать смотреть  Ископаемое сырье органической химии
Ископаемое сырье органической химии Решаем задачи «Домашняя аптечка» Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск
Решаем задачи «Домашняя аптечка» Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск Электролиз
Электролиз Химические волокна Ацетатное волокно Подготовила: ученица 11 класса Гориславец Дарья
Химические волокна Ацетатное волокно Подготовила: ученица 11 класса Гориславец Дарья  Элементы нелинейного функционального анализа
Элементы нелинейного функционального анализа Галогены. Физические свойства
Галогены. Физические свойства Стеклянные товары. Основные сырьевые материалы для производства стекла
Стеклянные товары. Основные сырьевые материалы для производства стекла Коллигативные свойства растворов
Коллигативные свойства растворов Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню
Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню Основные понятия органической химии
Основные понятия органической химии Этот многоликий цинк
Этот многоликий цинк Наноматериалы. Каталитические свойства
Наноматериалы. Каталитические свойства Обмен углеводов
Обмен углеводов Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона Вода та її властивості
Вода та її властивості Кремний
Кремний Островные силикаты (Орто)
Островные силикаты (Орто) Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Омыляемые липиды
Омыляемые липиды Биологически важные химические элементы. Неорганические соединения
Биологически важные химические элементы. Неорганические соединения