Содержание
- 2. Содержание История происхождения кальция Строение атома Физические свойства Химические свойства Получение Применение Биологическая роль кальция
- 3. Строение атома В периодической таблице химических элементов Д. И. Менделеева кальций Са расположен в 4-м периоде
- 4. История происхождения кальция Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий
- 5. Физические свойства По физическим свойствам: кальций — металл серебристо-белого цвета, относительно легкий (плотность р = 1,54),
- 6. Химические свойства Кальций реагирует с водяными парами : 2Са + О2 = 2СаО Кальций реагирует с
- 7. Получение Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из
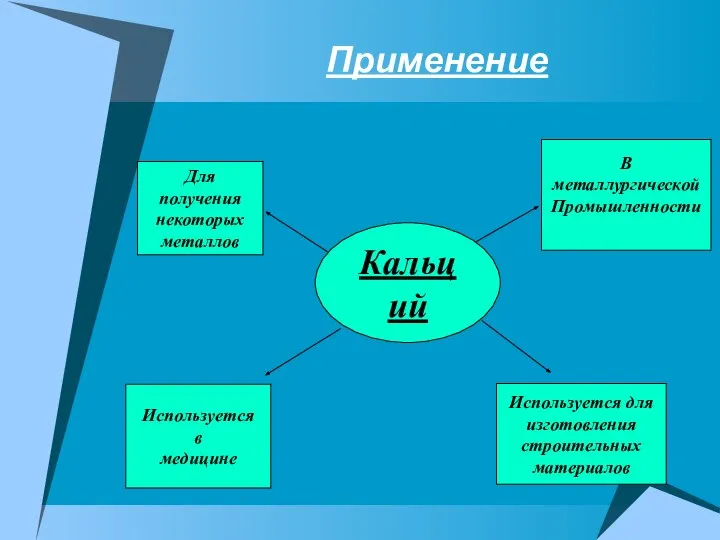
- 8. Применение Кальций Для получения некоторых металлов В металлургической Промышленности Используется в медицине Используется для изготовления строительных
- 9. Биологическая роль кальция Кальций поддерживает нормальный сердечный ритм, как и магний, кальций способствует здоровью сердечно-сосудистой системы
- 11. Скачать презентацию







 Строение атома Подготовка к ЕГЭ
Строение атома Подготовка к ЕГЭ Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть
Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть  Фосфор – тіршілік пен ақыл – ой элементі
Фосфор – тіршілік пен ақыл – ой элементі Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна
Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна  Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств
Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности
Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности Фосге́н (дихлорангидрид угольной кислоты)
Фосге́н (дихлорангидрид угольной кислоты) Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Алканы
Алканы Урок-упражнение по веществам
Урок-упражнение по веществам Фенол 10 класс - Презентация по Химии
Фенол 10 класс - Презентация по Химии Все технико-экономические показатели производства определяются на основе материального баланса.
Все технико-экономические показатели производства определяются на основе материального баланса. Кристаллдық және аморфтық күй
Кристаллдық және аморфтық күй Резеңке. Каучук
Резеңке. Каучук Презентация по химии выполнили ученицы 8а класса Соболева Екатерина Кудаева Кристина Учитель Полянская И.В.
Презентация по химии выполнили ученицы 8а класса Соболева Екатерина Кудаева Кристина Учитель Полянская И.В.  Графен. Классические и квантовые низкоразмерные системы. Ковалентная химическая связь: σ- и π-электроны
Графен. Классические и квантовые низкоразмерные системы. Ковалентная химическая связь: σ- и π-электроны Приборы для измерения температуры
Приборы для измерения температуры Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4)
Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4) Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Фосфорное сырье. Применение и обогащение фосфорного сырья
Фосфорное сырье. Применение и обогащение фосфорного сырья Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений