Содержание
- 2. ИСТОРИЧЕСКАЯ СПРАВКА С ДРЕВНЕЙШИХ ВРЕМЕН ИСПОЛЬЗОВАЛИ УКСУС, ОБРАЗУЮЩИЙСЯ ПРИ СКИСАНИИ ВИНА, ЛИСТЬЯ ЩАВЕЛЯ, СТЕБЛИ РЕВЕНЯ, СОК
- 3. КТО ПОЛУЧИЛ КИСЛОТЫ? УКСУСНАЯ КИСЛОТА СН3СООН – ИЗВЕСТНА С 8 ВЕКА БЕЗВОДНАЯ УКСУСНАЯ КИСЛОТА – 1789Г.,
- 4. МУРАВЬИНАЯ КИСЛОТА 16 ВЕК – ОБНАРУЖЕНО, ЧТО «КИСЛЫЙ ПАР» ИЗ МУРАВЕЙНИКОВ ИЗМЕНЯЕТ ЦВЕТ РАСТИТЕЛЬНЫХ КРАСИТЕЛЕЙ НА
- 5. КАРЛ ВИЛЬГЕЛЬМ ШЕЕЛЕ КОНЕЦ 18 ВЕКА – ВЫДЕЛИЛ И ОПИСАЛ ЛИМОННУЮ, МОЛОЧНУЮ, БЕНЗОЙНУЮ, ЩАВЕЛЕВУЮ И ДРУГИЕ
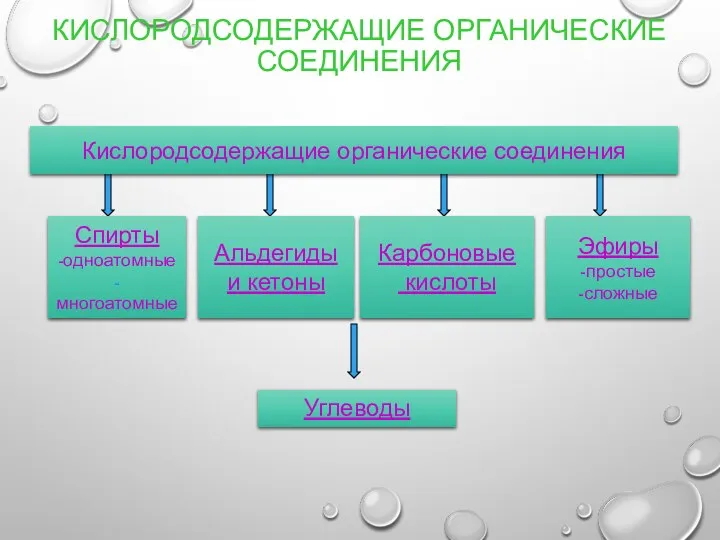
- 6. КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Спирты -одноатомные -многоатомные Альдегиды и кетоны Кислородсодержащие органические соединения Карбоновые кислоты Эфиры -простые
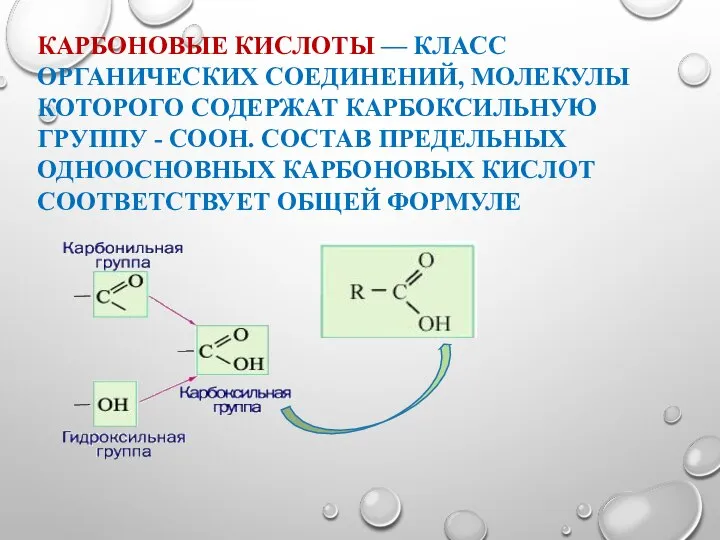
- 7. КАРБОНОВЫЕ КИСЛОТЫ — КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, МОЛЕКУЛЫ КОТОРОГО СОДЕРЖАТ КАРБОКСИЛЬНУЮ ГРУППУ - COOH. СОСТАВ ПРЕДЕЛЬНЫХ ОДНООСНОВНЫХ
- 8. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ В зависимости от числа карбоксильных групп Одноосновные Двухосновные (уксусная) (щавелевая) СН3С С -
- 9. Номенклатура IUPAC для карбоновых кислот Главную цепь выбирают таким образом, чтобы атом углерода карбоксильной группы оказался
- 10. СН3 – СООН 1 2 ЭТАНОВАЯ КИСЛОТА (УКСУСНАЯ КИСЛОТА) СН3 – СН2 – СН2 - СООН
- 11. СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАНОВАЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) 1 2 3
- 13. Алгоритм названия карбоновых кислот: 1. Находим главную цепь атомов углерода и нумеруем её, начиная с карбоксильной
- 14. : 1. Выделить корень слова на основании, которого записать углеродный скелет в состав, которого входит карбоксильная
- 15. ФИЗИЧЕСКИЕ СВОЙСТВА С1 – С3 Жидкости с характерным резким запахом, хорошо растворимые в воде С4 –
- 16. Агрегатное состояние жидкое Цвет бесцветная прозрачная жидкость Запах резкий уксусный Растворимость в воде хорошая Температура кипения
- 17. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ І. Общие с неорганическими кислотами Растворимые карбоновые кислоты в водных растворах диссоциируют:
- 18. 3.Взаимодействие с основными оксидами: 2 СН3 – СООН + СuО Уксусная кислота t (СН3 – СОО)2Сu
- 19. Специфические свойства муравьиной кислоты Реакция «Серебряного зеркала» Н- С О ОН + Ag2O t 2Ag +
- 20. ПРИМЕНЕНИЕ МУРАВЬИНОЙ КИСЛОТЫ Муравьиная кислота обладает ярко выраженными бактерицидными свойствами. Поэтому ее водные растворы используют как:
- 21. ВОПРОС: ПОЧЕМУ НЕЛЬЗЯ СМАЧИВАТЬ ВОДОЙ МЕСТО МУРАВЬИНОГО УКУСА ИЛИ ОЖОГА КРАПИВОЙ? ЭТО ПРИВОДИТ ТОЛЬКО К УСИЛЕНИЮ
- 22. Уксусная кислота (этановая кислота) Это – первая кислота, полученная и использованная человеком. «Родилась» более 4 тыс.лет
- 23. ПРИМЕНЕНИЕ УКСУСНОЙ КИСЛОТЫ - Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E-
- 24. Карбо- новые кислоты в порядке увеличе- ния их кислот- ности
- 25. ЗАДАНИЕ
- 27. Скачать презентацию






















 Единый государственный экзамен по ХИМИИ (консультация 2) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 2) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР История развития биохимического знания и биохимии как науки
История развития биохимического знания и биохимии как науки Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены
Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений Биоорганическая химия
Биоорганическая химия Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове
Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове  Строение гетероциклических соединений
Строение гетероциклических соединений МЕТАЛЛЫ диктант 9 класс
МЕТАЛЛЫ диктант 9 класс  Основные породы. Классификация основных пород
Основные породы. Классификация основных пород Общая фармакология
Общая фармакология Хром
Хром Презентация по Химии "Жёсткость воды" - скачать смотреть
Презентация по Химии "Жёсткость воды" - скачать смотреть  Аэробное окисление углеводов
Аэробное окисление углеводов Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) История каучука
История каучука Химическая музыка
Химическая музыка Строение атома
Строение атома Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Синтез нанослоев неорганических веществ методами ионно-коллоидного и коллоидного наслаивания. (Лекция 10)
Синтез нанослоев неорганических веществ методами ионно-коллоидного и коллоидного наслаивания. (Лекция 10) Масс-спектрометрия (МС)
Масс-спектрометрия (МС) Презентация по Химии "Скло Будівельний матеріал" - скачать смотреть бесплатно
Презентация по Химии "Скло Будівельний матеріал" - скачать смотреть бесплатно Распределительная хроматография
Распределительная хроматография Поверхностные явления. Адсорбция. (Лекция 1)
Поверхностные явления. Адсорбция. (Лекция 1) Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Ауа. Ауаның құрамы №1 көрсетілім «Ауа мен оттегіде жану реакциясы»
Ауа. Ауаның құрамы №1 көрсетілім «Ауа мен оттегіде жану реакциясы» Круговорот химических веществ в природе Выполнила: Подсыпанина Наташа Ученица: 10 «А» класса Учитель: Макарова Е. И.
Круговорот химических веществ в природе Выполнила: Подсыпанина Наташа Ученица: 10 «А» класса Учитель: Макарова Е. И. А. Общая характеристика подгруппы углерода: Подгруппа углерода - главная подгруппа IV группы, которую составляют углерод-С. к
А. Общая характеристика подгруппы углерода: Подгруппа углерода - главная подгруппа IV группы, которую составляют углерод-С. к Introduction to metabolism
Introduction to metabolism