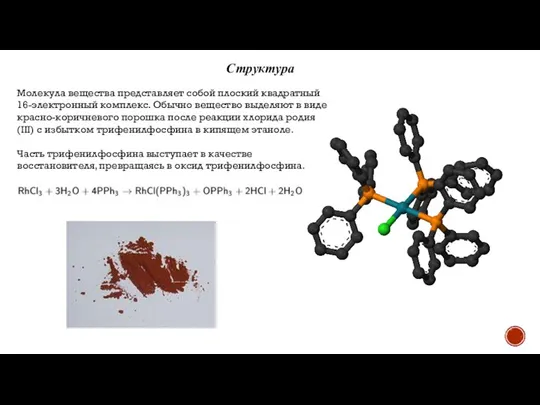
Применение
Катализатор Уилкинсона используют как катализатор для гидрования.
Гидри́рование химическая реакция, включающая
присоединение водорода к органическому веществу. В ходе данной реакции молекула водорода присоединяется к двойной или тройной связи молекулы.
Гидрирование находится в равновесии с обратным процессом дегидрирования и является сильно экзотермическим процессом (105—125 кДж на 1 моль водорода). Согласно принципу Ле Шателье, такое равновесие должно смещаться вправо при понижении температуры, поэтому в промышленных реакциях иногда ограничивают температуру, повышающуюся из-за экзотермичности реакции
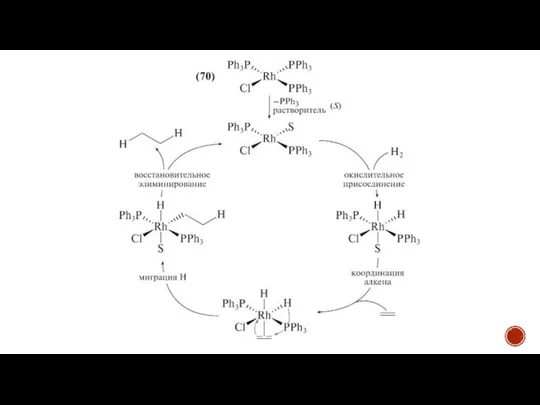
При гомогенном катализе водород и гидрируемое вещество координируются внутри каталитического комплекса. При этом водород диссоциирует, за счёт чего и происходит его активация.



 Адсорбция
Адсорбция Уран. Применение. Ядерное топливо
Уран. Применение. Ядерное топливо Липиды. Биосинтез
Липиды. Биосинтез Инструментальные методы анализа
Инструментальные методы анализа Презентация по химии Гидролиз
Презентация по химии Гидролиз  Бериллий: основные свойства, технологии получения, применение
Бериллий: основные свойства, технологии получения, применение Математический аппарат квантовой механики
Математический аппарат квантовой механики Пәнге кіріспе. Жалпы технологиялық түсініктер мен терминдер. Өнеркәсіптік регламент негізгі нормативті-техникалық құжат ретінде
Пәнге кіріспе. Жалпы технологиялық түсініктер мен терминдер. Өнеркәсіптік регламент негізгі нормативті-техникалық құжат ретінде Вещества
Вещества Висбрекинг (перспективный процесс ТК)
Висбрекинг (перспективный процесс ТК) Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Цветные металлы
Цветные металлы Оксиген як хімічний елемент
Оксиген як хімічний елемент Фильтрование. Лекция 5
Фильтрование. Лекция 5 Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.
Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.  Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Природные Источники
Природные Источники  Серная кислота
Серная кислота Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Буферные системы. Классификация буферных растворов
Буферные системы. Классификация буферных растворов Современные материалы как основа бизнеса
Современные материалы как основа бизнеса Квантовая химия
Квантовая химия Химические свойства металлов Урок химии в 11 классе
Химические свойства металлов Урок химии в 11 классе Титан. Нахождение в природе
Титан. Нахождение в природе История одного металла. Медь и её сплавы.
История одного металла. Медь и её сплавы.  Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Основы строения органических соединений. Теория строения органических соединений
Основы строения органических соединений. Теория строения органических соединений Тагер. Физико-химия полимеров
Тагер. Физико-химия полимеров