Содержание
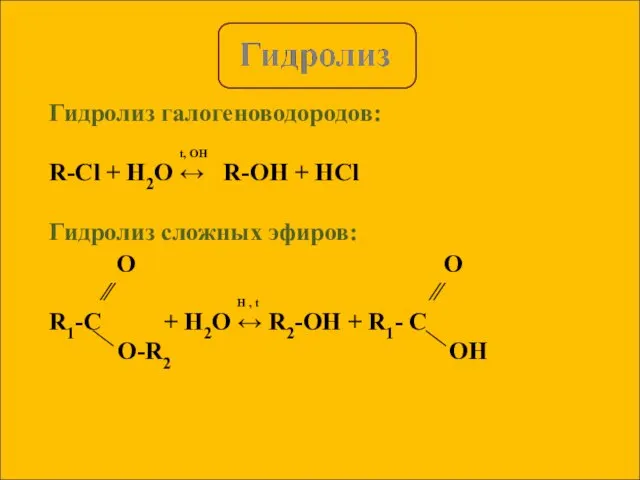
- 4. Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H
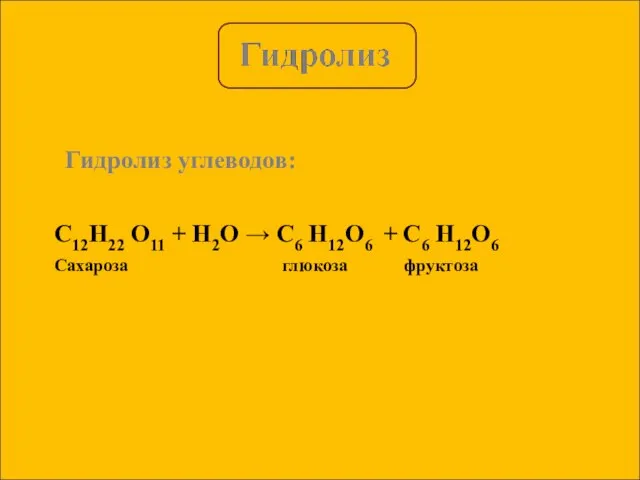
- 5. Гидролиз углеводов: C12H22 O11 + H2O → C6 H12O6 + C6 H12O6 Сахароза глюкоза фруктоза
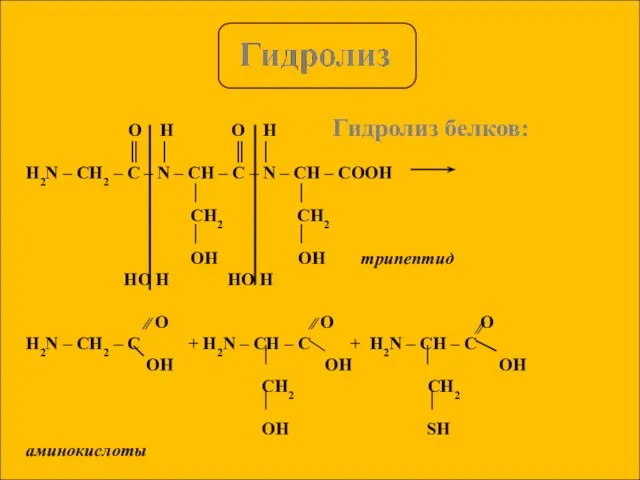
- 6. Гидролиз белков: O H O H ║ │ ║ │ H2N – CH2 – C –
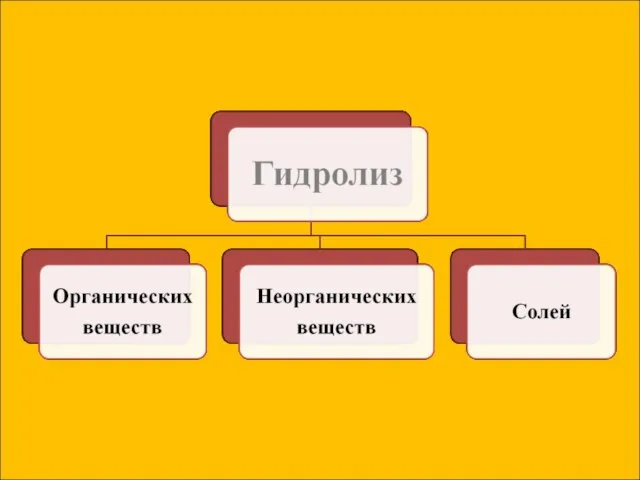
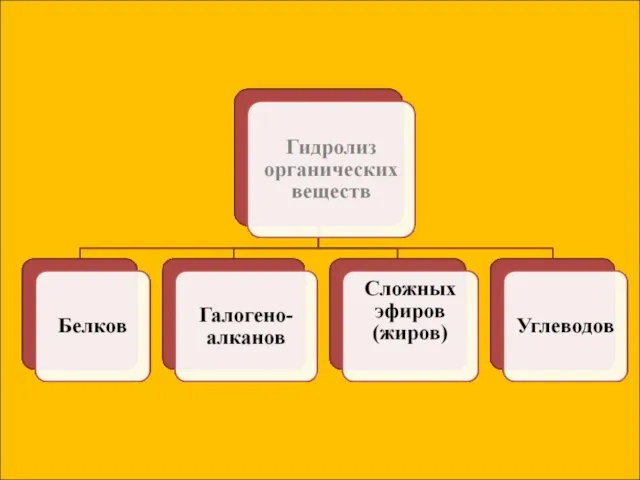
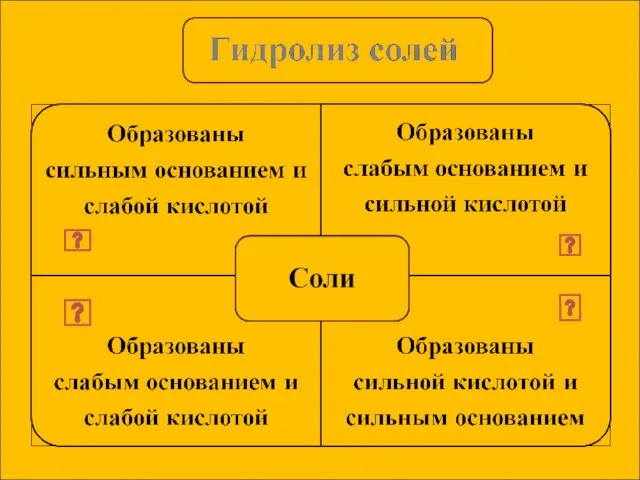
- 7. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате
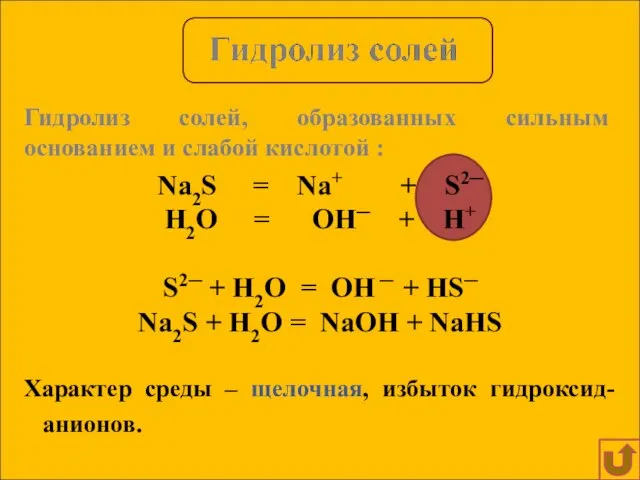
- 9. Na2S = Na+ + S2─ H2O = OH─ + H+ S2─ + H2O = OH ─
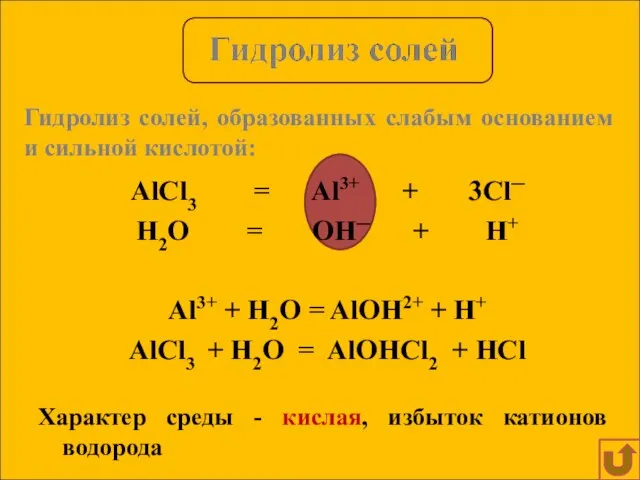
- 10. AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ +
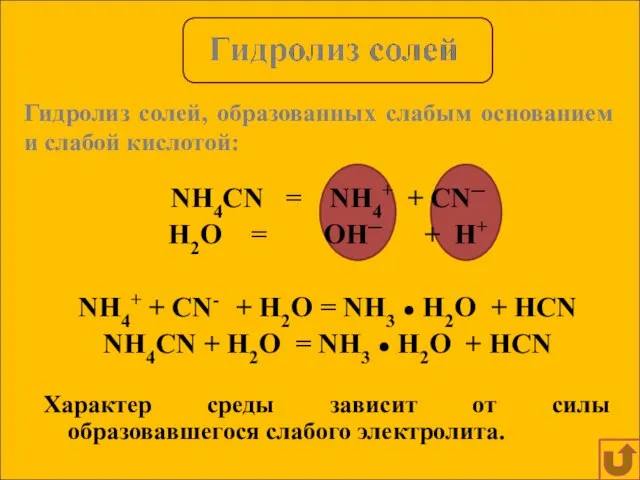
- 11. NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O =
- 12. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: Например, соли, которые нельзя получить реакцией обмена
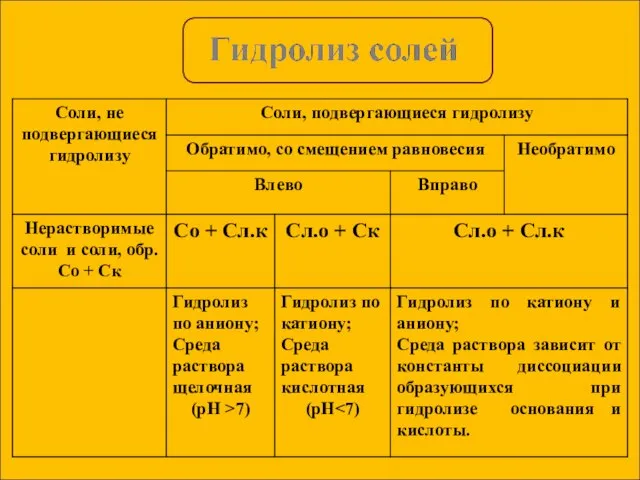
- 13. KCl = K+ + Cl- Слабых ионов нет, гидролиз не идет, среда нейтральная. Гидролиз солей, образованных
- 15. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье). Усилить гидролиз соли можно следующими способами: Добавить
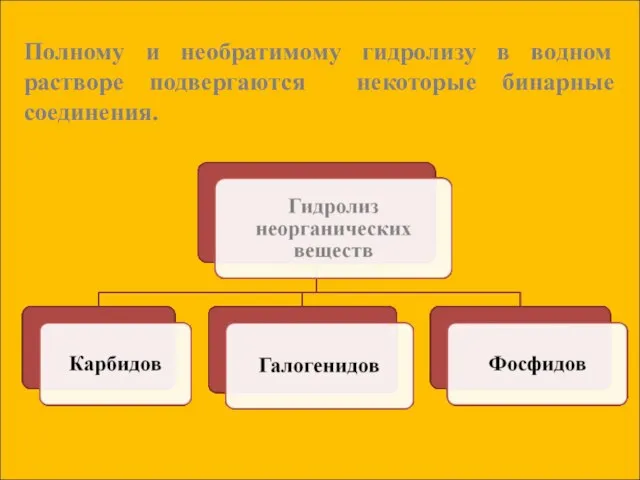
- 16. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
- 17. Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O
- 18. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов:
- 19. Роль гидролиза: В природе: преобразование земной коры; обеспечение слабощелочной среды морской воды. В народном хозяйстве: порча
- 20. Гидратация Присоединение молекул воды к молекулам без разложения на новые вещества
- 21. Гидратация алканов H2SO4 CH2=CH–CH3+HOH → CH3–CH–CH3 OH – H2SO4 Где больше водородов туда водород при разрыве
- 22. Дегидратация спиртов H2SO4 CH3–CH–CH2–CH3 → CH3–CH=CH–CH3 H2SO4 OH – -H2O У какого близ стоящего углерода меньше
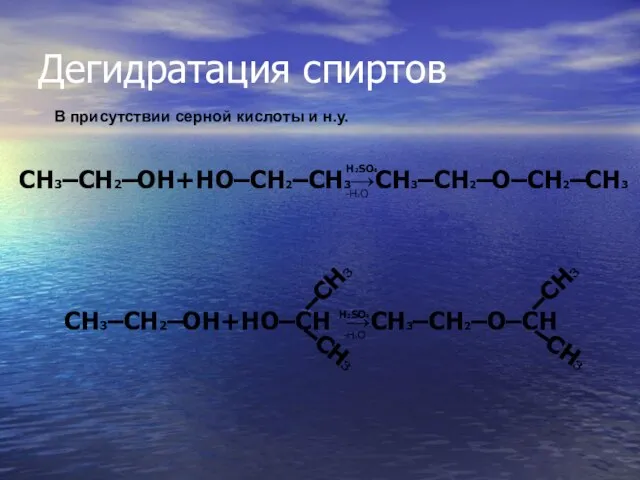
- 23. Дегидратация спиртов H2SO4 -H2O В присутствии серной кислоты и н.у. CH3–CH2–OH+HO–CH →CH3–CH2–O–CH –CH3 –CH3 –CH3 –CH3
- 24. Гидратация алкинов = O – H CH≡CH–CH3+HOH→CH2=CH–CH3 →CH2–C–CH3 = O HO – В OH гр кислород
- 25. Гидратация оксидов металов Ca=O+H2O↔Ca(OH)2 Ca=OMg=O+H2O↔Ca(OH)2MgO Ca=O Mg=O+2H2O↔Ca(OH)2 Mg(OH)2
- 26. Гидратация солей При гидратации бесцветного сульфата меди(II) последовательно образуются различные окрашенные кристаллогидраты, из которых выделены в
- 27. Кристализация солей При кристаллизации многих солей из их водных растворов молекулы воды входят в состав кристаллической
- 29. Скачать презентацию














 Газ тәрізді диэлектриктер. Пропан
Газ тәрізді диэлектриктер. Пропан Алкадиены
Алкадиены Химические реакторы
Химические реакторы Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Угольная кислота и её соли
Угольная кислота и её соли Металлы. Физические и химические свойства
Металлы. Физические и химические свойства Вредные вещества
Вредные вещества Состав тонких покрытий
Состав тонких покрытий Жири як компоненти їжі. Їхня роль в організмі
Жири як компоненти їжі. Їхня роль в організмі  Металлы s-семейства
Металлы s-семейства Дисахариды и полисахариды
Дисахариды и полисахариды Характеристика и технология производства основных катализаторов нефтепереработки
Характеристика и технология производства основных катализаторов нефтепереработки Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть
Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть  Хром. Физические и химические свойства
Хром. Физические и химические свойства Особенности строения, реакционной способности и методы синтеза карбонилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза карбонилсодержащих соединений Предельные углеводороды
Предельные углеводороды Метод изолирования Васильевой
Метод изолирования Васильевой Базиты. Химический состав
Базиты. Химический состав α – амин қышқылдары. Пептидтер. Ақуыздар
α – амин қышқылдары. Пептидтер. Ақуыздар Спирт µндіру технологиясы
Спирт µндіру технологиясы Защита населения от воздействия аварийно химически опасных веществ
Защита населения от воздействия аварийно химически опасных веществ Использование методических приёмов ТРКМ на уроке химии по теме: «Простые вещества: металлы и неметаллы» 8 класс
Использование методических приёмов ТРКМ на уроке химии по теме: «Простые вещества: металлы и неметаллы» 8 класс  Углерод – химический элемент и простое вещество
Углерод – химический элемент и простое вещество Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Периодическая система Д.И. Менделеева (Занятие 3)
Периодическая система Д.И. Менделеева (Занятие 3) Строение атома
Строение атома Химический элемент медь
Химический элемент медь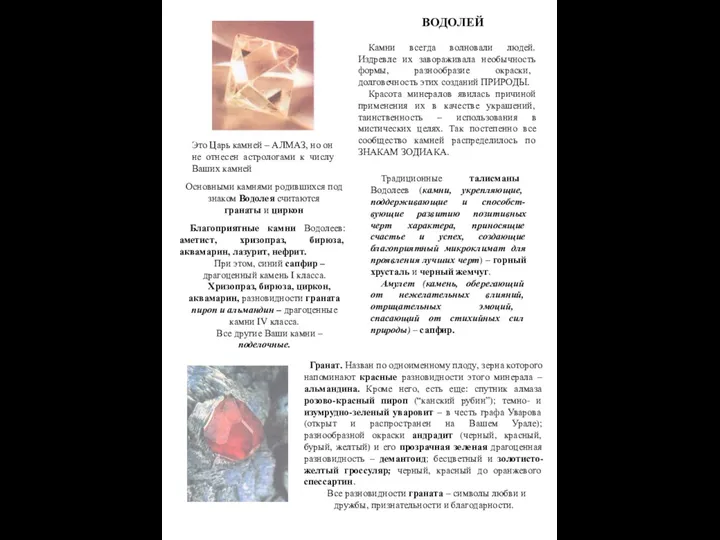 Камни и Водолей
Камни и Водолей