Содержание
- 2. К кислородсодержащим органическим соединениям относят многочисленные органические соединения, как природного происхождения, так и синтетические, являющиеся производными
- 3. Остальные валентности углерода могут участвовать в образовании связи либо с углеродными атомами, либо с атомами водорода
- 4. Спирты и их производные Производные углеводородов, представляющие собой продукты замещения атома водорода в углеводородной молекуле водным
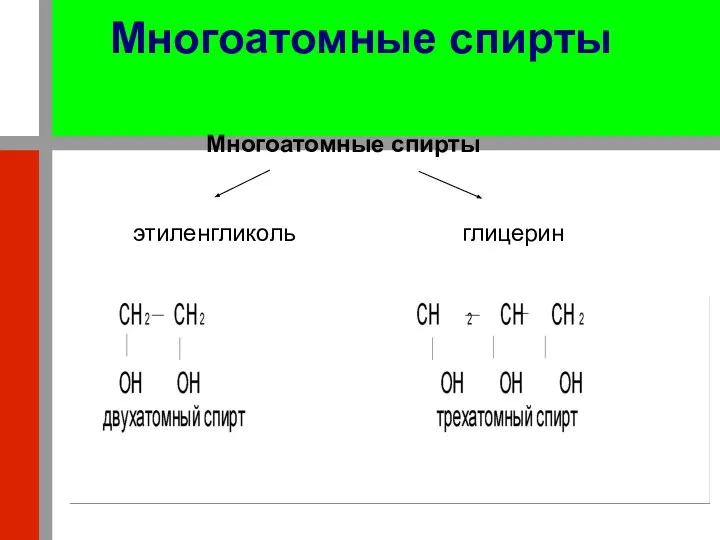
- 5. Спирты могут содержать и несколько гидроксильных групп но при разных атомах углерода. Число их характеризует атомность
- 6. Строение. Изомерия. Изомерия предельных одноатомных спиртов, общая формула которых CnH2n+1OH, обусловлена изомерией углеродного скелета и изомерией
- 7. Из бутана и изобутана могут быть произведены четыре изомерных бутиловых спирта. В зависимости от положения гидроксильной
- 8. Химические свойства Химические свойства спиртов обусловлены наличием гидроксильной группы. В разнообразных химических превращениях спиртов особая роль
- 9. Кислотные свойства спиртов. Атомы водорода гидроксильных групп в спиртах проявляют определённую подвижность. Подобно воде, спирты реагируют
- 10. По мере увеличения числа углеродных атомов в углеводородных радикалах спиртов активность последних в этой реакции всё
- 11. Окисление спиртов. Кислород воздуха окисляет спирты только при высокой температуре; при этом они горят. В результате
- 12. Большая склонность спиртов к окислению по сравнению с углеводородами объясняется влиянием имеющейся в их молекулах гидроксильной
- 13. При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, окисление третичных спиртов сопровождается разрывом углеродной цепи.
- 14. Дегидратация спиртов. Дегидратация (отнятие воды от молекулы спирта) приводит к образованию этиленовых углеводородов или простых эфиров.
- 15. Внутримолекулярная дегидратация, т.е. за счёт одной молекулы спирта, приводит к образованию этиленового углеводорода:
- 16. Образование сложных эфиров. Взаимодействие спиртов с кислотами (органическими и неорганическими) приводит к образованию производных кислот, называемых
- 17. Способы получения Гидролиз галогеналканов. При действии на галогеналкилы воды в присутствии щелочей происходит реакция гидролиза, в
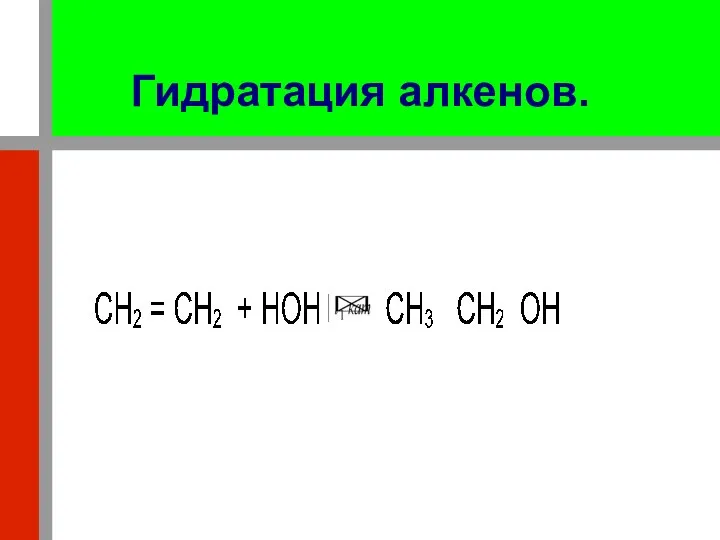
- 18. Гидратация алкенов. При нагревании в присутствии катализаторов (хлорид цинка, серная кислота) элементы воды (водород и гидроксил)
- 19. С гомологоми этилена реакция протекает по правилу Марковникова. Например:
- 20. Восстановление альдегидов и кетонов. При действии водорода в момент выделения (H) на карбонильные соединения альдегиды восстанавливаются
- 21. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности
- 22. Многоатомные спирты Многоатомные спирты этиленгликоль глицерин
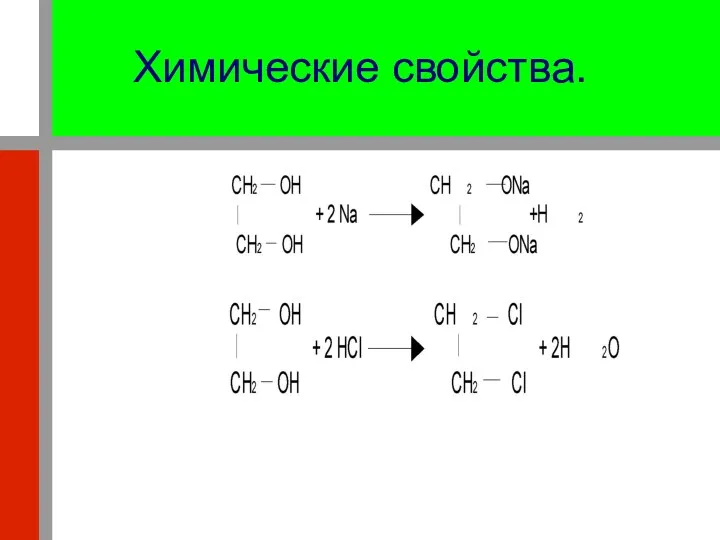
- 23. Химические свойства. 1. Реагируют со щелочными металлами: 2. Реагируют с галогеноводородами:
- 25. Скачать презентацию



















 Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Конкурс проектных работ «Химический элемент … – и это все о нем»
Конкурс проектных работ «Химический элемент … – и это все о нем» Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу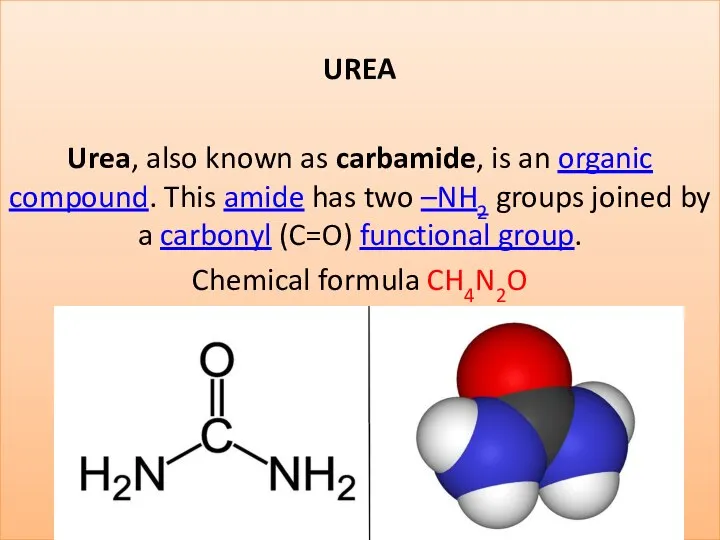 Urea (carbamide)
Urea (carbamide) Процессы минералообразования
Процессы минералообразования Предельные одноатомные спирты
Предельные одноатомные спирты  Занимательные опыты по химии
Занимательные опыты по химии Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Дифференциация магмы
Дифференциация магмы Элементы кристаллохимии
Элементы кристаллохимии Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1
Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1 “B” (бор) как химический элемент
“B” (бор) как химический элемент Металлы в природе
Металлы в природе Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Термохимия. Расчетные задачи. (Лекция 4.2)
Термохимия. Расчетные задачи. (Лекция 4.2)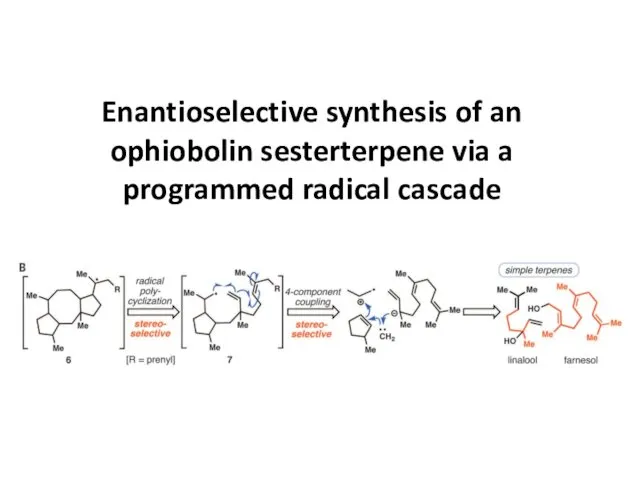 Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Металлы и их соединения
Металлы и их соединения Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Тайна Е-621" - скачать смотреть
Презентация по Химии "Тайна Е-621" - скачать смотреть  Методические рекомендации по изучению курса «Коррозия и защита металлов»
Методические рекомендации по изучению курса «Коррозия и защита металлов» Применение этанола
Применение этанола Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы
Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы Презентация по Химии "Галогены" - скачать смотреть
Презентация по Химии "Галогены" - скачать смотреть