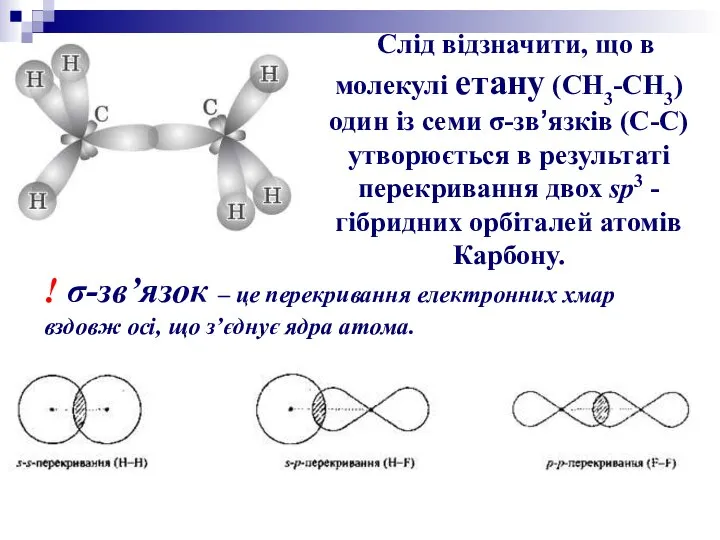
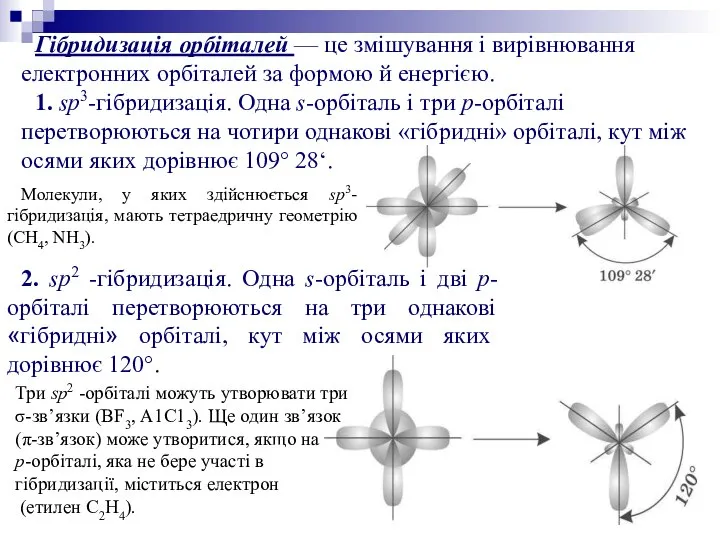
Гібридизація орбіталей — це змішування і вирівнювання електронних орбіталей за формою
й енергією.
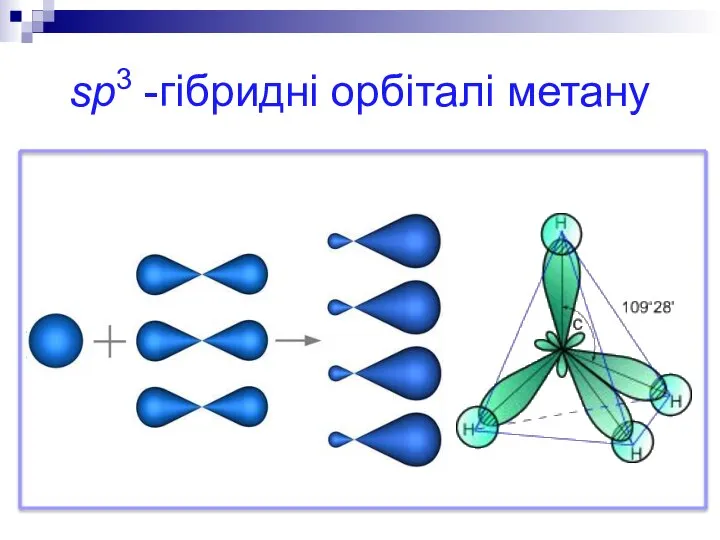
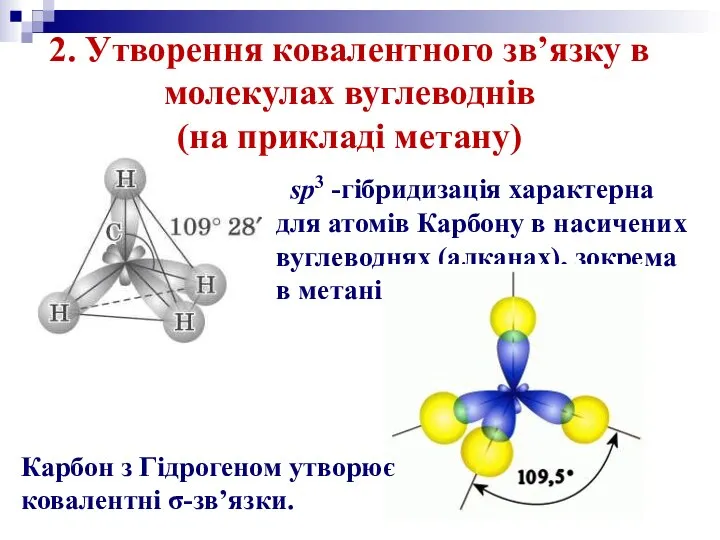
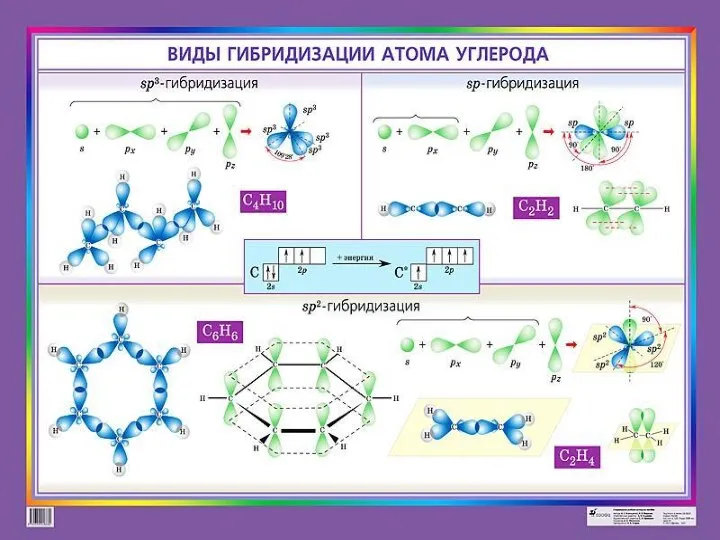
1. sp3-гібридизація. Одна s-орбіталь і три р-орбіталі перетворюються на чотири однакові «гібридні» орбіталі, кут між осями яких дорівнює 109° 28‘.
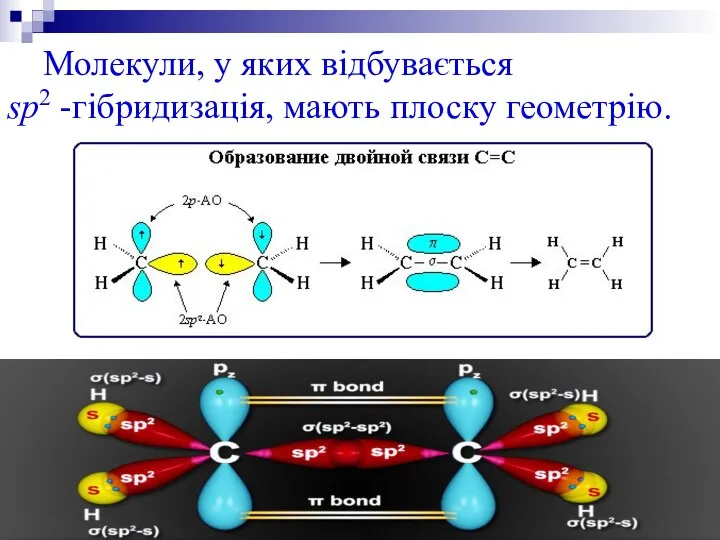
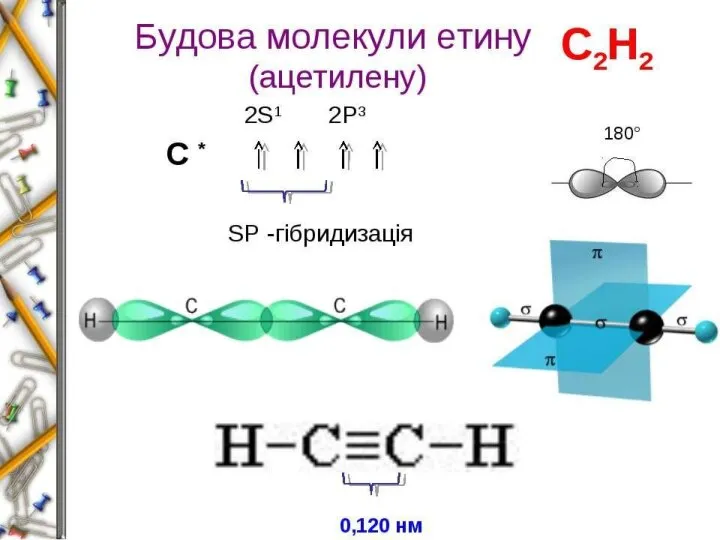
2. sp2 -гібридизація. Одна s-орбіталь і дві р-орбіталі перетворюються на три однакові «гібридні» орбіталі, кут між осями яких дорівнює 120°.
Молекули, у яких здійснюється sp3-гібридизація, мають тетраедричну геометрію (СН4, NH3).
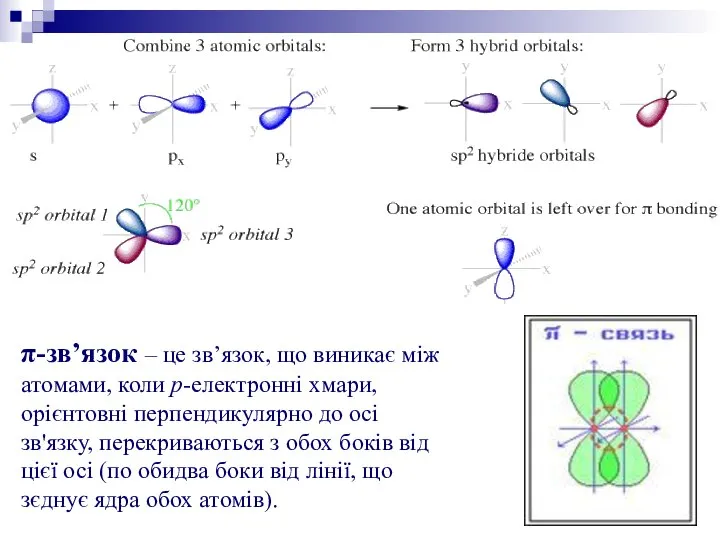
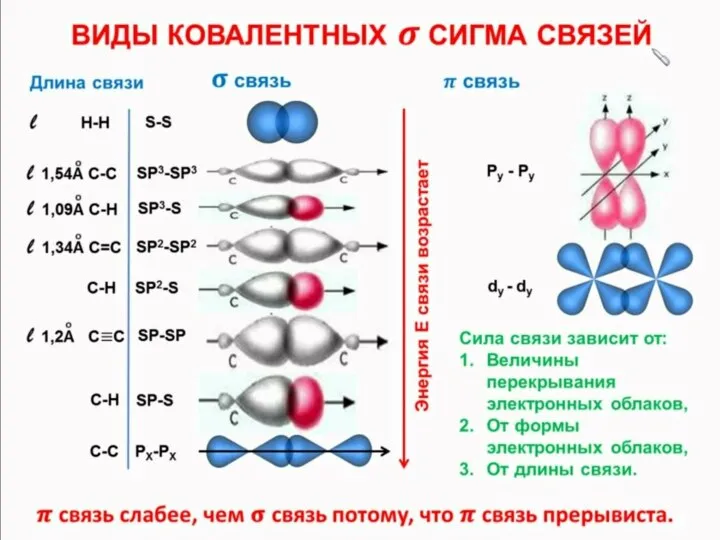
Три sp2 -орбіталі можуть утворювати три
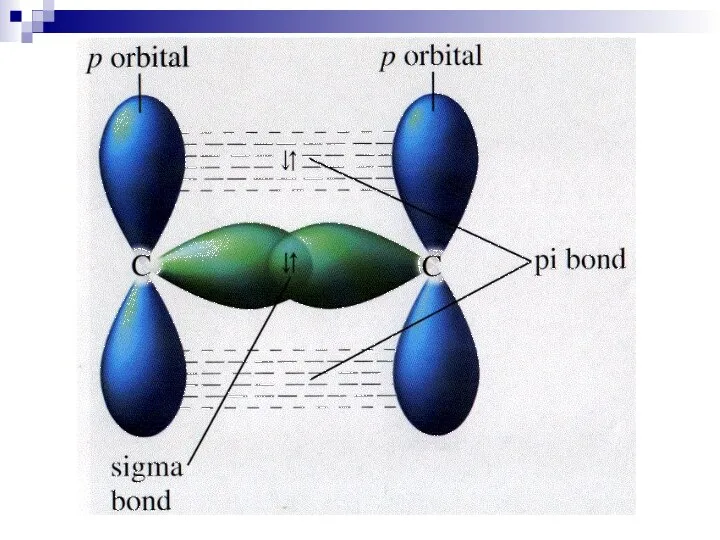
σ-зв’язки (BF3, А1С13). Ще один зв’язок
(π-зв’язок) може утворитися, якщо на
р-орбіталі, яка не бере участі в гібридизації, міститься електрон
(етилен С2Н4).



 Валентность
Валентность Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии
Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии Органикалық қосылыстардың жіктелуі
Органикалық қосылыстардың жіктелуі Сопряженное присоединение. Циклоприсоединениеie
Сопряженное присоединение. Циклоприсоединениеie Номенклатура органических соединений
Номенклатура органических соединений Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Применение солей
Применение солей  Классы неорганических соединений. Индивидуальные задания
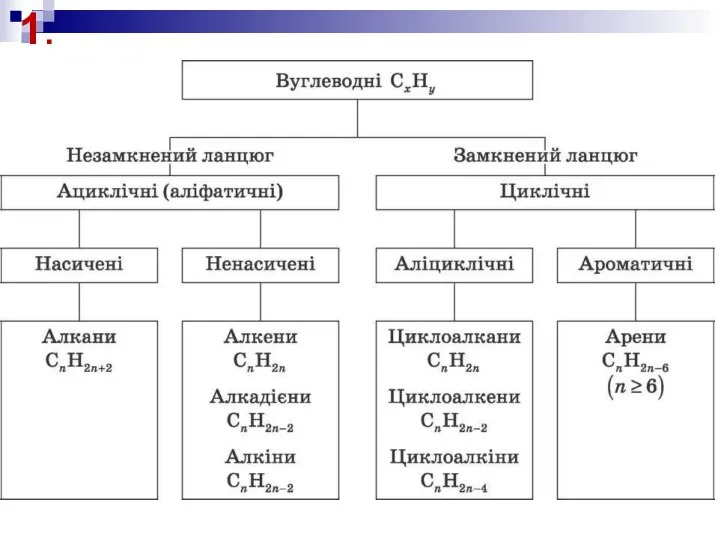
Классы неорганических соединений. Индивидуальные задания Углеводороды. Свойства алканов
Углеводороды. Свойства алканов Ртуть. Нахождение в природе. Применение
Ртуть. Нахождение в природе. Применение Химические компоненты клетки. Неорганические компоненты
Химические компоненты клетки. Неорганические компоненты Презентация по Химии "Синтетические материалы" - скачать смотреть
Презентация по Химии "Синтетические материалы" - скачать смотреть  Мило. Мийні засоби
Мило. Мийні засоби  Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет
Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет Горные породы: гранит, базальт
Горные породы: гранит, базальт Хочу хорошо сдать ЕГЭ
Хочу хорошо сдать ЕГЭ Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей
Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей  Подготовка к лабораторной работе
Подготовка к лабораторной работе Фосфор, фосфор оксидтері
Фосфор, фосфор оксидтері Биохимия печени
Биохимия печени Презентація на тему : Застосування Сполук Алюмінію Підготував : Учень 10 класу Кійко Едуард
Презентація на тему : Застосування Сполук Алюмінію Підготував : Учень 10 класу Кійко Едуард  Классификация минералов
Классификация минералов Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид
Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид Силикатная промышленность Подготовила ученица 9 А класса Семёнова Екатерина
Силикатная промышленность Подготовила ученица 9 А класса Семёнова Екатерина Сульфиды и им подобные соединения
Сульфиды и им подобные соединения Текстуры метаморфических пород
Текстуры метаморфических пород Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические