Содержание
- 2. Задачи урока: Расширить и углубить знания о химических реакциях, сравнить их с другими видами явлений. Научиться
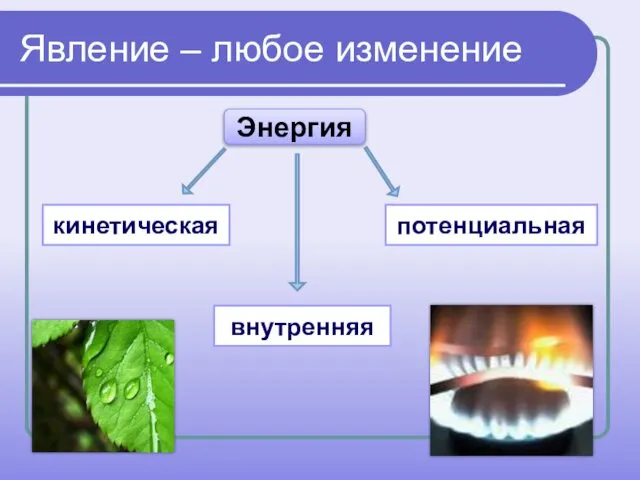
- 3. Явление – любое изменение Энергия кинетическая внутренняя потенциальная
- 4. К каким явлениям относятся данные превращения?
- 5. Химическая реакция (или химическое явление) это процесс, в результате которого из одних веществ образуются другие вещества,
- 6. Будут ли данные реакции химическими? 7N + 2Не 1 Н + 8О 92U + 0 n
- 7. Назовите химические процессы: Скисание молока. Горение свечи. Измельчение куска мела. Испарение воды. Ржавление железа Брожение виноградного
- 8. Признаки химических реакций изменение цвета образование(растворение) осадка изменение запаха выделение (поглощение) энергии выделение газа
- 9. Сущность химических процессов Разрыв химических связей в реагентах. Возникновение новых связей в продуктах реакции. Получение готового
- 10. Найдите правильную запись химического процесса: СН4 = С + Н2 NO + O2 = NO2 +Q
- 11. Историческая справка. В 1748 году сформулирован закон сохранения массы веществ «Все перемены, в натуре случающиеся, такого
- 12. Признаки классификации химических реакций Число и состав реагентов. Изменение степеней окисления элементов Направление процесса. Участие катализатора.
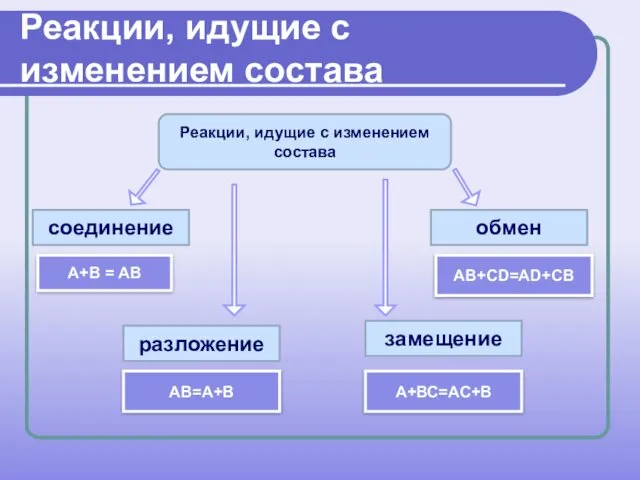
- 13. Реакции, идущие с изменением состава Реакции, идущие с изменением состава соединение А+В = АВ АВ=А+В А+ВС=АС+В
- 14. По изменению степеней окисления химических элементов Окислительно – восстановительные Окисление Восстановление Не окислительно- восстановительные ( С.
- 15. По направлению процесса Необратимые -реакции, протекающие в одном направлении.(→) Условия: Обратимые -реакции, протекающие в обоих направлениях.(↔)
- 16. По участию катализатора Каталитические - Катализатор - Ингибитор Некаталитические
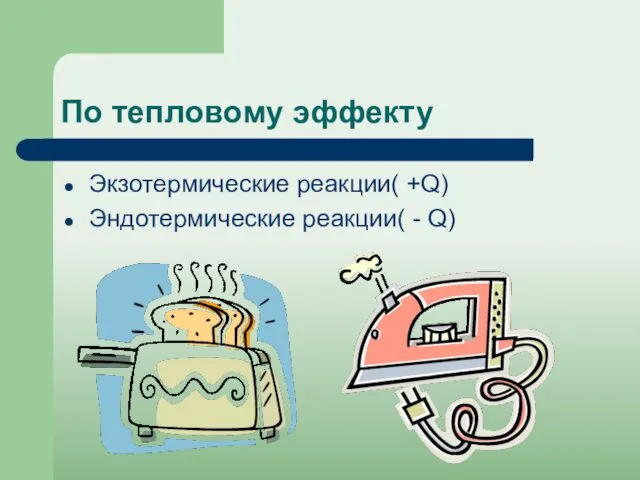
- 17. По тепловому эффекту Экзотермические реакции( +Q) Эндотермические реакции( - Q)
- 18. По фазовому составу Гомогенный процесс Гетерогенный процесс
- 20. Скачать презентацию














 Хлорид калия KCI
Хлорид калия KCI The ideal gas equation
The ideal gas equation Охорона довкілля від забруднення під час переробки нафти та кам’яного вугілля
Охорона довкілля від забруднення під час переробки нафти та кам’яного вугілля  Химическая очистка воды
Химическая очистка воды Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Металлы в нашей жизни Красноярск, гимназия №13
Металлы в нашей жизни Красноярск, гимназия №13 Галогены
Галогены The development of nanoporous hydrogen storages
The development of nanoporous hydrogen storages Физические и химические свойства меди
Физические и химические свойства меди Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Водород в природе
Водород в природе Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують  Физические и химические явления. Химические реакции
Физические и химические явления. Химические реакции Пиримидин. Оның туындылары
Пиримидин. Оның туындылары Ферментные электроды. (Лекция 7)
Ферментные электроды. (Лекция 7) Методика визначення механічних властивостей металів та сплавів
Методика визначення механічних властивостей металів та сплавів Решение задач по химической формуле
Решение задач по химической формуле Газообразное состояние вещества
Газообразное состояние вещества Презентация по Химии "Показатели воды: её жесткость и кислотность" - скачать смотреть
Презентация по Химии "Показатели воды: её жесткость и кислотность" - скачать смотреть  Графическое представление газовых процессов. (10 класс)
Графическое представление газовых процессов. (10 класс) Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно
Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно Shapes of molecules
Shapes of molecules Хлор. Отравления хлором
Хлор. Отравления хлором Своя игра на тему: «Физика и химия в медицине»
Своя игра на тему: «Физика и химия в медицине» Основные постулаты квантовой механики
Основные постулаты квантовой механики Карбоновые кислоты
Карбоновые кислоты Коррозия металлов. Виды коррозии металлов
Коррозия металлов. Виды коррозии металлов