Содержание
- 2. Карбоновые кислоты- класс органических соединений, молекулы которых содержат одну или несколько функциональных карбольсильных групп COOH –COOH
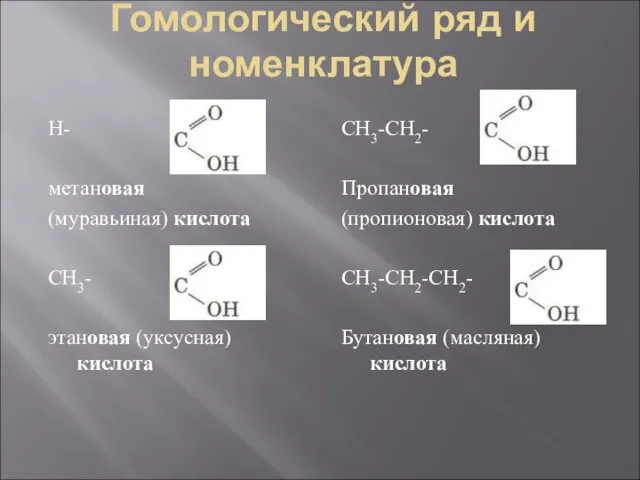
- 3. Гомологический ряд и номенклатура Н- метановая (муравьиная) кислота СН3- этановая (уксусная) кислота СН3-СН2- Пропановая (пропионовая) кислота
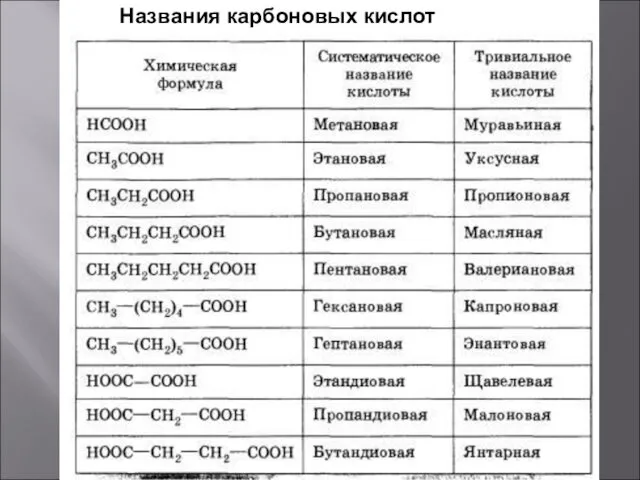
- 4. Названия карбоновых кислот
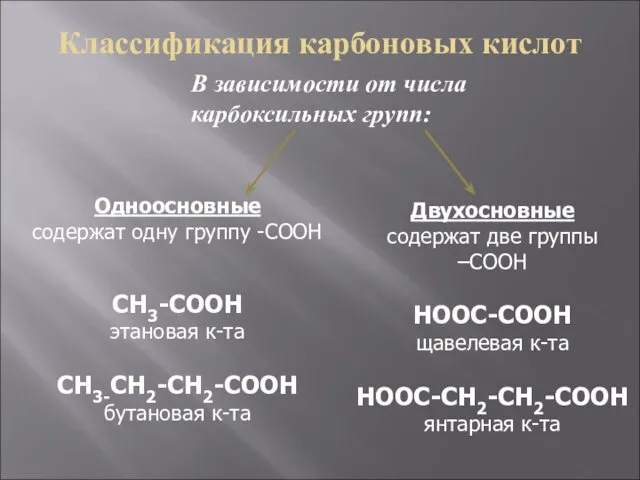
- 5. Классификация карбоновых кислот В зависимости от числа карбоксильных групп: Одноосновные содержат одну группу -COOH CH3-COOH этановая
- 6. В зависимости от строения радикала: Предельные – (производные алканов) Непредельные – (производные алкенов и других ненасыщенных
- 7. Номенклатура В систематической номенклатуре кислот действуют следующие правила: 1. Главная цепь должна начинаться и нумероваться с
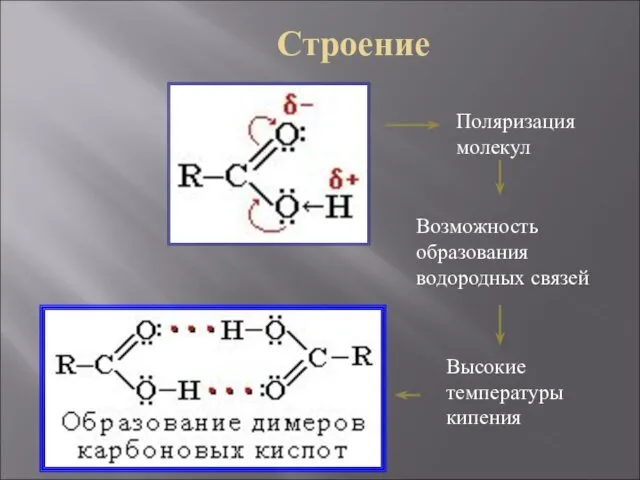
- 9. Строение Поляризация молекул Возможность образования водородных связей Высокие температуры кипения
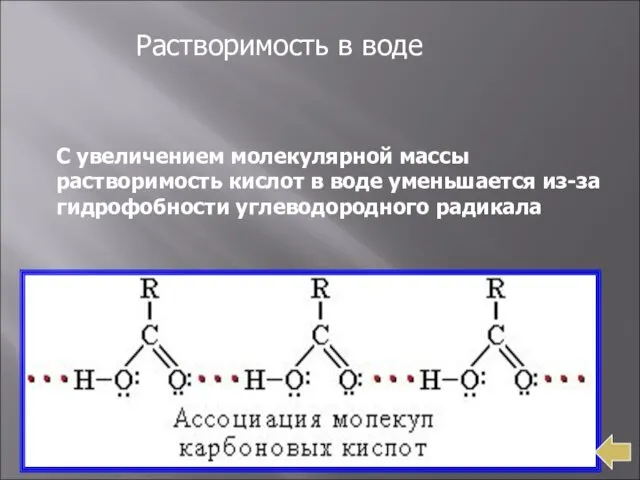
- 10. Растворимость в воде С увеличением молекулярной массы растворимость кислот в воде уменьшается из-за гидрофобности углеводородного радикала
- 11. Физические свойства легкоподвижные бесцветные жидкости, неограниченно смешиваются с водой, с характерным острым запахом . вязкие маслянистые
- 12. Химические свойства Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Из-за смещения электронной плотности от гидроксильной
- 13. Химические свойства 1) Взаимодействуют с активными металлами Mg + 2CH3COOH→(CH3COO)2Mg + H2 2) Взаимодействуют с основными
- 14. Сила карбоновых кислот С увеличением числа атомов углерода сила кислот убывает (из-за снижения полярности связи O-H).
- 15. Спасибо за внимание!
- 17. Скачать презентацию









 Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу
Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань  Массообменные процессы
Массообменные процессы Взаимосвязь обмена веществ
Взаимосвязь обмена веществ Производные изоникотиновой кислоты: изониазид
Производные изоникотиновой кислоты: изониазид Повторение 8 класса. Основные понятия химии
Повторение 8 класса. Основные понятия химии Підготувала учениця 11-А класу Білецька Олеся
Підготувала учениця 11-А класу Білецька Олеся  Silicates
Silicates Минералы и их свойства
Минералы и их свойства Кислород как элемент
Кислород как элемент Презентация по Химии "Класифікація хімічних речовин" - скачать смотреть бесплатно
Презентация по Химии "Класифікація хімічних речовин" - скачать смотреть бесплатно Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Химическая связь
Химическая связь Характеристика органических соединений
Характеристика органических соединений Решение 33 задания
Решение 33 задания Колообіг карбону у природі. Виконали: учениці 10-А класу Кирлейза Софія Мустіпан Вікторія
Колообіг карбону у природі. Виконали: учениці 10-А класу Кирлейза Софія Мустіпан Вікторія  Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу
Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу Классификация минералов по химическому принципу
Классификация минералов по химическому принципу Минералы. Классы минералов
Минералы. Классы минералов Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Алюминий и его сплавы
Алюминий и его сплавы Нәруыз. Қасиеті және қызметі
Нәруыз. Қасиеті және қызметі Алюміній
Алюміній  Волокно капрон
Волокно капрон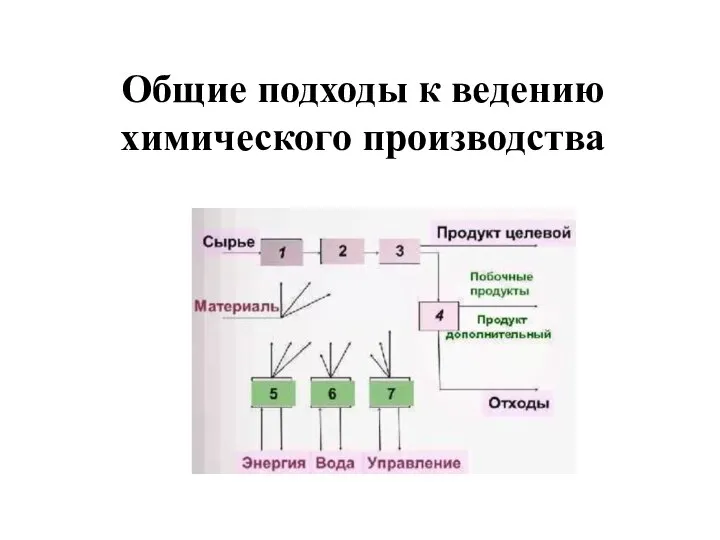 Общие подходы к ведению химического производства
Общие подходы к ведению химического производства Век медный, бронзовый, железный Тужилкина Полина 9 Б класс МОУ «СОШ №92»
Век медный, бронзовый, железный Тужилкина Полина 9 Б класс МОУ «СОШ №92» Парниковий ефект
Парниковий ефект