Конденсационные методы состоят во взаимодействии молекул истинных раствор с образованием частиц
коллоидных размеров, что может быть достигнуто как физическими, так и химическими методами.
Физические конденсационные методы:
Метод конденсации из паров- образование тумана в газовой фазе при понижении температуры. Пример: образование тумана, облаков, производство Н2SO4
Метод замены растворителя- раствор вещества приливают к жидкости, в которой это вещество практически не растворимо. Пример: Получение гидрозолей серы, холестерина, канифоли.
Химические конденсационные методы - методы основаны на образовании новой фазы (малорастворимого соединения) в результате протекания химических реакций. Любая химическая реакция, протекающая с образованием новой фазы, может быть источником получения коллоидной системы.
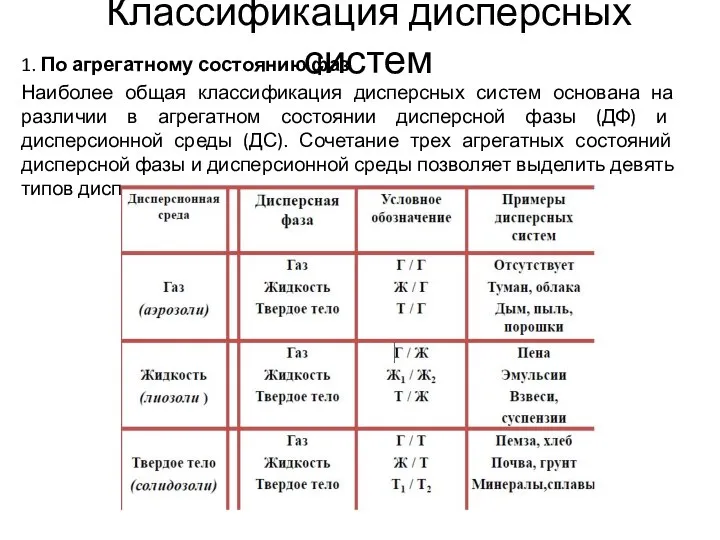
Методы получения дисперсных систем









 Каталитикалық крекинг
Каталитикалық крекинг Силіцій Стеценко Данило Котенко Роман Богдан Олександр Копич Вадим
Силіцій Стеценко Данило Котенко Роман Богдан Олександр Копич Вадим  Дендример, или арборол
Дендример, или арборол Ферменты и гормоны. (10-11 класс)
Ферменты и гормоны. (10-11 класс) Фосфор. Получение. Химические свойства
Фосфор. Получение. Химические свойства Презентация по Химии "Опорно-двигательная система. Скелет и мышцы птиц" - скачать смотреть
Презентация по Химии "Опорно-двигательная система. Скелет и мышцы птиц" - скачать смотреть  Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Способы перегонки
Способы перегонки «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Познаваемость мира. Сведения о клетке. Подготовила ученица 11 класса Шапаренко Екатерина
Познаваемость мира. Сведения о клетке. Подготовила ученица 11 класса Шапаренко Екатерина Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова  Металлы в продуктах питания
Металлы в продуктах питания Презентация по Химии "Угольная кислота" - скачать смотреть
Презентация по Химии "Угольная кислота" - скачать смотреть  Полупроводниковая магнитная керамика - ферриты
Полупроводниковая магнитная керамика - ферриты ПОЖАРОВЗРЫВОБЕЗОПАСНОСТЬ Учебные вопросы: 1. Процессы горения. Опасности пожара. 2. Виды горения. 3. Опасные факторы пожара. 4.
ПОЖАРОВЗРЫВОБЕЗОПАСНОСТЬ Учебные вопросы: 1. Процессы горения. Опасности пожара. 2. Виды горения. 3. Опасные факторы пожара. 4.  Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Поливинилхлорид. Физические и химические свойства
Поливинилхлорид. Физические и химические свойства Ферментативные методы анализа
Ферментативные методы анализа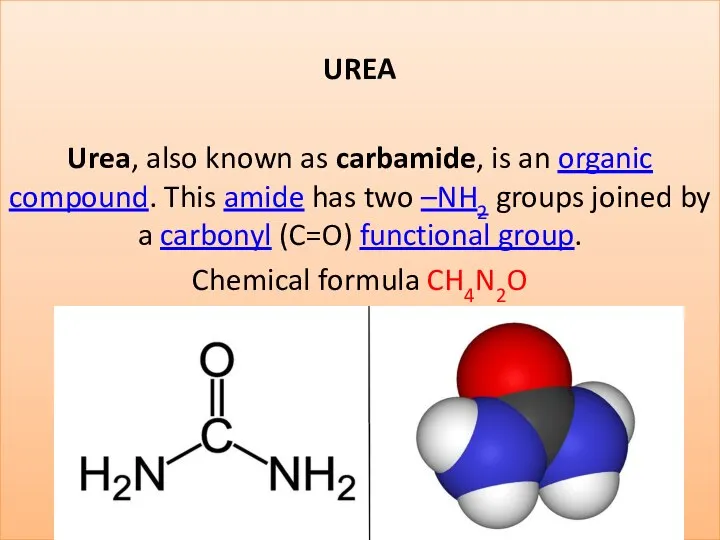 Urea (carbamide)
Urea (carbamide) Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Кристаллическая структура
Кристаллическая структура Щелочные металлы
Щелочные металлы Углеводороды. (Лекция 5)
Углеводороды. (Лекция 5) Растворы. Часть 2
Растворы. Часть 2 Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) Применение нитратов
Применение нитратов  Презентация Теллур
Презентация Теллур 9 класс Урок №9. Углеводы. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №9. Углеводы. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.