Содержание
- 2. Электроды 2 рода Усложним конструкцию, введем в систему на границу фаз серебро – раствор труднорастворимую соль
- 3. Газовые электроды В систему вместо труднорастворимого вещества можно ввести газ, тогда получатся так называемые газовые электроды.
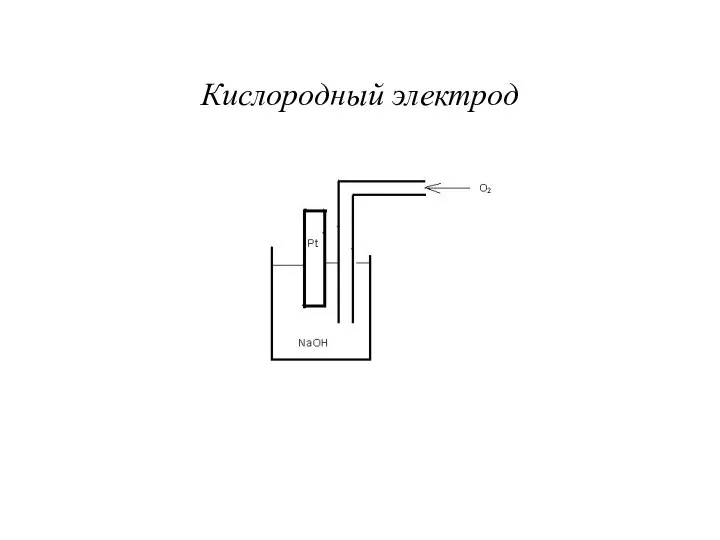
- 4. Кислородный электрод
- 5. Хлорный электрод Если на такую платиновую пластину, погруженную в раствор соляной кислоты, подавать газообразный хлор, получится
- 6. Электроды сравнения (водородный) (H2)Pt|H2SO4 На платине устанавливается равновесие: H2 ─ 2e ↔ 2H+ εH2 = εoH2
- 7. Red-ox электроды (+) Pt | Fe3+ Fe3+ + e ↔ Fe2+ (─) Pt | Sn2+ Sn4+
- 8. Гальванический элемент Двухэлектродная обратимая система, в которой энергия химической реакции преобразуется в электрическую, называется гальваническим элементом.
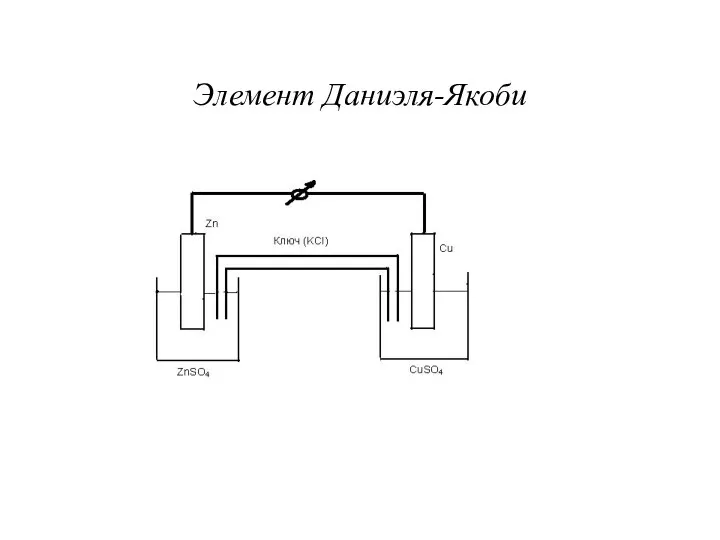
- 9. Элемент Даниэля-Якоби
- 10. Схема элемента и обозначение электродов Zn + CuSO4 ↔ ZnSO4 + Cu (─) Zn| ZnSO4 ||
- 11. Электродвижущая сила (Э.Д.С) Суммарная работа, производимая электрическим током называется электродвижущей силой (э.д.с.) элемента (Е). ∑Аi =
- 12. Виды работ А1 –работа окисления цинка (поверхность металлического цинка в контакте с раствором его соли). А1
- 13. Связь э.д.с. с потенциалами электродов А3 = А4 ≈ 0. Е • n • F =
- 14. Концентрационная цепь Cu| CuSO4 || CuSO4 | Cu (2) С1 = 1 моль/л, С2 = 0,01
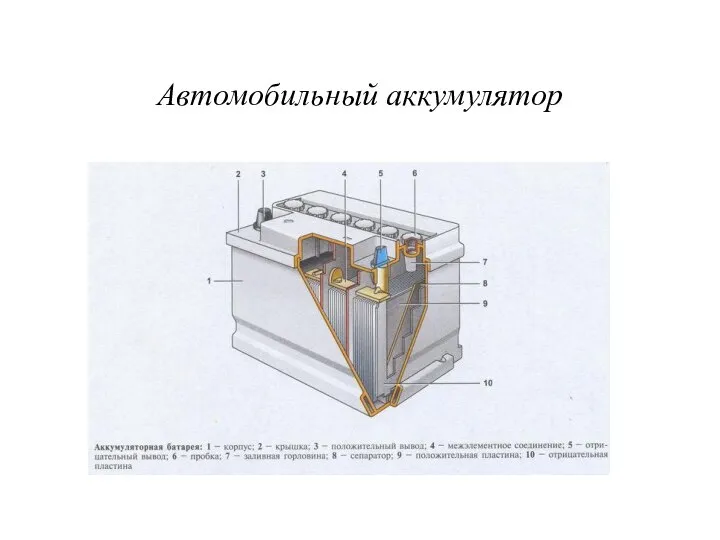
- 15. Автомобильный аккумулятор
- 16. Аккумуляторные батареи
- 18. Скачать презентацию












 Элементы IV группы, побочной подгруппы периодической системы Менделеева
Элементы IV группы, побочной подгруппы периодической системы Менделеева Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Альдегиды: химические свойства и применение
Альдегиды: химические свойства и применение Валентность
Валентность Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома Кристаллы в нашей жизни
Кристаллы в нашей жизни Ионные равновесия в растворах электролитов
Ионные равновесия в растворах электролитов СОЛИ Классификация сложных неорганических веществ
СОЛИ Классификация сложных неорганических веществ Валериановая кислота
Валериановая кислота Применение эксклюзионной хроматографии в биологии
Применение эксклюзионной хроматографии в биологии Stirring in liquid media
Stirring in liquid media Биосинтез и катаболизм пуриновых и пиримидиновых нуклеотидов
Биосинтез и катаболизм пуриновых и пиримидиновых нуклеотидов Бионеорганическая химия. Комплексообразование в организме. (Лекция 3)
Бионеорганическая химия. Комплексообразование в организме. (Лекция 3) Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Презентация по Химии "ХИМИЯ В НАШЕЙ ЖИЗНИ" - скачать смотреть
Презентация по Химии "ХИМИЯ В НАШЕЙ ЖИЗНИ" - скачать смотреть  Минералы натрия
Минералы натрия Железо, пирит
Железо, пирит Органические галогениды. (Лекция 7)
Органические галогениды. (Лекция 7) Игра по химии по теме «Атомы химических элементов. Простые вещества»
Игра по химии по теме «Атомы химических элементов. Простые вещества» Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Многоатомные Спирты
Многоатомные Спирты  Строение атома
Строение атома Химические средства защиты растений
Химические средства защиты растений Типы химических реакций в органической химии
Типы химических реакций в органической химии Неорганическая химия 8 класс г. Азов школа №9 учитель: Карасёв Евгений Владимирович
Неорганическая химия 8 класс г. Азов школа №9 учитель: Карасёв Евгений Владимирович  Электролиз воды
Электролиз воды Аттестационная работа. Методическая разработка фрагмента урока химии с элементами исследовательской деятельности
Аттестационная работа. Методическая разработка фрагмента урока химии с элементами исследовательской деятельности Состав воздуха и его загрязненность Отдел образования администрации Тальменского района Алтайского края
Состав воздуха и его загрязненность Отдел образования администрации Тальменского района Алтайского края