Содержание
- 2. Комплексные соединения – сложные соединения, в узлах кристаллов которых находятся наряду с простыми ионами и сложные
- 3. Образование комплексного соединения Реакция присоединения: Fe(CN)2 + 4KCN = K4[Fe(CN)6] 2. Реакция внедрения CuSO4 + 4NH3
- 4. K4[Fe(CN)6] Fe2+ - комплексообразователь CN- - лиганд 6 – координационное число [Fe(CN)6]4- - внутренняя сфера К+
- 5. [Pt(NH3)2Cl4] Pt4+ - комплексообразователь NH3 и Cl- - лиганды 6=2+4 – координационное число Внешней сферы нет
- 6. [Cu(NH3)4]SO4 Cu2+ - комплексообразователь NH3 - лиганд 4 – координационное число [Cu(NH3)4]2+ - внутренняя сфера SO42-
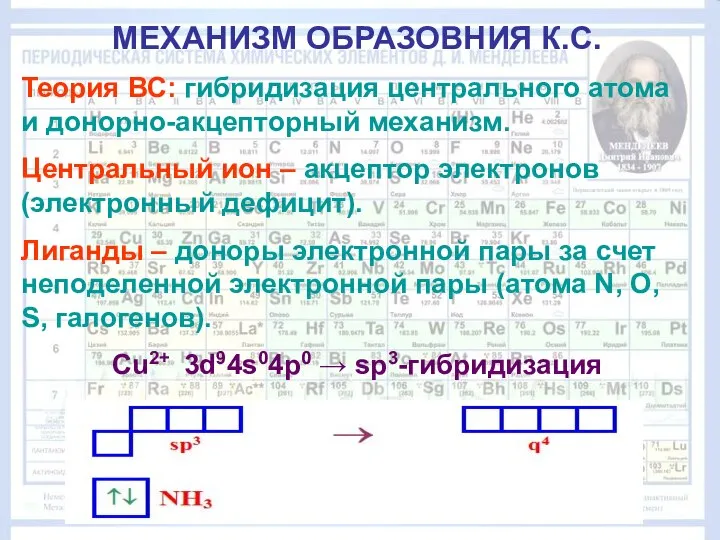
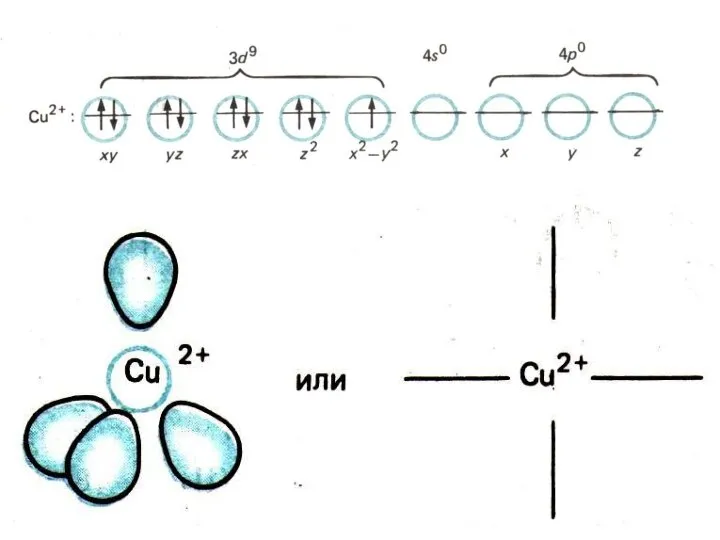
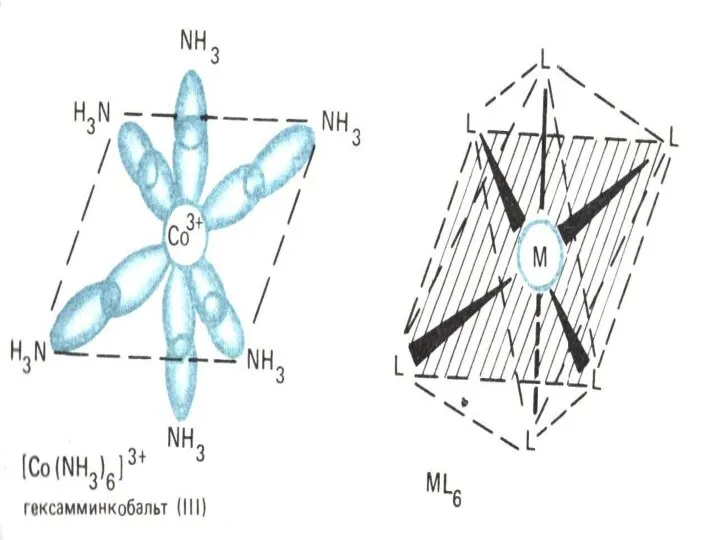
- 7. МЕХАНИЗМ ОБРАЗОВНИЯ К.С. Теория ВС: гибридизация центрального атома и донорно-акцепторный механизм. Центральный ион – акцептор электронов
- 10. КЛАССИФИКАЦИЯ К.С. 1. По заряду внутренней сферы а) катионные [Cu(NH3)4]2+ б) анионные [Fe(CN)6]3- в) нейтральные [Pt(NH3)2Cl]
- 11. КЛАССИФИКАЦИЯ К.С. 2. По природе лигандов а) ацедокомплексы [HgCl4]2-; [Fe(CN)6]4-; [Ag(S2O3)2]3- и др. б) амминные комплексы
- 12. НОМЕНКЛАТУРА Катионные комплексы Анион + лиганд с учетом его числа + + комплексообразователь и его степень
- 13. НОМЕНКЛАТУРА 2. Анионные комплексы Лиганды с учетом их числа + комплексообразователь (латинское название с окончанием «–ат»)
- 14. НОМЕНКЛАТУРА 3. Нейтральные комплексы Лиганды с учетом их числа + + комплексообразователь [Fe(Co)5] – пентакарбония железа
- 15. НОМЕНКЛАТУРА 4. Смешаннолигандные комплексы Анионы + лиганды с учетом его числа + комплексообразователь и его степень
- 16. ИЗОМЕРИЯ 1. Координационная [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6]
- 17. ИЗОМЕРИЯ 2. Ионизационная [Co(NH3)5Cl]SO4 [Co(NH3)5SO4]Cl
- 18. ИЗОМЕРИЯ 3. Гидратная [Co(H2O)6]Cl3 [Co(H2O)4Cl2]Cl⋅2H2O
- 19. ИЗОМЕРИЯ 4. Геометрическая (цис - транс) [Pt(NH3)2Cl2] [Cr(NH3)6][Co(CN)6]
- 20. ДИССОЦИАЦИЯ К.С. 1. Если есть внешняя сфера – первичная диссоциация как сильного электролита [Ag(NH3)2]Cl → [Ag(NH3)2]+
- 21. ДИССОЦИАЦИЯ К.С. 2. Внутренняя сфера – вторичная диссоциация как слабого электролита обратимо. Применим З.Д.М. [Ag(NH3)2]+ ↔
- 22. ДИССОЦИАЦИЯ К.С. 3. Константа диссоциации – константа нестойкости (константа неустойчивости) – количественная характеристика прочности комплекса. Чем
- 23. ДИССОЦИАЦИЯ К.С. 4. Величина обратная kнест называется константой устойчивости (константа образования). Чем больше kуст, тем прочнее
- 24. ХЕЛАТНЫЕ СОЕДИНЕНИЯ
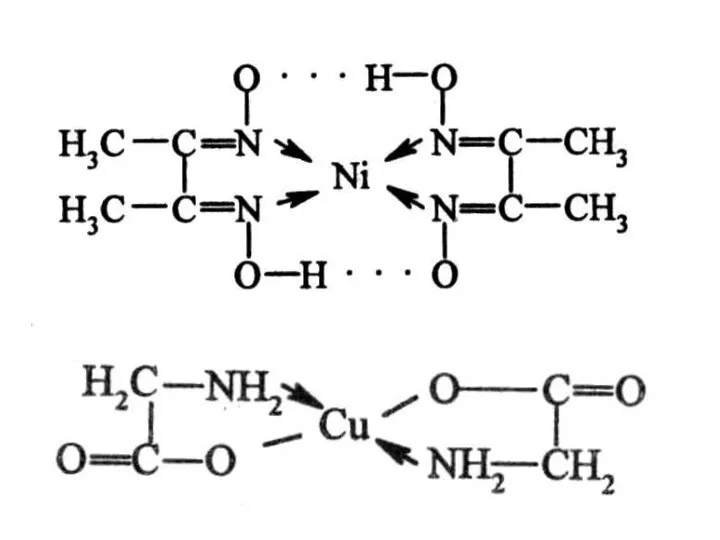
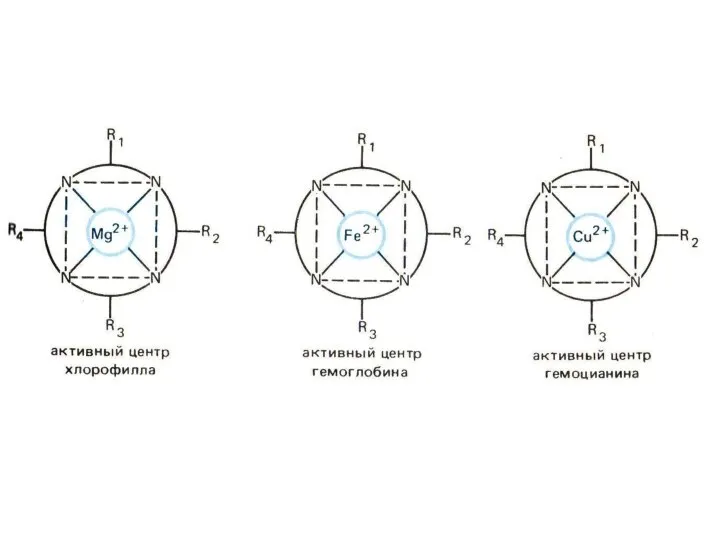
- 25. Лиганды занимают 2 или более координационных мест (полидентантные лиганды) Все биокомплексы – хелатные соединения. Биолиганды –
- 26. Правила циклов Л.А. ЧУГАЕВА 1) Наиболее устойчивы и прочны 5- и 6-членные циклы с участием комплексообразователя.
- 28. Полидентантными лигандами являются: Этилендиаминтетраацетат натрия (комплексон III, Трилон Б). Валиномицин (антибиотик) – 18-краун-6 с К+ Макроциклические
- 29. Полидентантными лигандами являются: 4. Металлоцены – образуются за счет взаимодействия вакантных орбиталей центрального атома с π-электронами
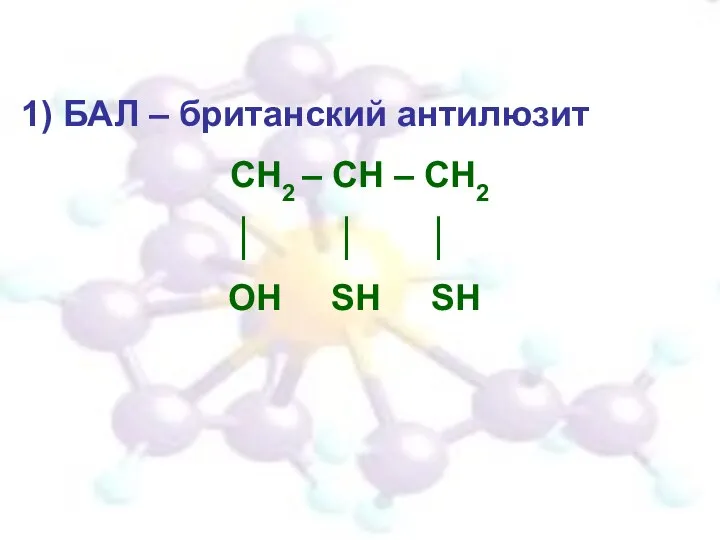
- 31. ХЕЛАТОТЕРАПИЯ - применение антидотов-лигандов для выведения токсичных d- и p-элементов из организма.
- 32. 1) БАЛ – британский антилюзит СН2 – СН – СН2 │ │ │ ОН SH SH
- 33. 2) Унитиол – растворимое соединение СН2 – СН – СН2 │ │ │ SН SH SO3Na
- 34. 3) Тетацин кальций Na2 СaЭДТА 4) Цис-изомер дихлородиаммин платины [Pt(NH3)2Cl2]
- 35. В биолигандах 2 вида комплексов: 1. Роль Ме высокоспецифична. Замена его даже на близкий ион приводит
- 36. В организме осуществляется металл-лигандный гомеостаз – поддержание их концентрации на постоянном уровне.
- 37. Причины нарушения гомеостаза: 1. Поступление из окружающей среды ионов-токсикантов. 2. Поступление микроэлементов, необходимых для жизни, в
- 38. Причины нарушения гомеостаза: 4. Поступление в организм токсичных лигандов (средства бытовой химии и химические средства защиты
- 39. Принципы хелатотерапии Эффект связывать ионы-токсиканты с антидотами должен быть более прочным, чем в организме. Не разрушать
- 41. Скачать презентацию

![Образование комплексного соединения Реакция присоединения: Fe(CN)2 + 4KCN = K4[Fe(CN)6] 2.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-2.jpg)
![K4[Fe(CN)6] Fe2+ - комплексообразователь CN- - лиганд 6 – координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-3.jpg)
![[Pt(NH3)2Cl4] Pt4+ - комплексообразователь NH3 и Cl- - лиганды 6=2+4 – координационное число Внешней сферы нет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-4.jpg)
![[Cu(NH3)4]SO4 Cu2+ - комплексообразователь NH3 - лиганд 4 – координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-5.jpg)
![КЛАССИФИКАЦИЯ К.С. 1. По заряду внутренней сферы а) катионные [Cu(NH3)4]2+ б) анионные [Fe(CN)6]3- в) нейтральные [Pt(NH3)2Cl]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-9.jpg)
![КЛАССИФИКАЦИЯ К.С. 2. По природе лигандов а) ацедокомплексы [HgCl4]2-; [Fe(CN)6]4-; [Ag(S2O3)2]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-10.jpg)


![НОМЕНКЛАТУРА 3. Нейтральные комплексы Лиганды с учетом их числа + + комплексообразователь [Fe(Co)5] – пентакарбония железа](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-13.jpg)

![ИЗОМЕРИЯ 1. Координационная [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-15.jpg)
![ИЗОМЕРИЯ 2. Ионизационная [Co(NH3)5Cl]SO4 [Co(NH3)5SO4]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-16.jpg)
![ИЗОМЕРИЯ 3. Гидратная [Co(H2O)6]Cl3 [Co(H2O)4Cl2]Cl⋅2H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-17.jpg)
![ИЗОМЕРИЯ 4. Геометрическая (цис - транс) [Pt(NH3)2Cl2] [Cr(NH3)6][Co(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-18.jpg)











![3) Тетацин кальций Na2 СaЭДТА 4) Цис-изомер дихлородиаммин платины [Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406763/slide-33.jpg)





 Физические свойства минералов
Физические свойства минералов Дифузія у побуті
Дифузія у побуті Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс Физико – химические характеристики электротехнических материалов
Физико – химические характеристики электротехнических материалов Сера и её соединения
Сера и её соединения Кислородсодержащие. Углеводы. Подготовка к ЕГЭ
Кислородсодержащие. Углеводы. Подготовка к ЕГЭ Реакции ионного обмена
Реакции ионного обмена Презентация по Химии "Особенности металла" - скачать смотреть
Презентация по Химии "Особенности металла" - скачать смотреть  Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро
Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро Наука химия. Роль химии в промышленности
Наука химия. Роль химии в промышленности Соединения терпеноидной структуры. Тема № 3
Соединения терпеноидной структуры. Тема № 3 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Биоэнергетика. Часть первая
Биоэнергетика. Часть первая ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна
ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна  The law of mass conservation
The law of mass conservation Предпрофильный курс Мир химии
Предпрофильный курс Мир химии Металлы. Общая характеристика
Металлы. Общая характеристика Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения
Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения Основы общей химии
Основы общей химии Підготувала Учениця 11 класу Лемак Андріана
Підготувала Учениця 11 класу Лемак Андріана  Ионообменная хроматография и ее применение
Ионообменная хроматография и ее применение Агрохимия растений
Агрохимия растений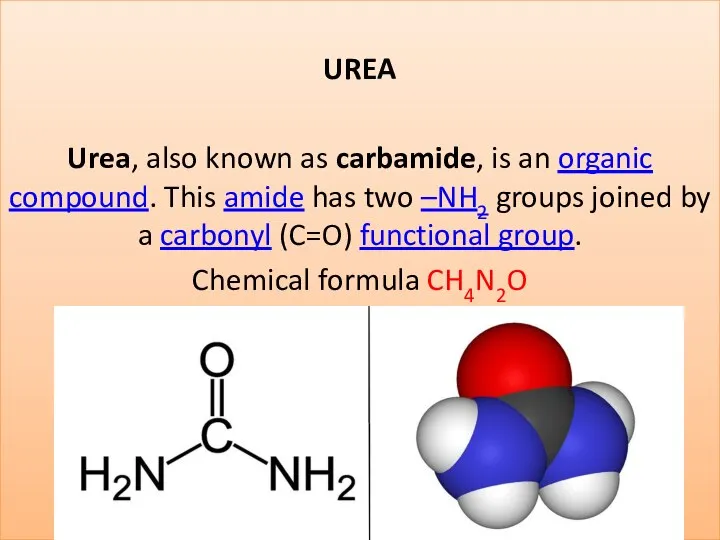 Urea (carbamide)
Urea (carbamide) Химия в строительстве
Химия в строительстве ИК-спектроскопия органических соединений
ИК-спектроскопия органических соединений Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ