Содержание
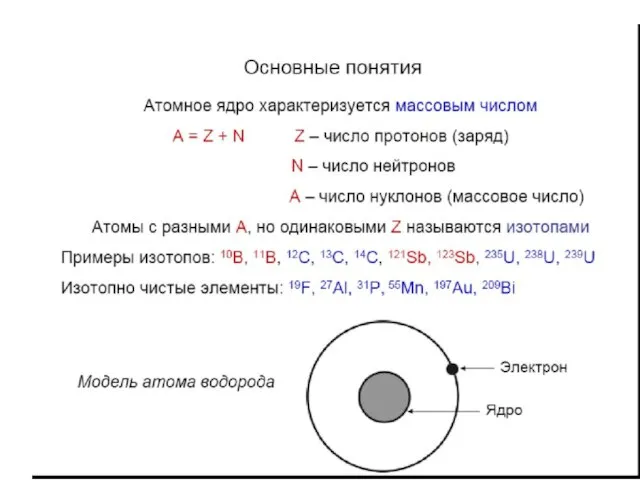
- 4. Одним из основных понятий химии и других естественных наук является атом (греч.ατομοζ – неделимый). Этот термин
- 5. Французский ученый Пьер Гассенди ввел понятие о молекуле, под которой он понимал качественно новое образование, составленное
- 6. В1860 году в г. Карлсруэ состоялся международный конгресс химиков. Благодаря усилиям итальянского ученого С. Канниццаро были
- 7. Долгое время атом считался неделимым. Открытие электрона Дж.Дж.Томсоном (1897 г.), открытие и исследование радиоактивности (А.Беккерель, М.Склодовская-Кюри,
- 8. В 1904 г. японский физик Хантаро Нагаока предложил модель “сатурноподобного” атома: атом состоит из тяжелого положительно
- 9. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов.
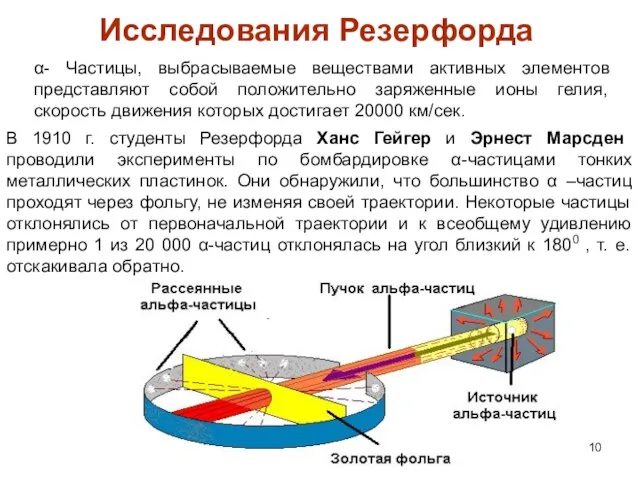
- 10. α- Частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает
- 11. Выводы: 1) в атоме есть некоторое «препятствие», которое было названо ядром; 2) ядро имеет положительный заряд
- 12. ВСЕГО ЭТОГО МОГЛО БЫ И НЕ БЫТЬ Предположим, что в начале XX века Э.Резерфорд (1871-1937) и
- 13. Но характер движения электрона по орбите вокруг ядра атома противоречит законам электродинамики: 1) Заряженная частица, движущаяся
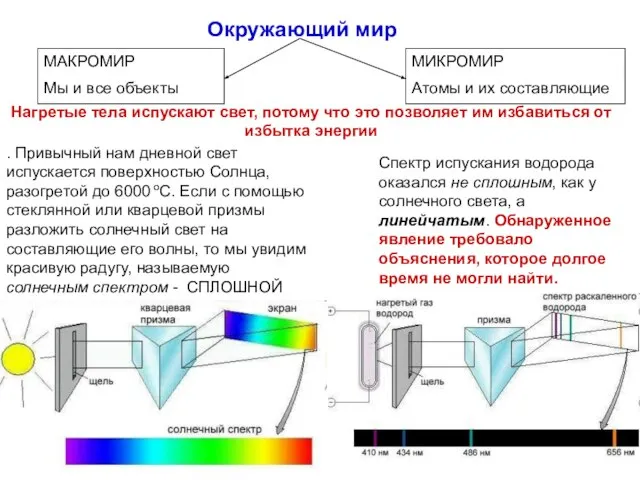
- 14. . Привычный нам дневной свет испускается поверхностью Солнца, разогретой до 6000 оС. Если с помощью стеклянной
- 15. 1. Теория квантования энергии М. Планк (1900 г.) Берлинский профессор Макс Планк в течение многих лет
- 16. 2. Теория СТРОЕНИЯ АТОМА по Н. Бору На основе квантовой теории излучения и поглощения света, созданной
- 17. Бор выдвинул предположение, что: атом водорода (система протон-электрон) может находиться только в определенных стационарных энергетических состояниях
- 18. Таким образом, Бор предположил, что электронный "рой" в модели Резерфорда не беспорядочен. ПОСТУЛАТЫ БОРА (1913 г.)
- 19. В теории Бора впервые искусственно было введено главное квантовое число n, значение которого определяет энергию электрона
- 20. Законы, которые описывают явления, происходящие в микромире, существенно отличаются от законов, описывающих поведение макротел. Корпускулярно-волновые свойства
- 22. 2. Принцип неопределенности Гейзенберга Принцип неопределённости означает, что движение микрочастиц нельзя характеризовать траекторией как точной линией,
- 23. Для тел атомного масштаба нельзя указать одновременно их точное положение в пространстве и направление движения. Можно
- 24. В 1926 г. Шредингер предложил уравнение, в которое для описания поведения электрона в атоме была введена
- 25. Физический смысл волновой функции определить трудно, а вот квадрат модуля ее |ψ| 2 определяет вероятность нахождения
- 26. Уравнение Шредингера - трехмерно. Соответственно - три набора квантовых чисел. Каждой координате свое квантовое число. Размер,
- 27. l l Состояние электрона, соответствующее определенному значению l, называется энергетическим подуровнем. КВАНТОВЫЕ ЧИСЛА
- 28. Например, n = 1 l = 0s n = 2 l = 0s, 1p n =
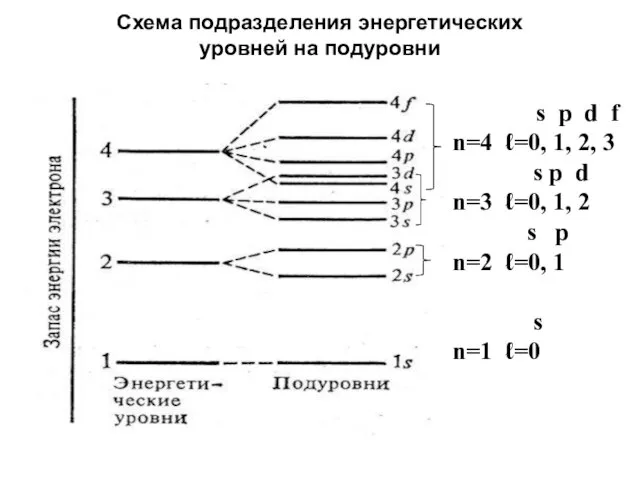
- 29. Схема подразделения энергетических уровней на подуровни s p d f n=4 ℓ=0, 1, 2, 3 s
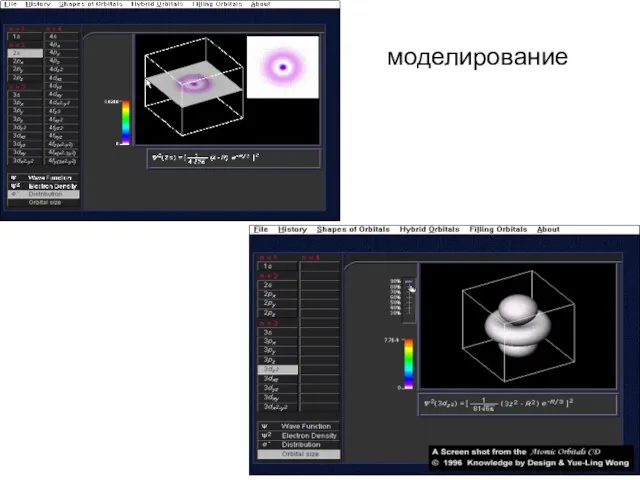
- 30. моделирование
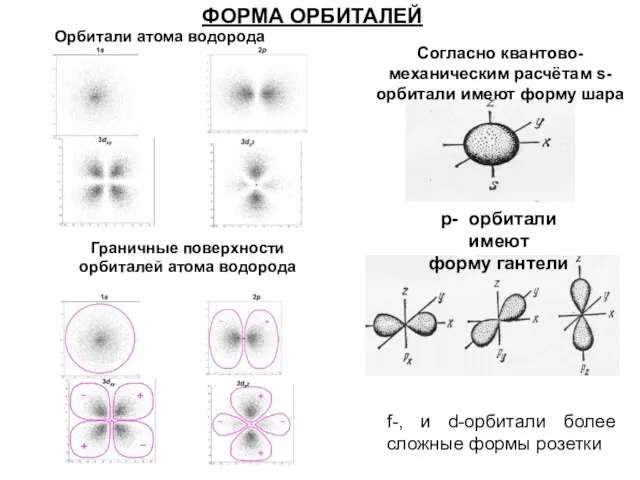
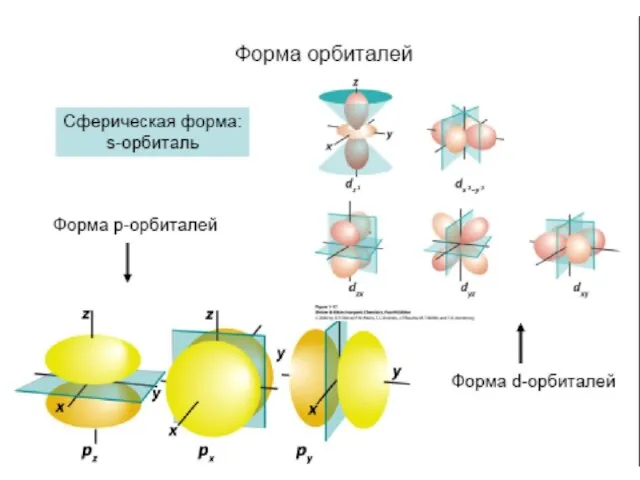
- 31. Согласно квантово-механическим расчётам s- орбитали имеют форму шара p- орбитали имеют форму гантели f-, и d-орбитали
- 32. 3. ml – магнитное квантовое число. При данном l , ml принимает значения всех целых чисел
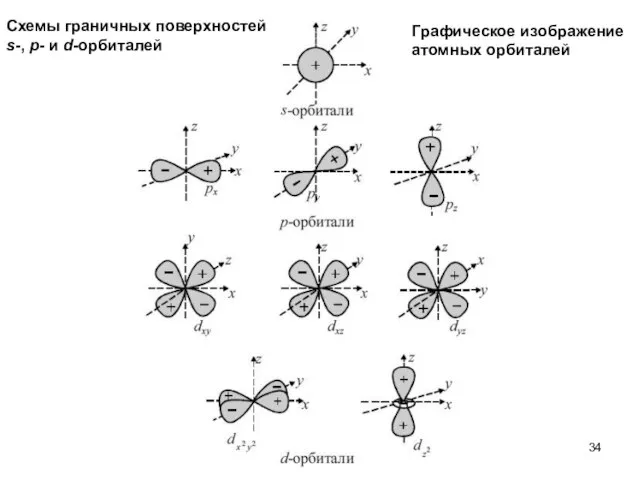
- 34. Схемы граничных поверхностей s-, p- и d-орбиталей Графическое изображение атомных орбиталей
- 37. 4. ms – спиновое квантовое число. спиновое квантовое число может иметь только два значения: +½ (↑)
- 38. Распределение электронов по энергетическим уровням и подуровням изображают в виде Электронных формул Графических электронных структур Энергетической
- 39. Принцип наименьшей энергии каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией. С ростом
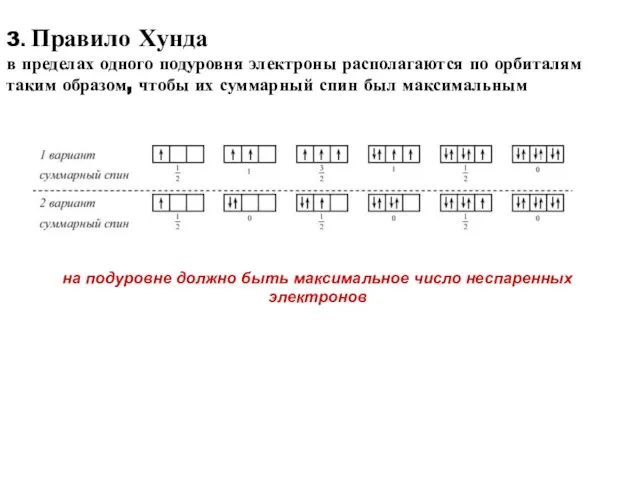
- 40. 3. Правило Хунда в пределах одного подуровня электроны располагаются по орбиталям таким образом, чтобы их суммарный
- 41. 4. Правила Клечковского Первое правило: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от
- 42. НЕ ПОДЧИНЯЮТСЯ ПРАВИЛАМ КЛЕЧКОВСКОГО
- 43. 2) Графические электронные формулы каждая орбиталь обозначается клеткой, стрелка − электрон, направление стрелки − направление спина,
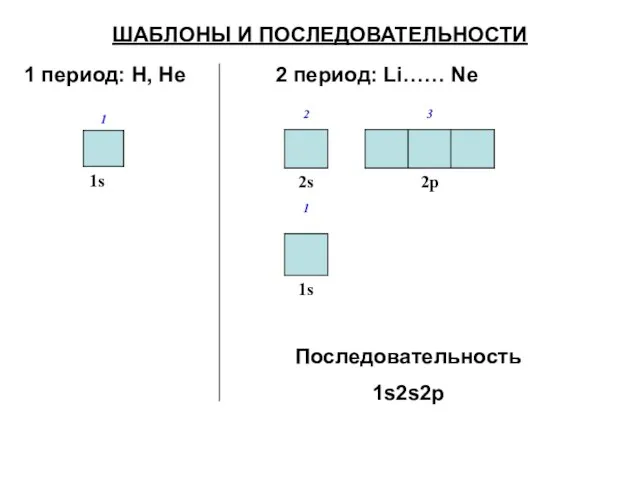
- 44. ШАБЛОНЫ И ПОСЛЕДОВАТЕЛЬНОСТИ 1 период: H, He 2 период: Li…… Ne Последовательность 1s2s2p
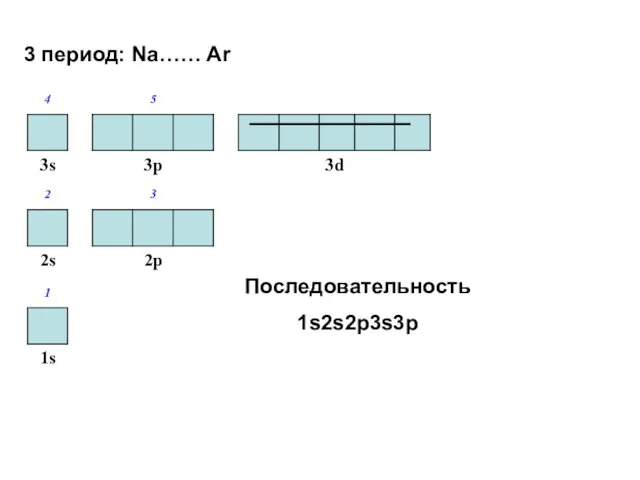
- 45. 3 период: Na…… Ar Последовательность 1s2s2p3s3p
- 46. 4 период: К…… Кr Последовательность 1s2s2p3s3p4s3d4p
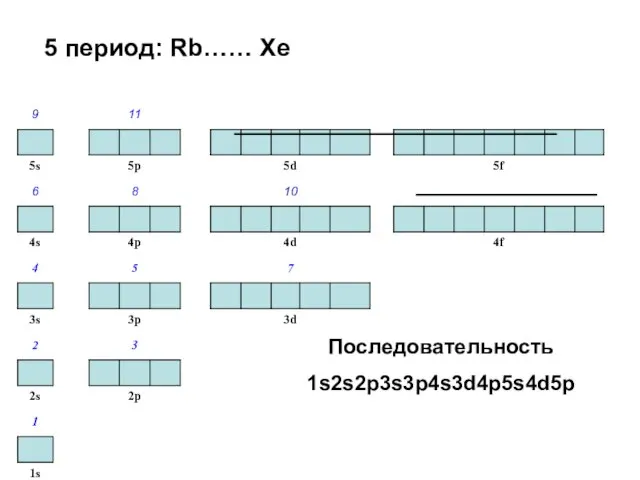
- 47. 5 период: Rb…… Xe Последовательность 1s2s2p3s3p4s3d4p5s4d5p
- 53. Скачать презентацию






































 Строение, получение и применение полимеров
Строение, получение и применение полимеров Презентация Нефть и способы ее переработки
Презентация Нефть и способы ее переработки Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные
Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные Аттестаионная работа. Сахар. Изучаем и исследуем
Аттестаионная работа. Сахар. Изучаем и исследуем Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Презентация по Химии "Химическое загрязнение среды промышленностью." - скачать смотреть бесплатно
Презентация по Химии "Химическое загрязнение среды промышленностью." - скачать смотреть бесплатно Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно
Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно Влияние шампуня на состояние волос человека
Влияние шампуня на состояние волос человека Презентация по Химии "Комплексные соединения" - скачать смотреть
Презентация по Химии "Комплексные соединения" - скачать смотреть  Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы Детонаційна стійкість бензину
Детонаційна стійкість бензину Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола
Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Химитариум. Погрузись в мир занимательной химии
Химитариум. Погрузись в мир занимательной химии Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Поверхностные явлении и дисперсные системы (коллоидная химия)
Поверхностные явлении и дисперсные системы (коллоидная химия) Производство топлив и масел
Производство топлив и масел Полимеры, пластмассы и товары на их основе
Полимеры, пластмассы и товары на их основе Альдегиды и кетоны
Альдегиды и кетоны Физико-химическая и механическая миграция
Физико-химическая и механическая миграция Свойства снега и льда (окружающий мир, 3 класс)
Свойства снега и льда (окружающий мир, 3 класс) Роль воды в жизни и хозяйстве
Роль воды в жизни и хозяйстве Магнитті қатты материалдар және оны техникада қолдану әдістері
Магнитті қатты материалдар және оны техникада қолдану әдістері Презентация Угольная кислота
Презентация Угольная кислота Кальцій і Магній
Кальцій і Магній  Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна
Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна