Содержание
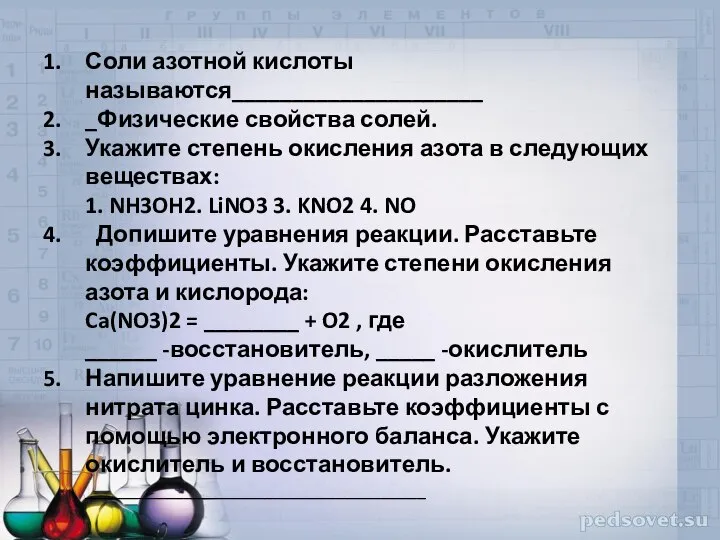
- 2. Соли азотной кислоты называются_____________________ Физические свойства солей-_________________________________________. 2. Дайте названия следующим солям: KNO3_______________________________, Ba(NO3)2________________________________, Zn (NO3)2
- 3. Соли азотной кислоты называются_____________________ _Физические свойства солей. Укажите степень окисления азота в следующих веществах: 1. NH3OH2.
- 4. СОЛИ АММОНИЯ Урок по неорганической химии в 9 классе.
- 5. Цели урока: сформировать знания о составе и характерных свойствах солей аммония, ознакомить с представителями этих солей
- 6. Задачи урока: Образовательные: Систематизировать знания учащихся о солях, изучить свойства, присущие солям аммония, научиться распознавать эти
- 7. Соли азотной кислоты называются____________________ _Физические свойства солей-__________________________________________________________. 2. Дайте названия следующим солям: KNO3_______________________________, Ba(NO3)2___________________________________, Zn (NO3)2
- 8. II. Повторение и контроль.
- 9. Решите альтернативный тест – выбор правильного ответа из множества. I вариант выбирает правильные ответы для азота,
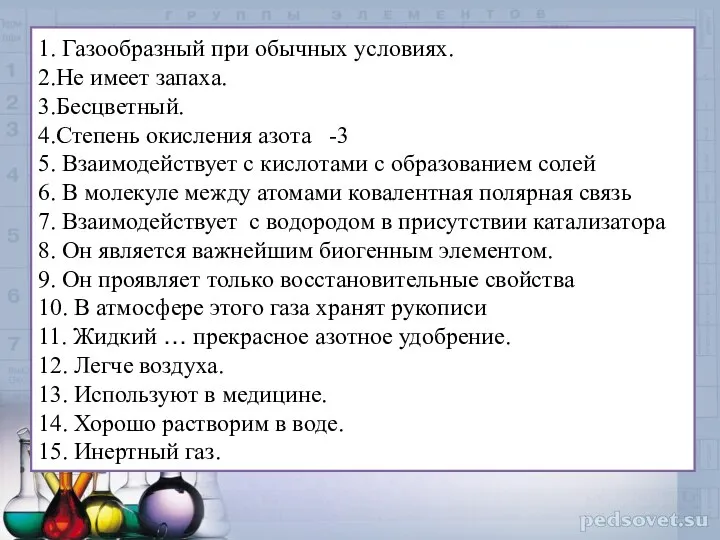
- 10. 1. Газообразный при обычных условиях. 2.Не имеет запаха. 3.Бесцветный. 4.Степень окисления азота -3 5. Взаимодействует с
- 11. Взаимопроверка
- 12. III. Изучение нового материала.
- 13. Девиз урока : «Можно не любить химию, но прожить без неё сегодня и завтра нельзя» (О.М.
- 14. Первая мировая война. Морское сражение немцев с англичанами.
- 15. Тема урока «Соли аммония» Во время I мировой войны английский крейсер вел преследование поврежденного в бою
- 16. Тема урока «Соли аммония»
- 17. Этимология – происхождение названия. Название «аммоний» предложил в 1808 году знаменитый английский химик Хэмфри Дэви. Латинское
- 18. 1787 год - комиссия по химической номенклатуре дала этому газу имя ammoniaque (аммониак). 1801 год -
- 19. H Строение N H H •• Есть возможность образовать донорно – акцепторную связь Молекула образована ковалентной
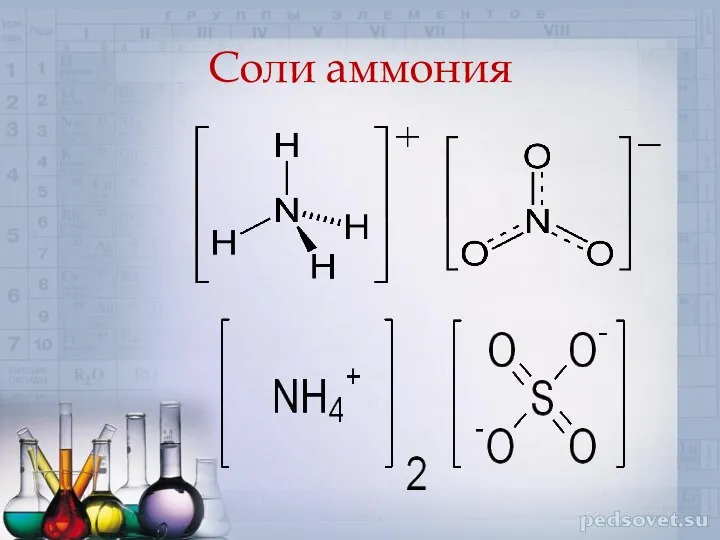
- 20. Соли аммония
- 21. Физические свойства солей аммония. а) твёрдые вещества; б) имеют кристаллическое строение (ионные кристаллические решётки); в) хорошо
- 22. Химические свойства солей аммония Вспомните правила Т/Б!
- 23. Химические свойства солей аммония. Взаимодействие с солями. хлорид аммония + нитрат серебра NH4Cl + AgNO3 ?
- 24. Сульфат аммония + хлорид бария (NH4)2SO4 + BaCl2 ? 2NH4Cl + BaSO4 2NH4 ++SO42- + Ba2+
- 25. 2. Взаимодействие с кислотами. Карбонат аммония + соляная кислота (NH4 )2СО3 + 2HCl ? 2NH4Cl +
- 26. ФИЗКУЛЬТМИНУТКА
- 27. Для разминки из-за парт Поднимаемся. На старт! Бег на месте. Веселей И быстрей, быстрей, быстрей! Делаем
- 28. 3. Взаимодействие с щелочами. NH4Cl+ NaOH ? NH3 + H2O + NaCl Взаимодействие с щелочами –
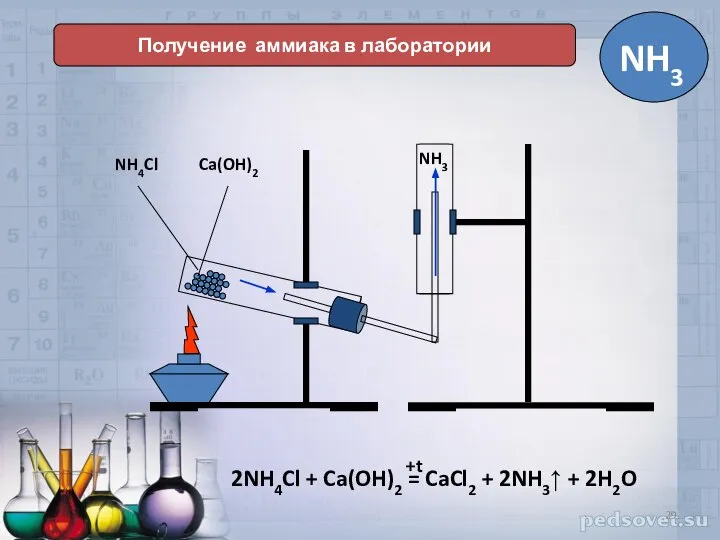
- 29. Получение аммиака в лаборатории NH4Cl Ca(OH)2 NH3
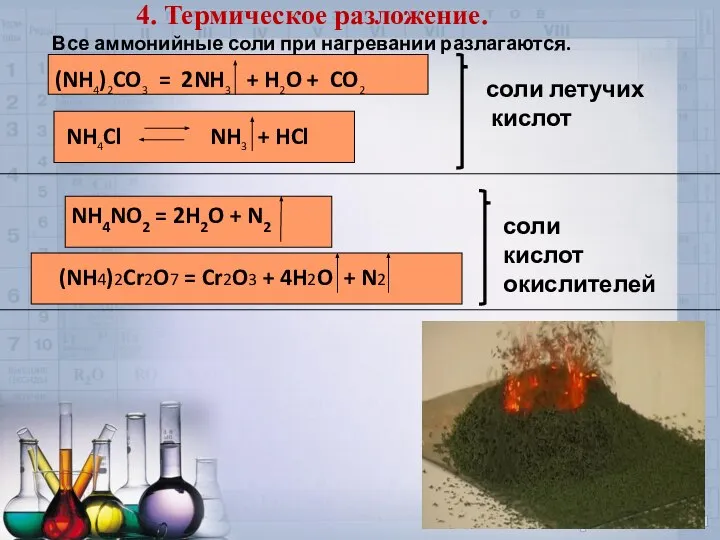
- 30. 4. Термическое разложение. Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O + CO2
- 31. Получение солей аммония Получают их при взаимодействии NH3 или NH4 OH с кислотами: NH3 + HCl
- 32. Применение солей аммония.
- 33. Русский химик Д.Н Прянишников Соли аммония Азотные удобрения
- 34. Аммиачная селитра (нитрат аммония) - прекрасное азотное удобрение. NH4NO3
- 35. Аммиачная селитра (нитрат аммония) – взрывчатое вещество.
- 36. Смесь нитрата аммония с алюминием и углем - аммонал (взрывные работы, в пиротехнике)
- 37. Нашатырь (хлорид аммония) Паяние, лужение металлов Изготовление гальванических элементов Хлорид аммония NH4Cl используют при паянии, так
- 38. Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, так как они легко разлагаются
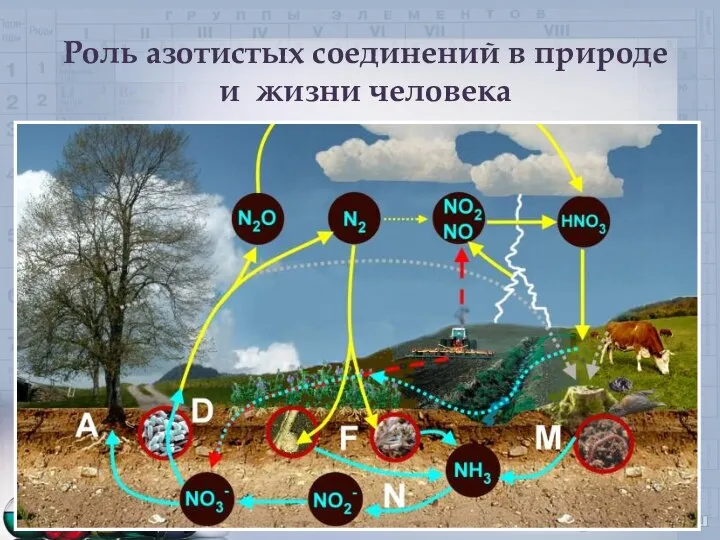
- 39. Роль азотистых соединений в природе и жизни человека
- 40. Знаете ли вы... Теннисные мячи не надувают, а вводят в них «вздуватели» - специальные вещества, которые
- 41. Задания на развитие творческого мышления Предложите способ очистки поваренной соли от содержащейся в ней примеси хлорида
- 42. IV. Закрепление.
- 43. Повторим: 1.Выбрать и назвать соли аммония 2. Перечислите химические свойства солей аммония. 3. Назовите физические свойства
- 44. V. Домашнее задание. Выучить параграф 18. Составить уравнения реакций, с помощью которых можно осуществить превращения: N2?
- 45. VI. Рефлексия.
- 46. РЕФЛЕКСИЯ 1) Больше всего мне понравилось... 2) Самым интересным сегодня на уроке было... 3) Сегодня на
- 48. Скачать презентацию







































 Основи біохімії. (Лекція 1)
Основи біохімії. (Лекція 1) Gmp – тиісті өндірістік тәжірибе
Gmp – тиісті өндірістік тәжірибе Алмаз. Внутренняя структура алмаза
Алмаз. Внутренняя структура алмаза Устойчивость и коагуляция коллоидных систем
Устойчивость и коагуляция коллоидных систем Витамин В
Витамин В Циклоалканы
Циклоалканы Растворы
Растворы Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно
Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна.
ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна. Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов 10 класс семинар-написание формул органических веществ
10 класс семинар-написание формул органических веществ Аминокислоты
Аминокислоты Электролитическая диссоциация
Электролитическая диссоциация Моторные масла
Моторные масла Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода?
Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода? Петрография некоторых распространенных метаморфических пород
Петрография некоторых распространенных метаморфических пород Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Лекарственные формы для глаз в условиях аптечного производства
Лекарственные формы для глаз в условиях аптечного производства Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, л
Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, л Основы теории энергетических зон кристаллов. Волны Блоха
Основы теории энергетических зон кристаллов. Волны Блоха Простые вещества неметаллы
Простые вещества неметаллы Физические и химические свойства воды
Физические и химические свойства воды Відносна молекулярна маса. Масова частка елемента в складній речовині
Відносна молекулярна маса. Масова частка елемента в складній речовині Метаболизм углеводов
Метаболизм углеводов Образование раствора
Образование раствора Обмен нуклеотидов
Обмен нуклеотидов Презентация по Химии "Адсорбція" - скачать смотреть бесплатно
Презентация по Химии "Адсорбція" - скачать смотреть бесплатно Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма