Содержание
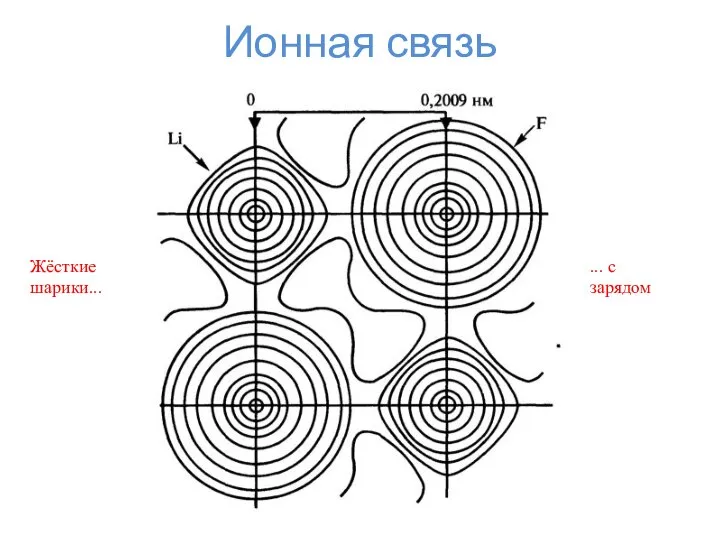
- 2. Ионная связь Жёсткие шарики... ... с зарядом
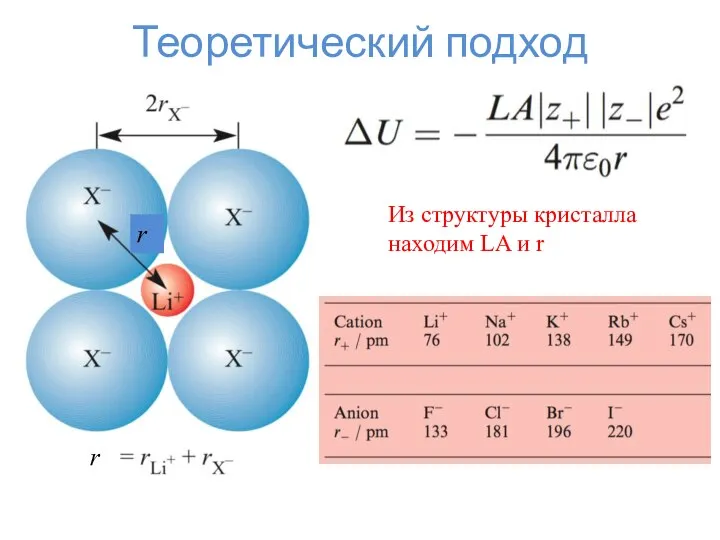
- 3. Теоретический подход r r Из структуры кристалла находим LA и r
- 4. Экспериментальный подход Цикл Борна-Габера Несоответствие ΔHрассчёт - ΔHэксперимент Что же делать???
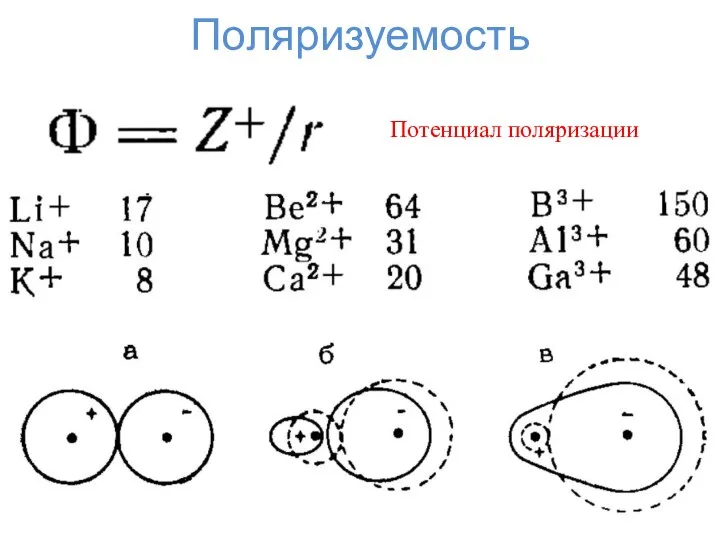
- 5. Поляризуемость Потенциал поляризации
- 6. Правила Фаянса Поляризующая способность катиона характеризуется величиной его потенциала поляризации (чем меньше и беднее катион, тем
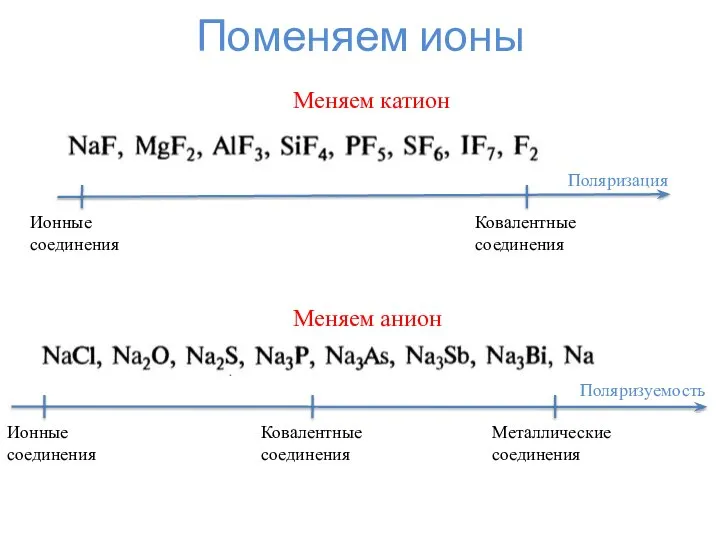
- 7. Поменяем ионы Поляризация Ковалентные соединения Ионные соединения Меняем катион Поляризуемость Металлические соединения Ионные соединения Ковалентные соединения
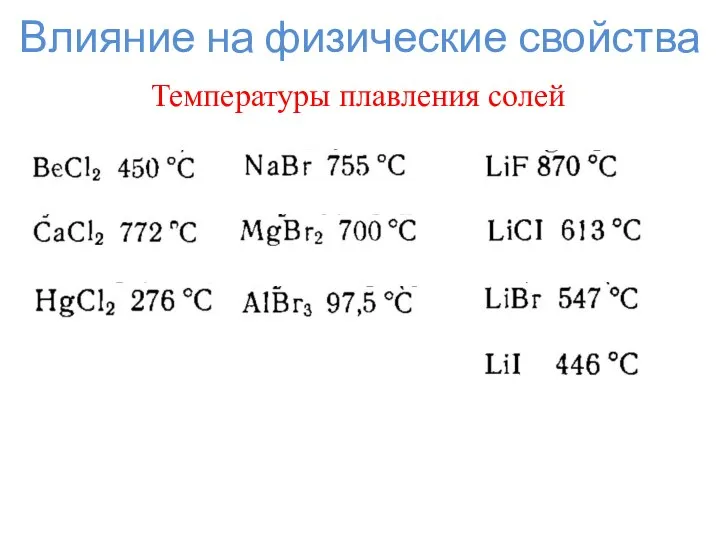
- 8. Влияние на физические свойства Температуры плавления солей
- 9. Влияние на химические свойства Температуры разложения карбонатов
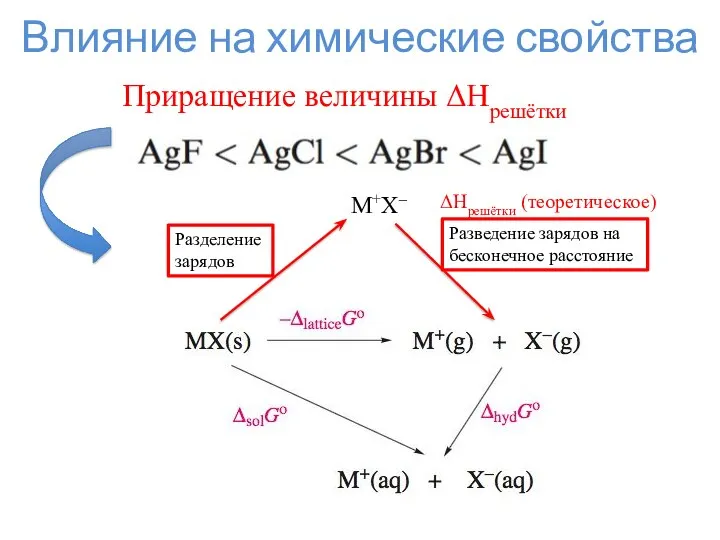
- 10. Влияние на химические свойства Приращение величины ΔHрешётки Разделение зарядов M+X– Разведение зарядов на бесконечное расстояние ΔHрешётки
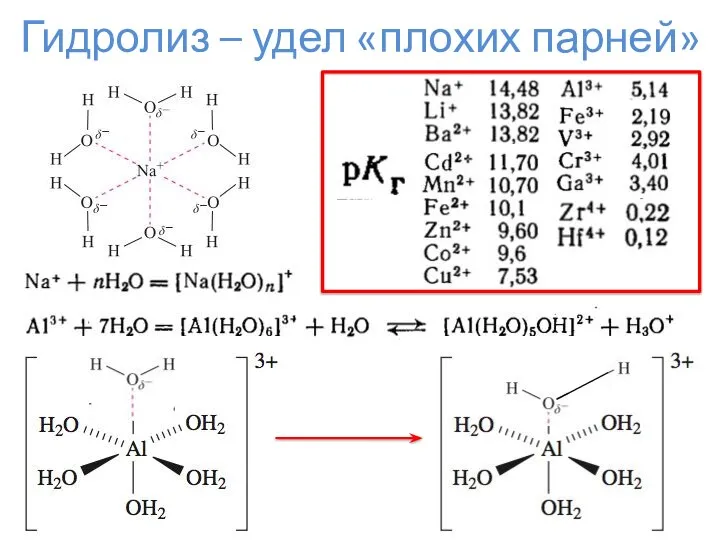
- 11. Гидролиз – удел «плохих парней»
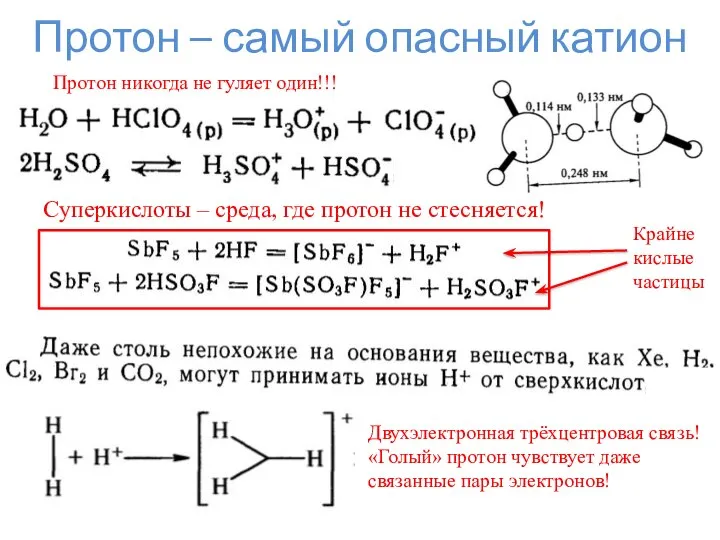
- 12. Протон – самый опасный катион Протон никогда не гуляет один!!! Суперкислоты – среда, где протон не
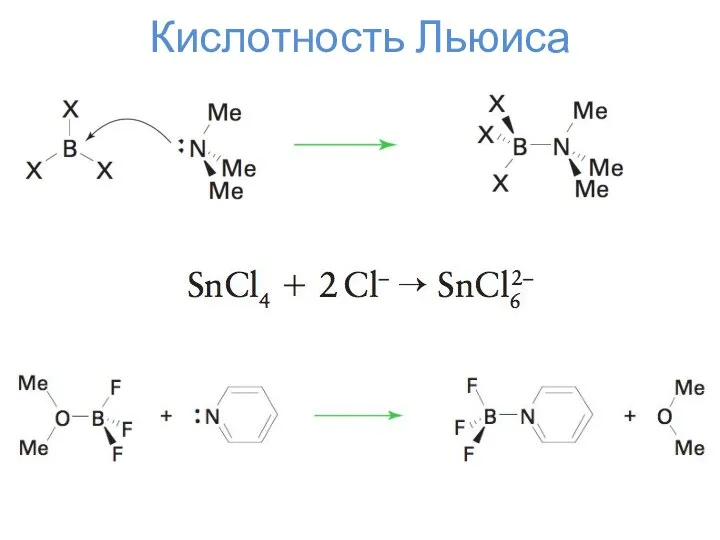
- 13. Кислотность Льюиса
- 14. Амфотерность повсюду!
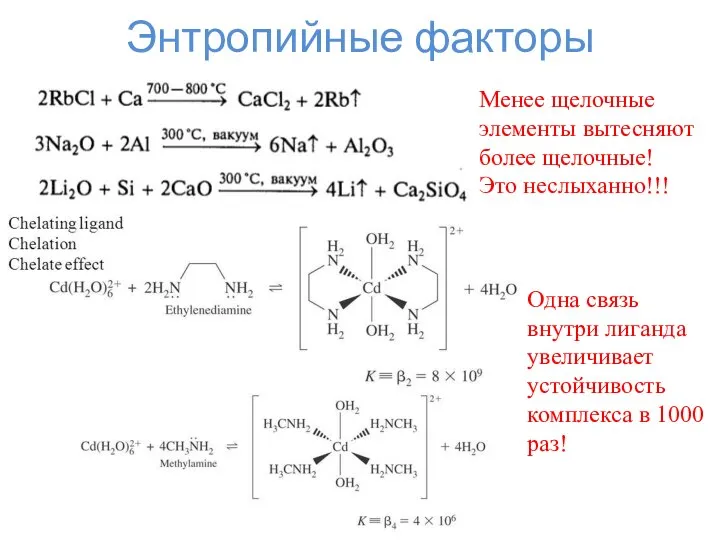
- 15. Энтропийные факторы Менее щелочные элементы вытесняют более щелочные! Это неслыханно!!! Одна связь внутри лиганда увеличивает устойчивость
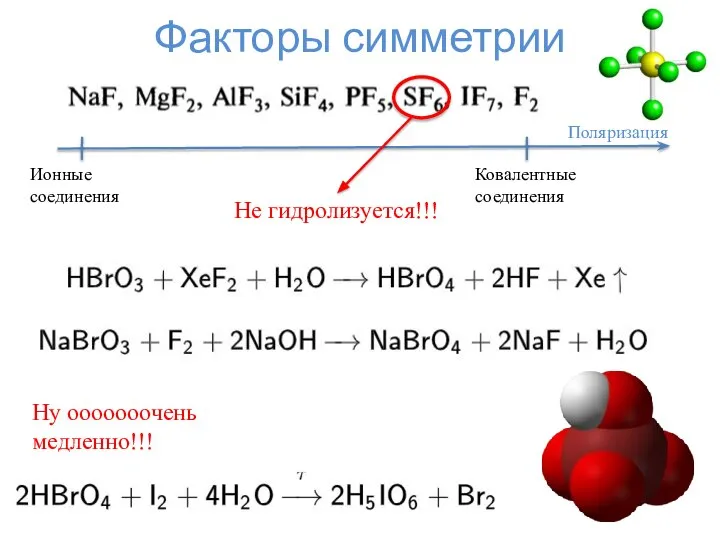
- 16. Факторы симметрии Поляризация Ковалентные соединения Ионные соединения Не гидролизуется!!! Ну ооооооочень медленно!!!
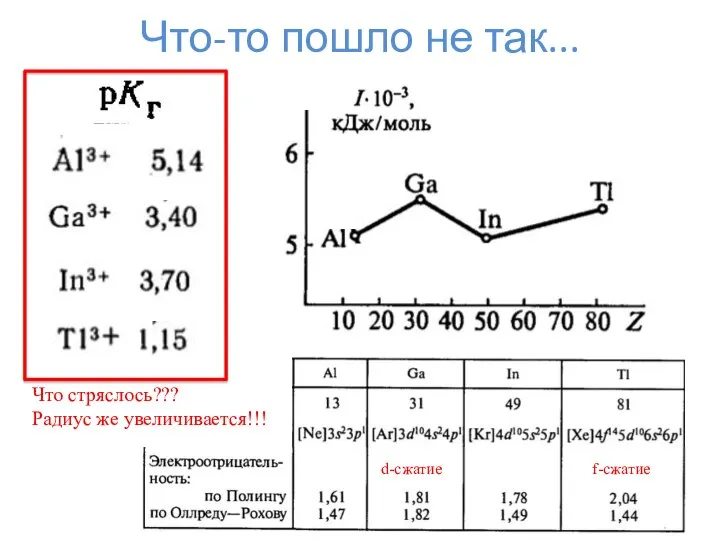
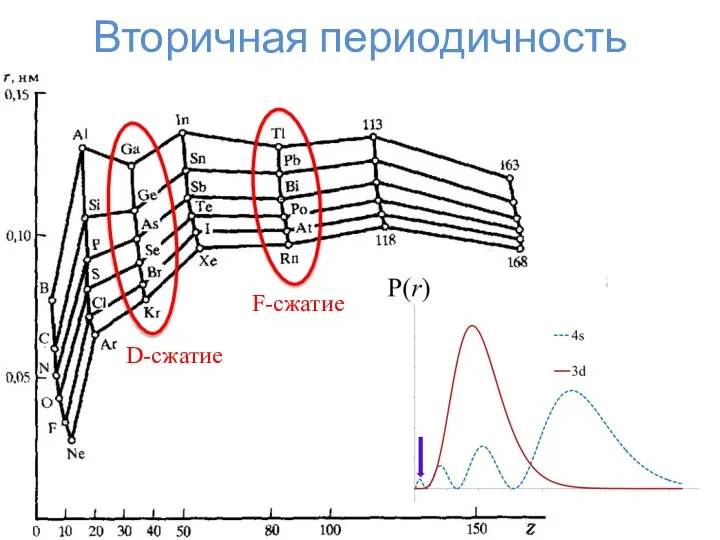
- 17. Что-то пошло не так... Что стряслось??? Радиус же увеличивается!!! d-сжатие f-сжатие
- 18. Вторичная периодичность D-сжатие F-сжатие
- 20. Скачать презентацию




 Атмосферный цикл соединений азота
Атмосферный цикл соединений азота Лекарственные вещества (определения и классификация)
Лекарственные вещества (определения и классификация) Ион алмасу әдістері арқылы қолданылатын ионидтер. Ионидтерге қойылатын талаптар
Ион алмасу әдістері арқылы қолданылатын ионидтер. Ионидтерге қойылатын талаптар Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Коррозия металлов
Коррозия металлов Строение и свойства белков
Строение и свойства белков Кислоты и их применение. Классификация кислот
Кислоты и их применение. Классификация кислот Гидроксид калия KOH
Гидроксид калия KOH Кольцевые силикаты и их аналоги
Кольцевые силикаты и их аналоги Коррозия металлов
Коррозия металлов Основное уравнение молекулярно-кинетической теории. Тест
Основное уравнение молекулярно-кинетической теории. Тест Гетерофункциональные соединения
Гетерофункциональные соединения Презентация по Химии "Способы получения металлов" - скачать смотреть
Презентация по Химии "Способы получения металлов" - скачать смотреть  Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Валидация титриметрических методик анализа
Валидация титриметрических методик анализа Теоретическая электрохимия, часть 1
Теоретическая электрохимия, часть 1 Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Фенолы Простые эфиры
Фенолы Простые эфиры Аминокислоты. Стереохимия аминокислот
Аминокислоты. Стереохимия аминокислот Бензол: строение и свойства
Бензол: строение и свойства Химическая связь. Типы кристаллических решеток. Урок №6,7
Химическая связь. Типы кристаллических решеток. Урок №6,7 Кам'яне вугі́лля
Кам'яне вугі́лля  Нафта. Класифікація нафти
Нафта. Класифікація нафти Структура и функции аминокислот с полярным (заряженным отрицательно) радикалом
Структура и функции аминокислот с полярным (заряженным отрицательно) радикалом Кислоты и соли
Кислоты и соли Изучение свойств H2SO4. Практическая работа
Изучение свойств H2SO4. Практическая работа Нафта
Нафта  Группа веществ, изолируемых из биологического материала дистилляцией. (Лекция 11)
Группа веществ, изолируемых из биологического материала дистилляцией. (Лекция 11)