Содержание
- 2. [Co(NH3)6]3+ – комплекс; [Co(NH3)6]Cl3 – комплексное соединение (соль); [Fe(CO)5] – комплекс и комплексное соединение. Комплекс означает
- 3. K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды Координационное число Внутренняя сфера Внешняя сфера Строение комплексного соединения
- 4. Строение комплексного соединения Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет
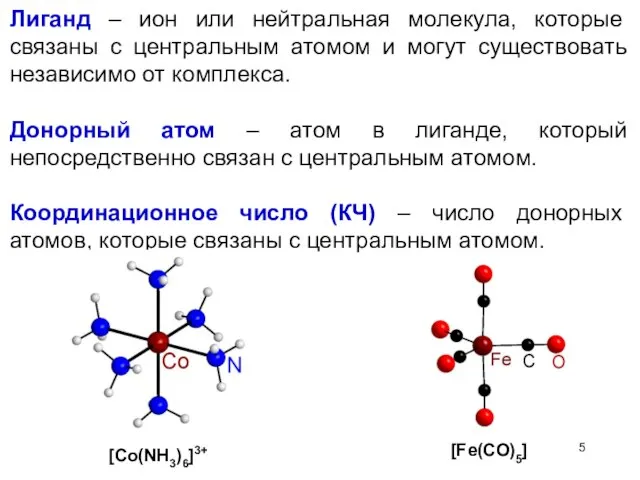
- 5. Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от
- 6. Донорно-акцепторный механизм: лиганд предоставляет электронную пару, а центральный атом вакантную орбиталь. Координационные (комплексные) соединения особенно характерны
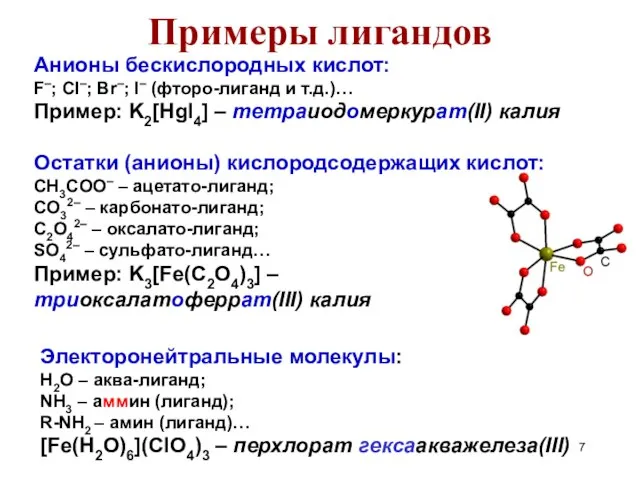
- 7. Анионы бескислородных кислот: F–; Cl–; Br–; I– (фторо-лиганд и т.д.)… Пример: K2[HgI4] – тетраиодомеркурат(II) калия Остатки
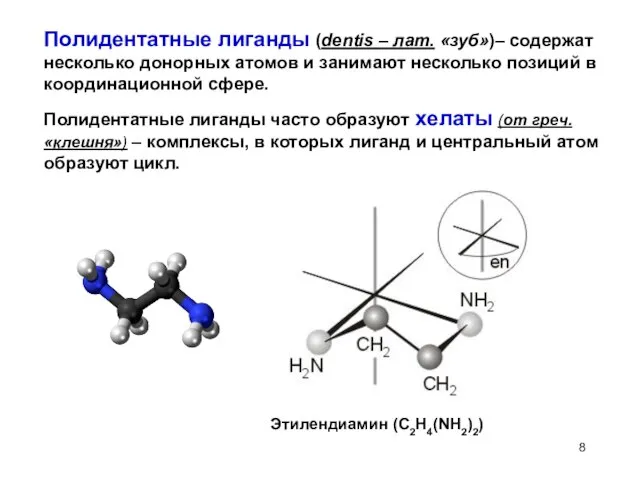
- 8. Полидентатные лиганды (dentis – лат. «зуб»)– содержат несколько донорных атомов и занимают несколько позиций в координационной
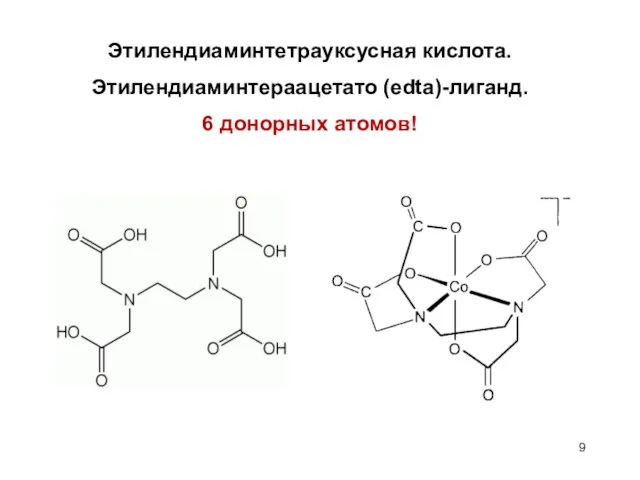
- 9. Этилендиаминтетрауксусная кислота. Этилендиаминтераацетато (edta)-лиганд. 6 донорных атомов!
- 10. ИЗОМЕРИЯ (от др.-греч. ἴσος – «равный», μέρος – «доля, часть») Явление, заключающееся в существовании химических соединений
- 11. Цис- и транс- изомеры, для квадратных частиц. [Pt(Gly)2] – диглицинатоплатина (II) Транс- менее растворим в воде,
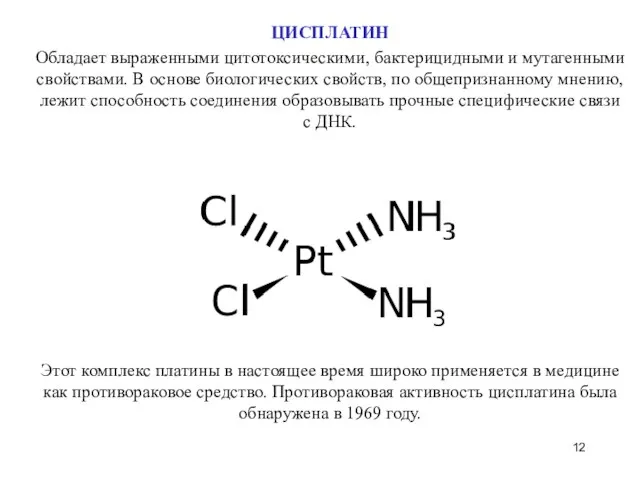
- 12. ЦИСПЛАТИН Обладает выраженными цитотоксическими, бактерицидными и мутагенными свойствами. В основе биологических свойств, по общепризнанному мнению, лежит
- 13. ос- (mer-) реберный гран- (fac-) граневой Для октаэдрических частиц [Pt(NH3)2Cl4] [Co(NH3)3Cl3] транс- (trans-) цис- (cis-) Геометрическая
- 14. Лиганды во внутренней и внешней координационной сфере меняются местами. [Co(NH3)5Cl]CN – пентаамминхлорокобальт (II) цианид [Co(NH3)5СN]Cl –
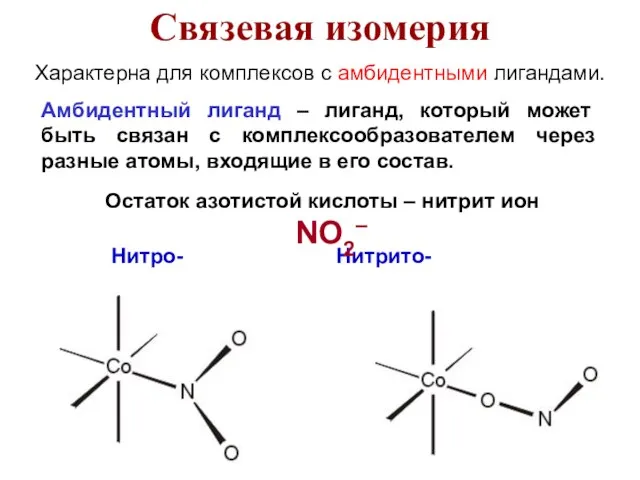
- 15. Характерна для комплексов с амбидентными лигандами. Амбидентный лиганд – лиганд, который может быть связан с комплексообразователем
- 16. для комплексных солей, в которых и катион и анион являются комплексными (CuPt(NH3)4Cl4) [Cu(NH3)4][PtCl4] – фиолетовый цвет
- 17. Cd2+ + CN– = [Cd(CN)]+ K1 = [Cd(CN)+]/[Cd2+][CN–]; [Cd(CN)]+ + CN– = [Cd(CN)2] K2 = [Cd(CN)2]/[
- 18. Константа образования характеризует устойчивость комплексов (в водных растворах). Константа образования характеризует прочность связывания лиганда с металлом
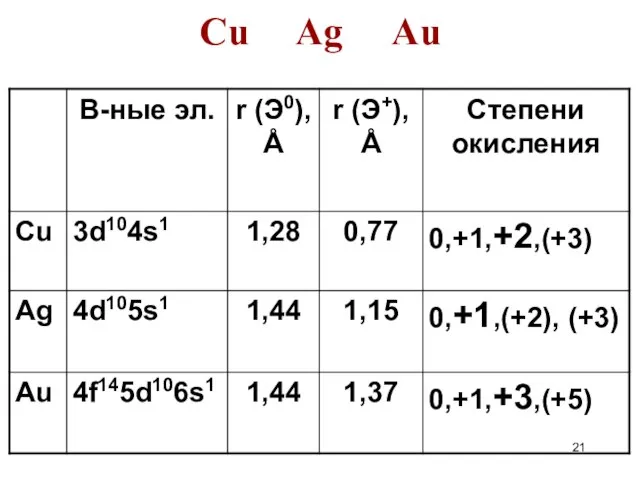
- 19. Побочная подгруппа I группы периодической системы
- 21. Cu Ag Au
- 22. В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au ϕ°, В: +0,34 +0,799 +1,00 ЭIБ
- 23. Cu – 25 место; CuFeS2 (халькорипит), Cu2S (халькозин), 2CuCO3.Cu(OH)2 (азурин), CuCO3.Cu(OH)2 (азурин), самородная Cu Ag –
- 24. Известны с древнейших времен Сu – гр. «кипрос» - остров Кипр. Ag – гр. «аргос» -
- 25. 2Сu2S + 3O2 = 2Cu2O + 2SO2↑ (обжиг) Cu2S + 2Cu2O = 4Cu + SO2↑ (томление,
- 26. Цианидный способ для извлечения Ag и Au Разработан в 1843 г. в России 2M + H2O
- 27. Свойства простых веществ Cu + X2 = CuX2 (X = Cl, Br) Cu + 1/2I2 =
- 28. Реакции с кислотами-окислителями Cu + 2H2SO4 конц. = CuSO4 + SO2↑ + 2H2O Cu + 4HNO3
- 29. Ox-red свойства В кислой среде устойчивы Cu2+ и Ag+; В кислой среде диспропорционируют Cu+ и Au+;
- 30. Соединения Cu+ Эл. конфигурация: d10 , Почти все соединения бесцветны. НО! Cu2O – красного цвета. 4Cu2+
- 31. Н/р соли: CuX (X = Cl, Br, I, CN, SCN). CuF – неизвестен. Растворимые соли Cu+
- 32. Получение нерастворимых солей: Cu2+ + 3I– = CuI↓ + I2 2Cu2+ + 4CN– = 2CuCN↓ +
- 33. Cu2+ + 2OH– = Cu(OH)2↓ голубой Растворяется в кислотах и щелочах. Сu(OH)2 + H2SO4 = CuSO4
- 34. Нерастворимы в воде: CuS, CuCO3 Растворимы в воде: CuX2 (X = Cl, Br, NO3,1/2SO4, ClO4, OAc)
- 35. 2Cu(OH)2↓ + K2S2O8 + 2KOH = 2K2SO4 + 3H2O + Cu2O3↓ KClтв + CuCl2 тв+ F2
- 36. Ag+ – окислительные свойства. Ag+ + 1e = Ag0, E0 = 0,80 В AgNO3 – ляпис,
- 37. 2Ag+ +2OH– = Ag2O↓ + H2O бурый, основ. Ag2O + 2HF = 2AgF + H2O Ag2O
- 38. Комплексы Ag+ Ag2O↓+ 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OH– AgCl↓ + 2NH3 = [Ag(NH3)2]+ +
- 39. Ag2+ и Ag3+ Ag + F2 = AgF2 очень сильный окислитель 4AgF2 + 2H2O = O2
- 40. Au+ Н/р соли: AuX ( X = Cl, Br, I, CN). Диспропорционируют даже н/р: 3AuCl↓ +
- 41. Au3+ Сильные окислители, в основном, комплексы. [AuCl4]– + 3OH– = Au(OH)3↓+ 4Cl– Красно-коричневый, амфотерный. Au(OH)3 +
- 42. Au3+ и Au5+ Au + KrF2 = Kr + AuF5 (устойчив до 200оС) AuF5 = F2
- 43. Побочная подгруппа II группы периодической системы
- 45. Валентные электроны: Zn: [Ar]3d104s2 Cd:[Kr]4d105s2 Hg: [Xe]4f145d106s2 Zn Cd Hg
- 46. Zn – 24 место; ZnS (сфалерит), ZnO (цинкит). Cd – 48 место; CdS (гринокит), CdCO3 (отавит).
- 47. Открытие элементов Zn – производство в Индии с XII века; сплав с медью (латунь) до н.э.;
- 48. Получение Zn и Cd В природе: ZnS – сфалерит (цинковая обманка), Cd сопутствует Zn в рудах
- 49. Hg В природе: HgS (киноварь), самородная ртуть HgS + O2 = Hg + SO2↑ HgS +
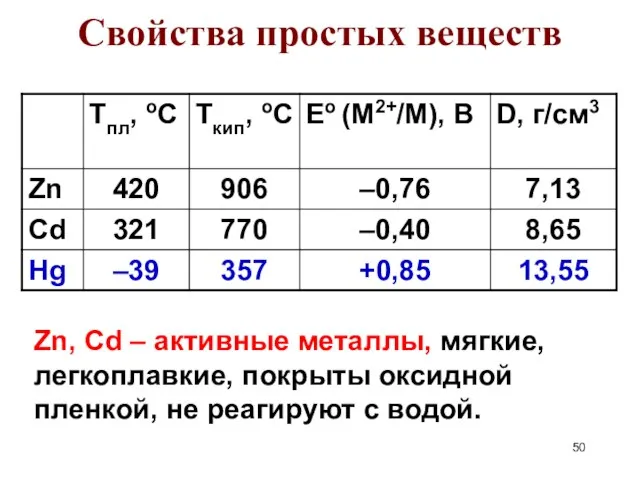
- 50. Свойства простых веществ Zn, Cd – активные металлы, мягкие, легкоплавкие, покрыты оксидной пленкой, не реагируют с
- 51. Свойства простых в-в M + H2SO4 разб = MSO4 + H2↑ (M = Zn, Cd) Zn
- 52. Сравнение соединений Zn и Cd Сходство: Растворимые соли: MX2 (X = Cl, Br, NO3, 1/2SO4) Н/р
- 53. Оксиды/гидрокcиды ZnO/Zn(OH)2 – амфотерные свойства: Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O Zn(OH)2 + 2NaOH =
- 54. Амальгамы MxHgy в зависимости от соотношения x и y могут быть жидкими или твердыми. M =
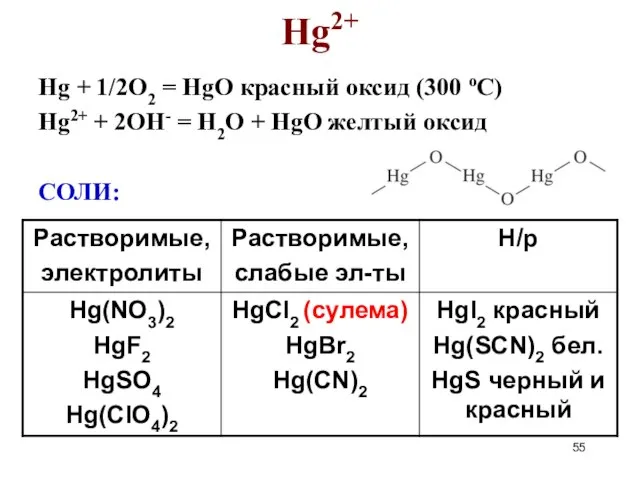
- 55. Hg2+ Hg + 1/2O2 = HgO красный оксид (300 оС) Hg2+ + 2OH- = H2O +
- 56. Соли Hg2+ Гидролиз сильных электролитов: Hg2+ + NO3– +H2O = (HgOH)NO3↓ + H+ белый осадок растворим
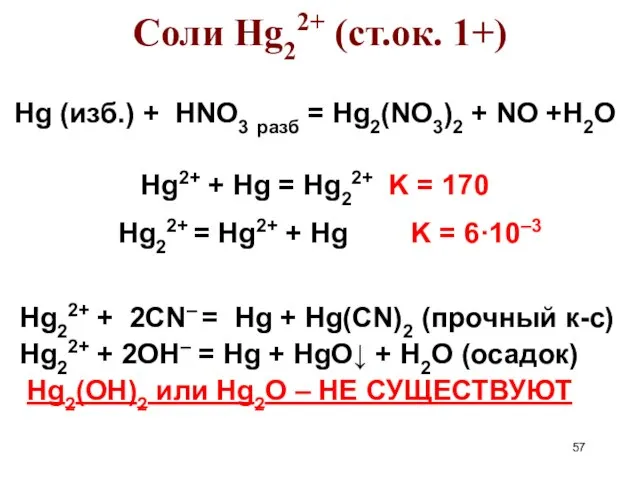
- 57. Соли Hg22+ (ст.ок. 1+) Hg (изб.) + HNO3 разб = Hg2(NO3)2 + NO +H2O Hg2+ +
- 58. [H2O–Hg–Hg–OH2]2+, [X–Hg–Hg–X] Растворимые соли: Hg2(NO3)2, Hg2F2 Нерастворимые соли: Hg2X2 (X = Cl, Br, I) Гидролиз растворимых
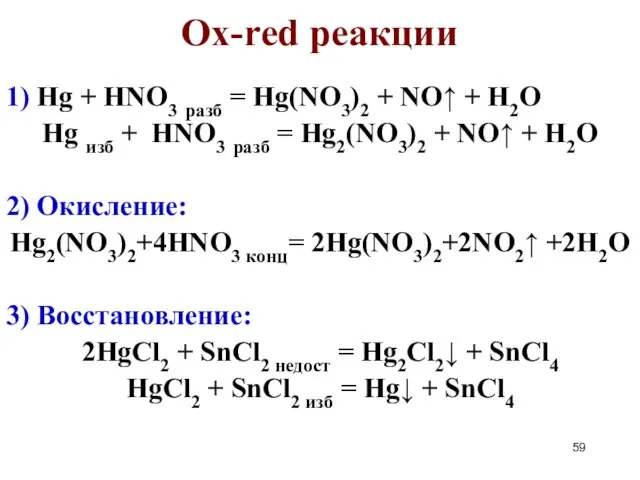
- 59. Ox-red реакции 1) Hg + HNO3 разб = Hg(NO3)2 + NO↑ + H2O Hg изб +
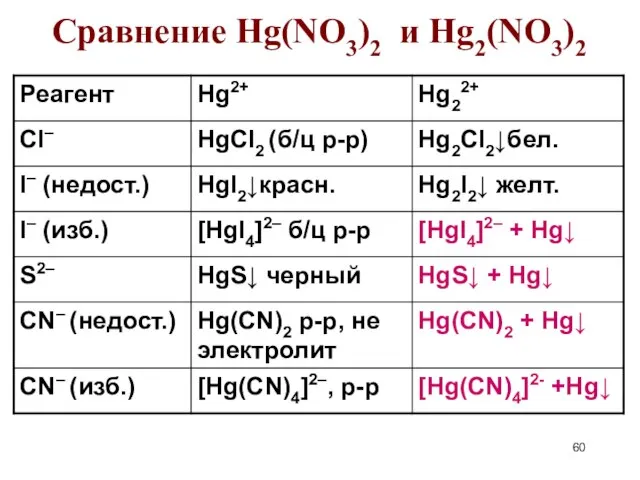
- 60. Сравнение Hg(NO3)2 и Hg2(NO3)2
- 61. Побочная подгруппа III группы периодической системы (f-элементы)
- 62. 14 лантаноидов (4f элементы) относятся к РЗЭ Ac и 14 актиноидов (5f элементы) – радиоактивны
- 63. Распространенность РЗЭ Pm – радиоактивен 145Pm61 t1/2 = 26 лет Cамый редкий из стабильных - тулий
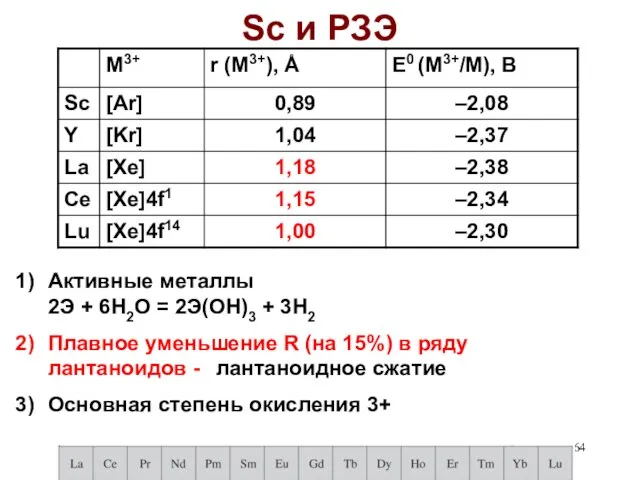
- 64. Sc и РЗЭ Активные металлы 2Э + 6H2О = 2Э(ОН)3 + 3H2 Плавное уменьшение R (на
- 65. Лантаноидное сжатие У лантаноидов (как и у актиноидов) увеличение атомного номера приводит не к повышению, а
- 66. Основные соединения Оксиды M2O3 – тугоплавкие, плохо растворимы в воде, растворимы в кислотах. Но: La2O3 +
- 67. Разделение РЗЭ Проблема разделения: близкие ионные радиусы Ионобменная хроматография хлоридов: LnCl3 + 3RH = R3Ln +
- 68. Ce 4f26s2 4f06s0 (Ce4+) Eu 4f76s2 4f76s0 (Eu2+) Gd 4f75d16s2 4f76s0 (Gd3+) Tb 4f96s2 4f76s0 (Tb4+)
- 69. Степень окисления +4 Ce4+: [Xe] CeO2, CeF4 Pr4+: [Xe]4f1 PrO2 (pO2 280 атм, 400˚C); PrF4 Но
- 70. Степени окисления +2 Sm2+: [Xe]4f6 SmI2 Eu2+: [Xe]4f7 EuO, EuX2, EuSO4 (н/р), EuCO3 (н/р) Yb2+: [Xe]4f14
- 71. Комплексы лантаноидов Аквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9 с); Предпочитают координацию по кислороду;
- 72. Актиноиды
- 73. Актиноиды Актиноидное сжатие – уменьшение R(M3+) от 1,26 Å для Ac до 1,02 Å для Lr
- 74. Актиноиды Все радиоактивны 232Th t1/2 = 3,28.1010 лет; 238U t1/2= 4,47.109 лет; 251Cf t1/2= 900 лет;
- 75. Ac (актиний), Th (торий), Pa (протактиний) Ac3+ - похож на La 227Ac t1/2= 22 года Ac2O3;
- 76. Pa5+ - похож на Nb5+ и Ta5+ Продукт распада урана, получены десятки грамм. Pa(OH)5 – слабые
- 77. Атомная станция Фукусима-1 235UO2 – топливо
- 78. U 238U – 99% t1/2= 4.5 млрд. лет 235U – 0,75% - наиболее важен t1/2= 0.7
- 79. U Урановая кислота-H2UO4 ≡ UO2(OH)2-основание уранила 2H2UO4 + 2NaOH → Na2U2O7 + 3H2O (→Na2UO4) – уранаты
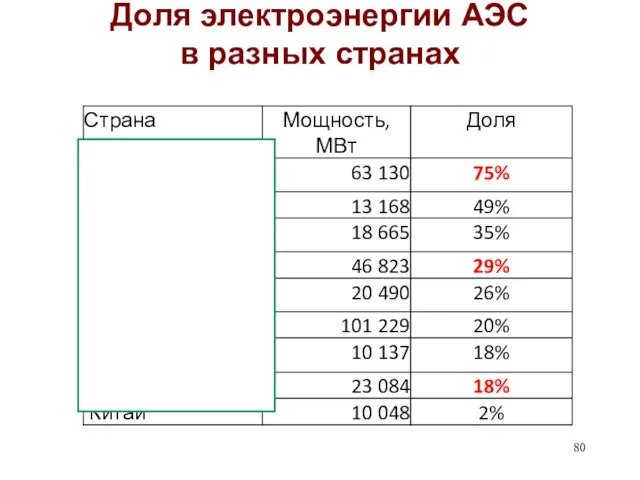
- 80. Доля электроэнергии АЭС в разных странах
- 81. Применение Ядерное горючее – 235U, 238U, 239Pu В перспективе – 233U (из 232Th); 2. Портативные источники
- 82. Ядерные реакции Образование трансурановых элементов в ядерном реакторе происходит по следующим схемам: 235U + n →
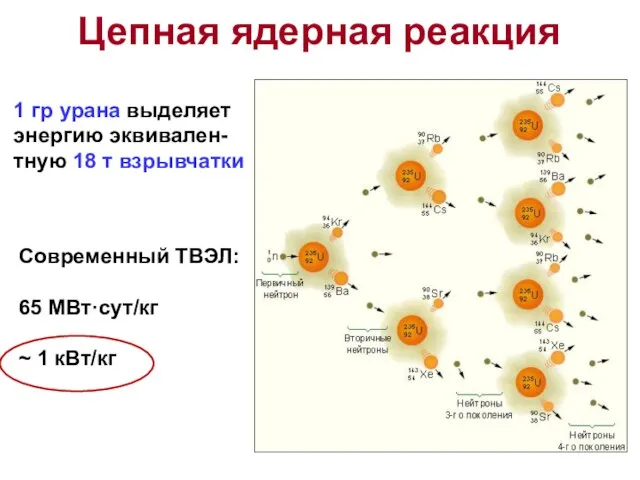
- 83. Цепная ядерная реакция 1 гр урана выделяет энергию эквивален- тную 18 т взрывчатки Современный ТВЭЛ: 65
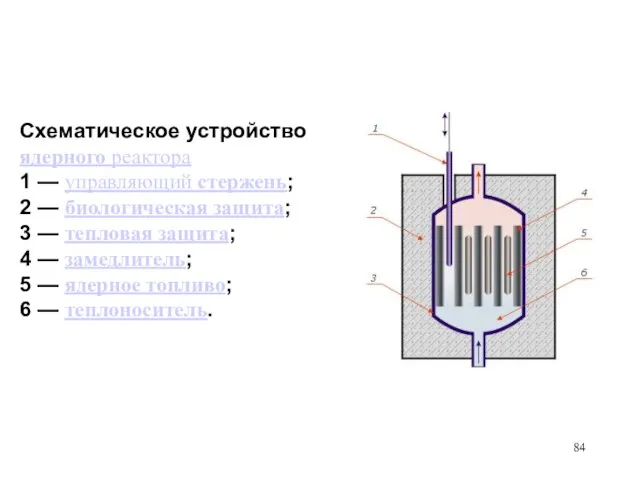
- 84. Схематическое устройство ядерного реактора 1 — управляющий стержень; 2 — биологическая защита; 3 — тепловая защита;
- 86. Скачать презентацию
![[Co(NH3)6]3+ – комплекс; [Co(NH3)6]Cl3 – комплексное соединение (соль); [Fe(CO)5] – комплекс](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-1.jpg)
![K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды Координационное число Внутренняя сфера Внешняя сфера Строение комплексного соединения](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-2.jpg)
![Строение комплексного соединения Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-3.jpg)


![Цис- и транс- изомеры, для квадратных частиц. [Pt(Gly)2] – диглицинатоплатина (II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-10.jpg)
![ос- (mer-) реберный гран- (fac-) граневой Для октаэдрических частиц [Pt(NH3)2Cl4] [Co(NH3)3Cl3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-12.jpg)
![Лиганды во внутренней и внешней координационной сфере меняются местами. [Co(NH3)5Cl]CN –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-13.jpg)

![Cd2+ + CN– = [Cd(CN)]+ K1 = [Cd(CN)+]/[Cd2+][CN–]; [Cd(CN)]+ + CN–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-16.jpg)



![В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au ϕ°,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-21.jpg)















![Комплексы Ag+ Ag2O↓+ 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OH– AgCl↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-37.jpg)


![Au3+ Сильные окислители, в основном, комплексы. [AuCl4]– + 3OH– = Au(OH)3↓+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-40.jpg)


![Валентные электроны: Zn: [Ar]3d104s2 Cd:[Kr]4d105s2 Hg: [Xe]4f145d106s2 Zn Cd Hg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-44.jpg)









![[H2O–Hg–Hg–OH2]2+, [X–Hg–Hg–X] Растворимые соли: Hg2(NO3)2, Hg2F2 Нерастворимые соли: Hg2X2 (X =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-57.jpg)







![Степень окисления +4 Ce4+: [Xe] CeO2, CeF4 Pr4+: [Xe]4f1 PrO2 (pO2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-68.jpg)
![Степени окисления +2 Sm2+: [Xe]4f6 SmI2 Eu2+: [Xe]4f7 EuO, EuX2, EuSO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-69.jpg)
![Комплексы лантаноидов Аквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/536082/slide-70.jpg)









 Спін-спінова взаємодія в спектрах ямр
Спін-спінова взаємодія в спектрах ямр Полимеры
Полимеры  В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми
В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми  Физико-химические и электро-физические свойства А3В5. Сравнительный анализ
Физико-химические и электро-физические свойства А3В5. Сравнительный анализ Атомно – молекулярное учение
Атомно – молекулярное учение Нефть в США. История. Запасы и прогноз
Нефть в США. История. Запасы и прогноз Классификация электродов. (Лекция 4)
Классификация электродов. (Лекция 4) Сахароза
Сахароза Основные сведения о строении атома
Основные сведения о строении атома Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Минеральные удобрения
Минеральные удобрения Ядерный магнитный резонанс. (Лекция 8)
Ядерный магнитный резонанс. (Лекция 8) Фазовые равновесия раствор-пар в двухкомпонентных системах из двух летучих жидкостей
Фазовые равновесия раствор-пар в двухкомпонентных системах из двух летучих жидкостей Щелочные металлы
Щелочные металлы Алканы и циклоалканы
Алканы и циклоалканы Полудрагоценные камни
Полудрагоценные камни Двойной электрический слой на границе раздела твердое тело. Раствор электролита
Двойной электрический слой на границе раздела твердое тело. Раствор электролита Презентация по Химии "Открытия и изобретения в химии" - скачать смотреть
Презентация по Химии "Открытия и изобретения в химии" - скачать смотреть  VI группа периодической системы Д.И. Менделеева
VI группа периодической системы Д.И. Менделеева Промышленная очистка воды
Промышленная очистка воды Перекисное окисление липидов
Перекисное окисление липидов Презентация Щелочные металлы
Презентация Щелочные металлы  Олимпиада по химии
Олимпиада по химии Группа галогенов в периодической системе
Группа галогенов в периодической системе Гидрокаталитические процессы
Гидрокаталитические процессы Полимеризация циклов. Сополимеризация
Полимеризация циклов. Сополимеризация Жувальна гумка Виконав учень 11-Б Надворний Ярослав
Жувальна гумка Виконав учень 11-Б Надворний Ярослав  Строение белков и их значение для организма “Жизнь – форма существования белковых тел.”
Строение белков и их значение для организма “Жизнь – форма существования белковых тел.”