Содержание
- 3. Электроды I рода Me | Mez+
- 4. Электроды I рода Cu в растворе CuSO4 Cu | Cu2+
- 5. Электроды II рода Me, MeyAz | Ay–
- 6. Хлорсеребряный электрод Ag, AgCl | Cl– — электрод сравнения
- 7. Хлорсеребряный электрод Ag, AgCl Раствор KCl Ag, AgCl | KClнас.
- 8. Электроды II рода Hg, HgO | OH– Оксидно-ртутный электрод
- 9. Окислительно-восстановительные электроды Pt | Ox, Red
- 10. Окислительно-восстановительные электроды Pt | Fe3+, Fe2+
- 11. Окислительно-восстановительные электроды
- 12. Хингидронный электрод — индикаторный электрод для измерения pH
- 13. Водородный электрод — индикаторный электрод для измерения pH
- 14. Измерение pH KCl | AgCl, Ag Водный раствор KCl, загущённый агар-агаром («солевой мостик»)
- 15. Измерение pH
- 16. Ионселективные электроды Ag, AgCl 0,1M HCl Стеклянный электрод Спец. стекло
- 17. Стеклянный электрод
- 18. Ионселективные электроды Есть стеклянные электроды, селективные к ионам: Na+, K+, Li+, Cs+, NH4+, Ag+, Tl+, органическим
- 19. Классификация электрохимических цепей по источнику получения ЭДС
- 20. Химическая кинетика — изучает закономерности протекания химических процессов во времени
- 21. Основные понятия химической кинетики Скорость химической реакции — …
- 22. Основные понятия химической кинетики Если V (или S) = const — Скорость химической реакции — положительна!
- 23. Основные понятия химической кинетики Скорость химической реакции общая и по веществу
- 24. Основные понятия химической кинетики Скорость химической реакции общая и по веществу
- 25. Основные понятия химической кинетики Реагируют только те молекулы, которые сталкиваются, поэтому скорость реакции пропорциональна числу сталкивающихся
- 26. Основные понятия химической кинетики
- 27. Основные понятия химической кинетики k — константа скорости реакции — скорость реакции при концентрациях реагирующих веществ,
- 28. Основные понятия химической кинетики Молекулярность реакции — число молекул, реагирующих в элементарном акте реакции. Молекулярность реакции
- 29. Основные понятия химической кинетики Общий порядок реакции может совпадать с молекулярностью, если реакция простая и протекает
- 30. Кинетика простых химических реакций Простые химические реакции — реакции, необратимо протекающие в одну стадию.
- 31. Кинетика простых химических реакций
- 32. Кинетика простых химических реакций
- 33. Кинетика простых химических реакций
- 34. Кинетика простых химических реакций
- 35. Кинетика простых химических реакций
- 36. Кинетика простых химических реакций
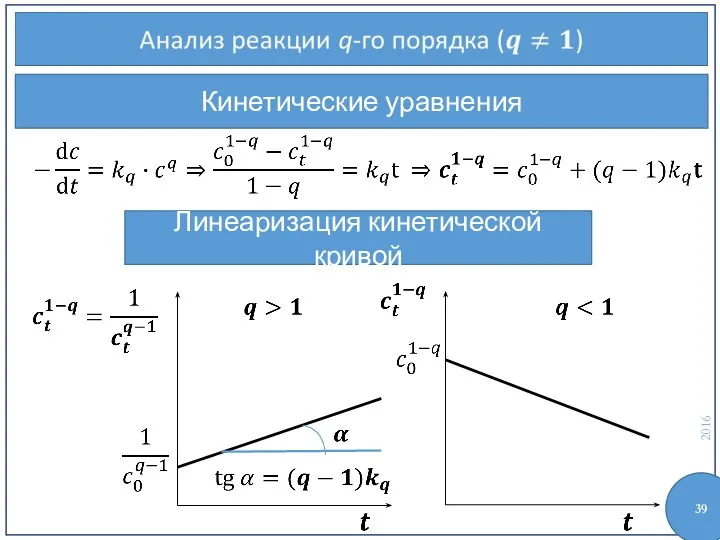
- 37. Анализ реакции первого порядка (q = 1) Кинетические уравнения Линеаризация кинетической кривой Время полупревращения
- 38. Кинетические уравнения
- 39. Кинетические уравнения Линеаризация кинетической кривой
- 40. Кинетические уравнения Время полупревращения
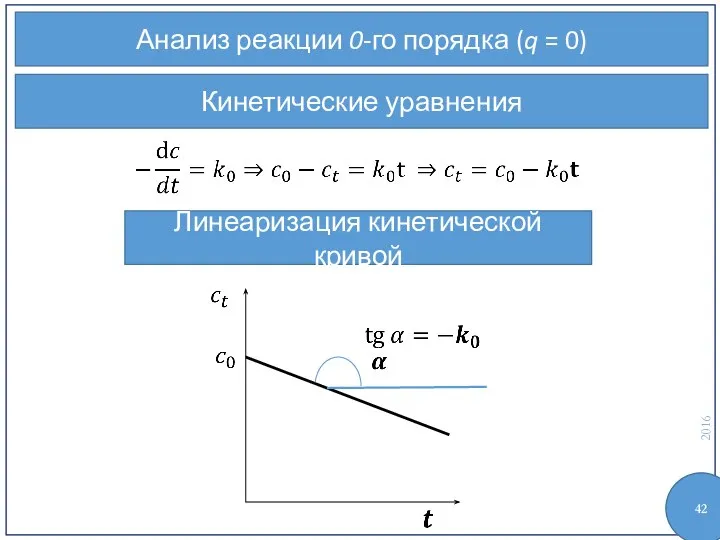
- 41. Анализ реакции 0-го порядка (q = 0) Кинетические уравнения
- 42. Анализ реакции 0-го порядка (q = 0) Кинетические уравнения Линеаризация кинетической кривой
- 43. Кинетические уравнения Время полупревращения
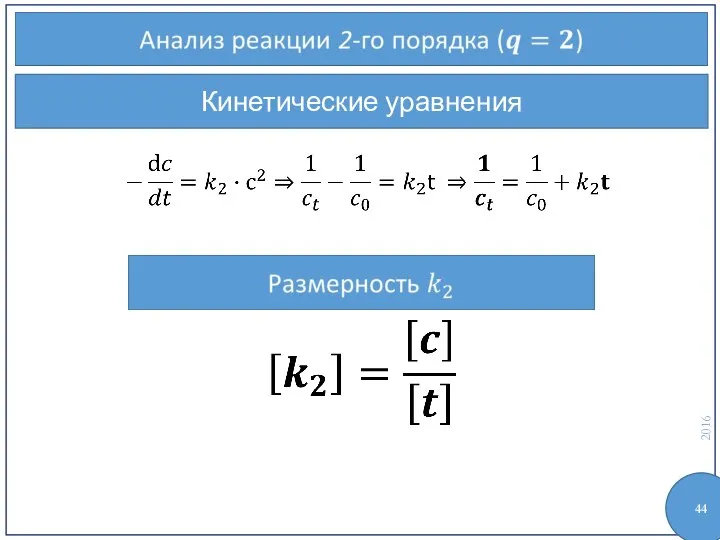
- 44. Кинетические уравнения
- 45. Кинетические уравнения Линеаризация кинетической кривой
- 46. Кинетические уравнения Время полупревращения
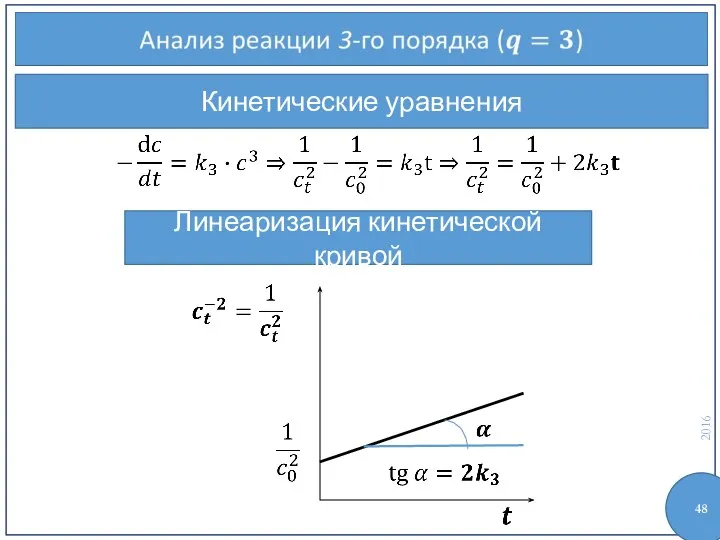
- 47. Кинетические уравнения
- 48. Кинетические уравнения Линеаризация кинетической кривой
- 49. Кинетические уравнения Время полупревращения
- 50. Влияние температуры на скорость реакции Правило Вант-Гоффа Соблюдается не для всех реакций!
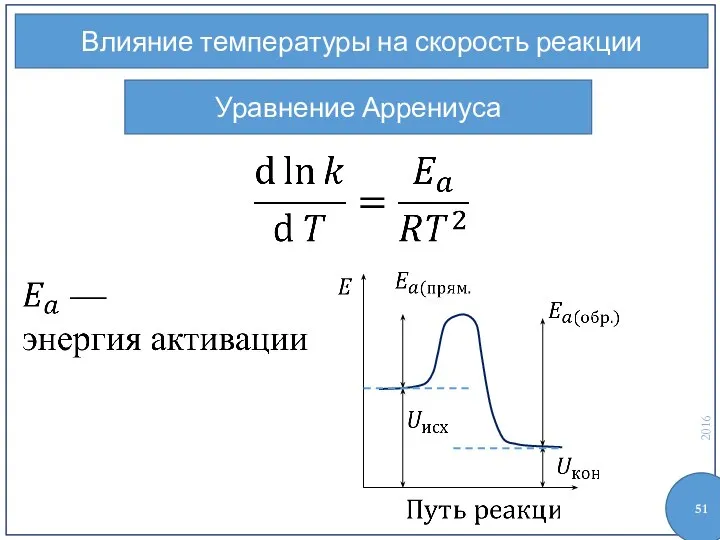
- 51. Влияние температуры на скорость реакции Уравнение Аррениуса
- 52. Влияние температуры на скорость реакции Уравнение Аррениуса
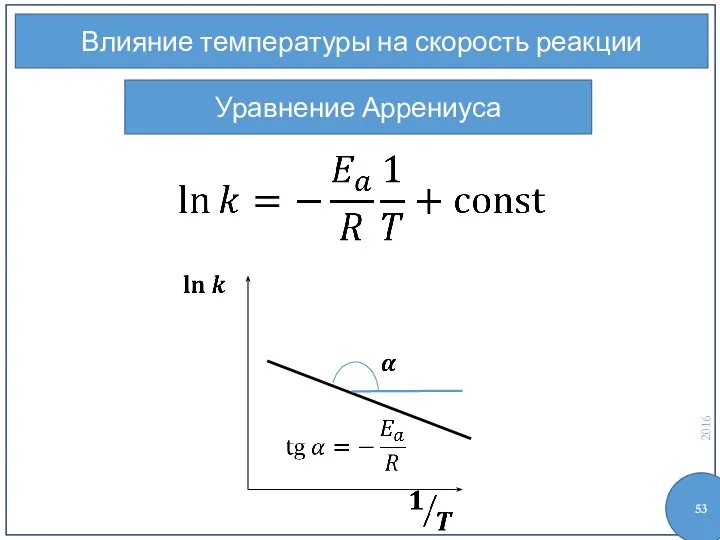
- 53. Влияние температуры на скорость реакции Уравнение Аррениуса
- 55. Скачать презентацию














































 Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Получение и приминение этилена
Получение и приминение этилена Презентация по Химии "Почему золото блестит?" - скачать смотреть
Презентация по Химии "Почему золото блестит?" - скачать смотреть  Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. 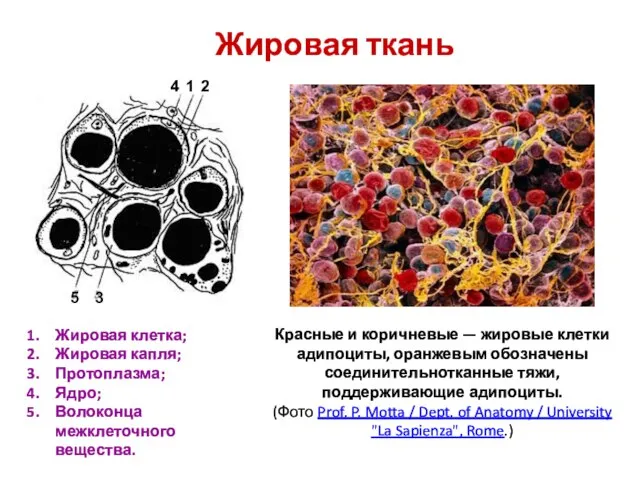 Жировая ткань
Жировая ткань Зависимость константы скорости химической реакции от температуры
Зависимость константы скорости химической реакции от температуры История микроскопа
История микроскопа  Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Клиническая фармакология антибактериальных препаратов
Клиническая фармакология антибактериальных препаратов Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Химический элемент натрий
Химический элемент натрий Ковалентная химическая связь
Ковалентная химическая связь Транс-жиры
Транс-жиры Обмен липидов
Обмен липидов Метаболизм углеводов
Метаболизм углеводов Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В.
Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В. Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Водородная связь
Водородная связь Разделение смесей
Разделение смесей Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват Дисперсные системы и растворы
Дисперсные системы и растворы Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В.
Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В. Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Соли. Названия и классификация солей
Соли. Названия и классификация солей