Содержание
- 2. Наиболее часто встречающимися окислителями являются О2, а в кислых средах H3O -ионы. Поскольку равновесные потенциалы водородного
- 3. 2Н30+ + 2е = Н2 + 2Н20 (1) 02 + 2Н20 + 4е = 4ОН- (2)
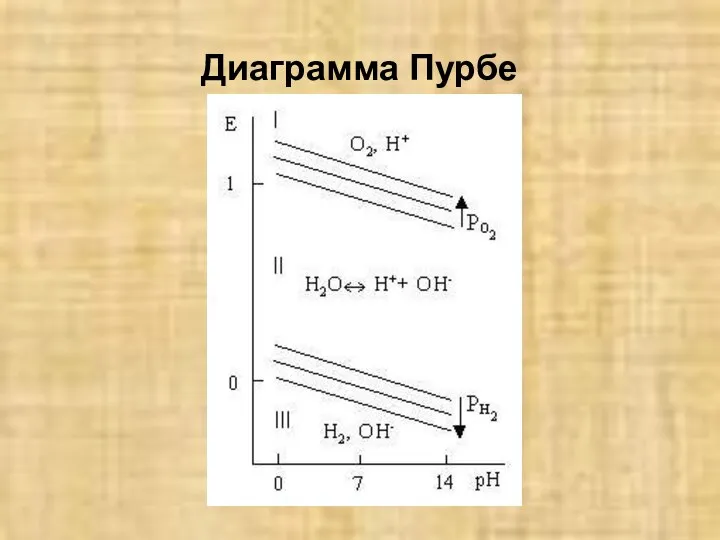
- 4. Диаграмма Пурбе
- 5. На диаграмме, разделенной линиями PE=f(pH) имеются области термодинамической устойчивости 02, Н2, а также воды, диссоциирующей на
- 6. Если pE металла находится в области I, он не может корродировать ни с водородной, ни с
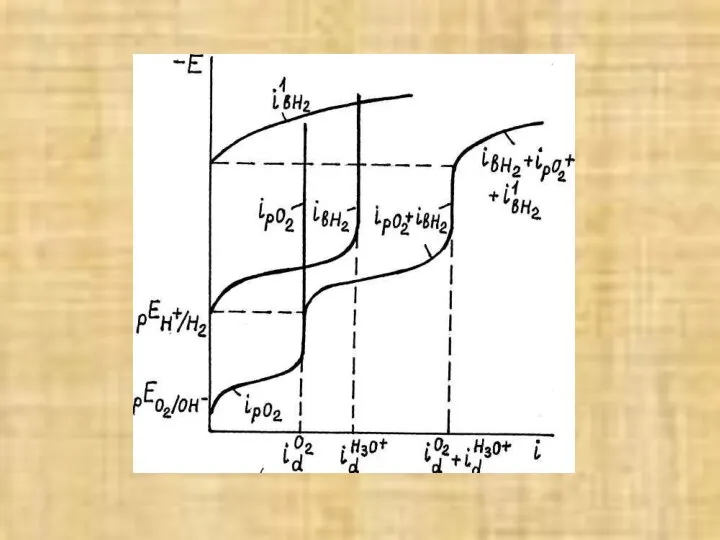
- 7. Поляризационные кривые Скорость катодных реакций зависит от Е по кинетическому уравнению: E = pEОx/R – (a
- 9. Этот процесс протекает, когда при поверхностная концентрация Н30+ равна 0. Поэтому равновесный бестоковый потенциал для этой
- 10. Кислородная деполяризация обычно протекает в области предельного диффузионного тока из-за низкой растворимости 02, малого D, а
- 11. В первые промежутки времени I dO2 несколько растет за счет первого фактора, который является наиболее быстродействующим,
- 12. Механизм кислородной деполяризации Суммарные процессы кислородной деполяризации) можно разбить на две двухэлектронные стадии: O2 +2 H+
- 14. Этот маршрут процесса доказывается появлением в растворе H2O2. При интенсивном перемешивании раствора или под очень тонкими
- 15. Кинетика и механизмы водородной деполяризации Водородная деполяризация в кислых средах протекает с электрохимическим или реакционным перенапряжением.
- 17. Природа M оказывает существенное влияние на ηН, например, на ртути и платине равно соответственно 7⋅10-9 А/м2
- 18. По другим представлениям, такой маршрут и механизм имеют только анодно активированные платиновые М. В остальных случаях
- 19. При замедленных стадиях разряда, электрохимической десорбции и рекомбинации (молизации) выделение водорода при ηH> 120мВ описывается прямой.
- 20. Наводороживание и водородная хрупкость Наводороживание М (абсорбция водорода М) в результате кислотной коррозии и катодной электрохимической
- 21. основные теории водородной хрупкости Теория давления молекулярного водорода в коллекторах ("ловушках") базируется на представлении о проникновении
- 23. Скачать презентацию









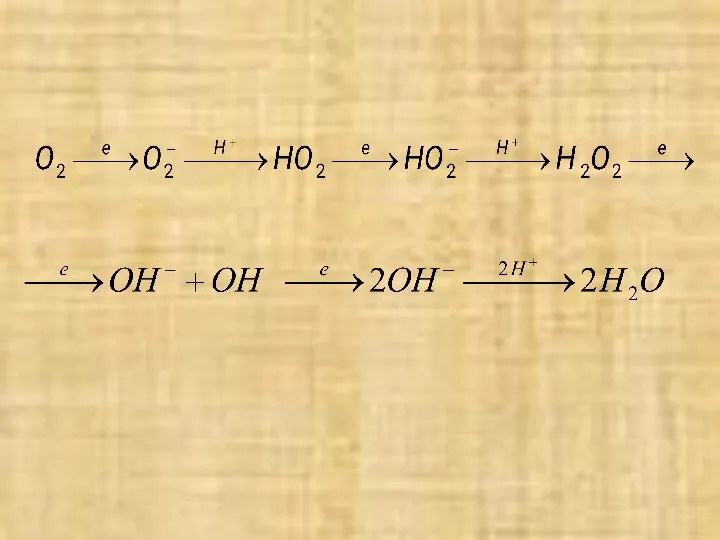


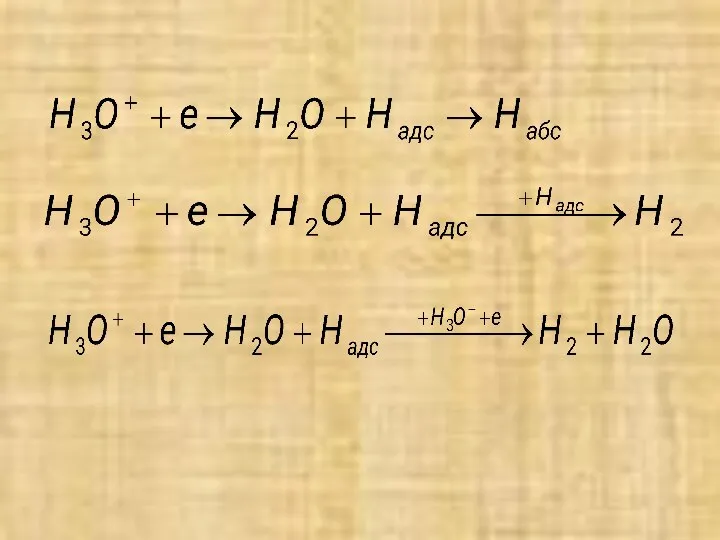





 Атом. Будова атома
Атом. Будова атома ЛЕКЦИЯ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ и КЛЕТОЧНЫЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ. ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ и его ХАРАКТЕРИСТИКИ. РЕПЛИКАЦИ
ЛЕКЦИЯ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ и КЛЕТОЧНЫЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ. ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ и его ХАРАКТЕРИСТИКИ. РЕПЛИКАЦИ Склероглюкан
Склероглюкан Биотехнологии Генная инженерия
Биотехнологии Генная инженерия  Полимерные реагенты в бурении
Полимерные реагенты в бурении Керамика
Керамика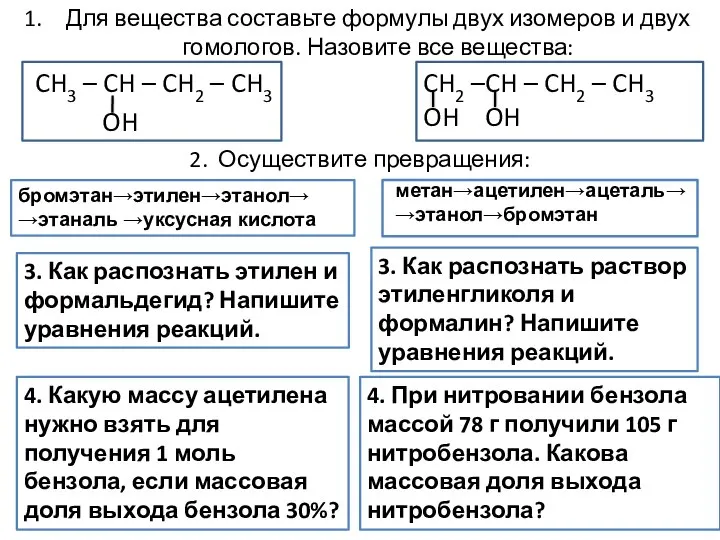 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Полимеры. Строение, способ образования, особенности, применение полимеров
Полимеры. Строение, способ образования, особенности, применение полимеров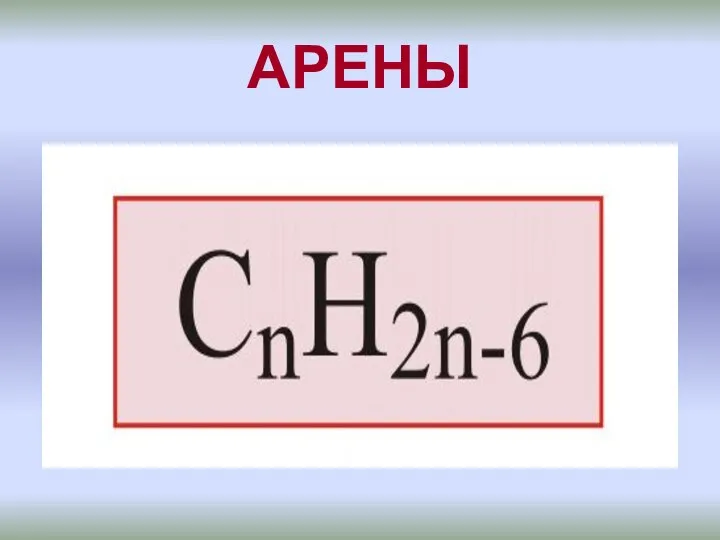 Бензоидные ароматические углеводороды - арены
Бензоидные ароматические углеводороды - арены Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти
Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти  Готовимся к ЕГЭ Окислительно-восстановительные реакции
Готовимся к ЕГЭ Окислительно-восстановительные реакции Платина. Знаходження в періодичній системі і основні характеристики
Платина. Знаходження в періодичній системі і основні характеристики Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно
Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно Производство метанола и этанола
Производство метанола и этанола Заттың сұйық фазадағы ерітілген концентрациясының беттік тартылысқа тәуелділігі. Беттік керілу. Дәріс 5
Заттың сұйық фазадағы ерітілген концентрациясының беттік тартылысқа тәуелділігі. Беттік керілу. Дәріс 5 Дисперсные системы. Лиофобные дисперсные системы (часть 1)
Дисперсные системы. Лиофобные дисперсные системы (часть 1) Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П.
Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П.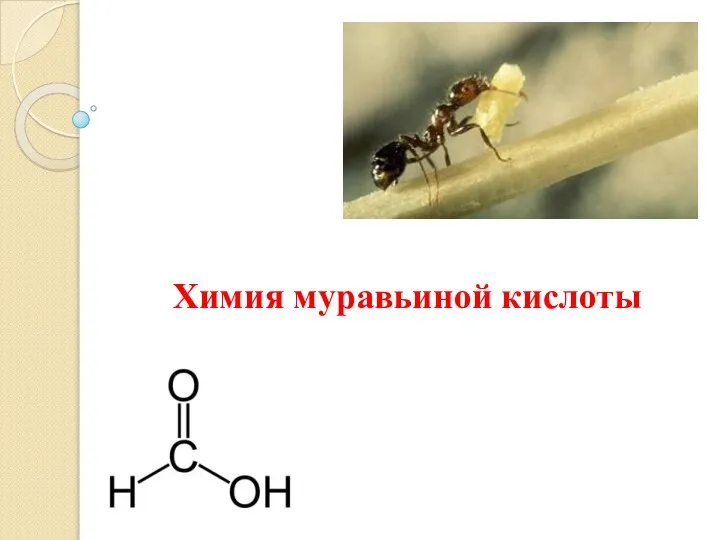 Химия муравьиной кислоты
Химия муравьиной кислоты Органическая химия
Органическая химия Бинарный урок. Минеральные удобрения. (9 класс)
Бинарный урок. Минеральные удобрения. (9 класс) Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая
Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Система микросомального окисления
Система микросомального окисления Бензол и его свойства
Бензол и его свойства Липиды. Классификация, строение, свойства, биологическая роль
Липиды. Классификация, строение, свойства, биологическая роль Биоэнергетика. Современное представление о биологическом окислении
Биоэнергетика. Современное представление о биологическом окислении Липиды. Классификация липидов
Липиды. Классификация липидов Хлор. Состав. Строение
Хлор. Состав. Строение