Содержание
- 2. К чему стремится любой «одинокий» атом? В одиночном состоянии он энергетически нестабилен Атому нужно завершить свой
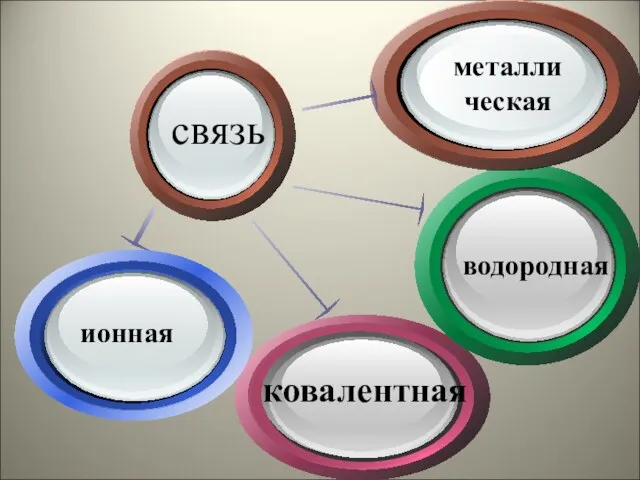
- 3. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
- 4. Валентность – это способность атома элемента образовывать различное число химических связей с другими атомами. Величина валентности
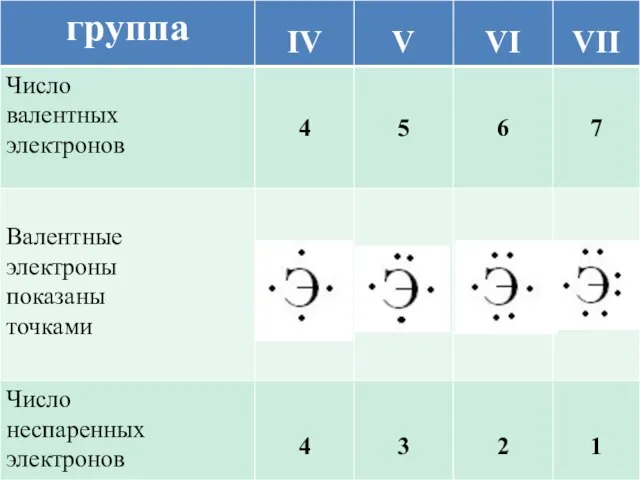
- 5. В образовании химической связи участвуют только валентные электроны. У элементов главных подгрупп это электроны внешнего энергетического
- 6. Click to add Titl водородная металлическая связь
- 7. В образовании ковалентной связи принимают участие неспаренные валентные электроны атома, которые располагаются на внешнем уровне по
- 9. Ковалентная связь – это химическая связь между атомами, осуществляемая при помощи общих электронных пар.
- 10. Неполярная ковалентная связь – связь между атомами элементов-неметаллов, одинаковых по электроотрицательности. Это связь в простых веществах
- 11. Механизм образования ковалентной неполярной связи Неспаренные электроны Общая или поделённая пара электронов Между ядрами образуется сгущение
- 12. Образование ковалентной связи в молекуле хлора (Cl2). +17Cl 2е- 8е- 7е- Для завершения внешнего слоя каждому
- 13. Образование молекулы азота (N2). +7N 2е- 5е- В молекуле азота образуется тройная связь, значит атом азота
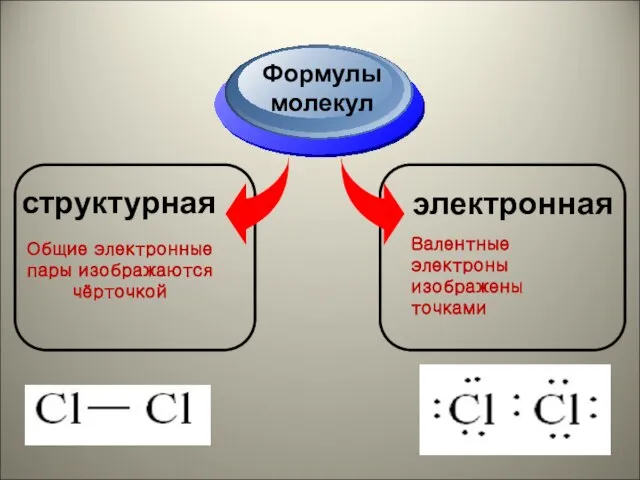
- 14. структурная Формулы молекул электронная Общие электронные пары изображаются чёрточкой Валентные электроны изображены точками
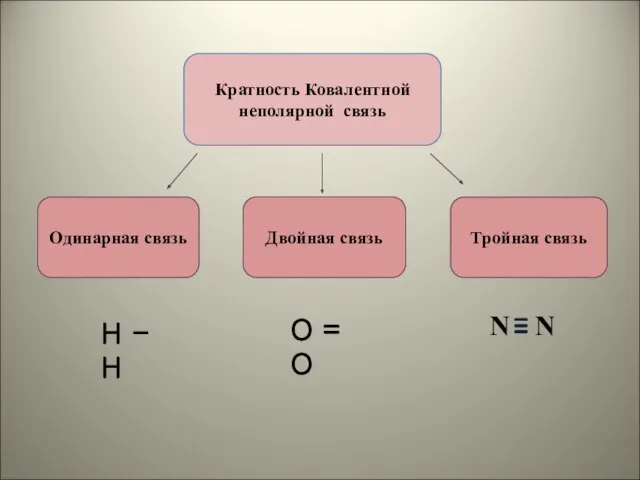
- 15. Кратность Ковалентной неполярной связь Одинарная связь Двойная связь Тройная связь О = О Н - Н
- 16. Длина связи – это расстояние между ядами атомов в молекуле. Чем больше кратность связи, тем меньше
- 18. Полярная ковалентная связь – это связь между элементами – неметаллами с разными значениями электроотрицательности. Это связь
- 19. Образование молекулы хлороводорода (HCl). +1Н 1е- +17Cl 2е- 8е- 7е- Водород и хлор в молекуле хлороводорода
- 20. Укажите вид ковалентной связи HF O 2 2 2 N H S P H H 3
- 21. Неполярная ковалентная связь O 2 N 2 H 2 S 8
- 22. полярная ковалентная связь HF H 2 S P H 3 SO 2
- 23. Ковалентная связь Неполярная Полярная H2, O2, N2, Cl2 H2S, NH3, HCl
- 24. Практическая часть. Составьте схему строения атома кислорода. Подчеркните валентные электроны и обозначьте их точками вокруг символа
- 25. ОТВЕТЫ. +8О 2е- 6е- Число валентных электронов равно 6,из них неспаренных - 2 (8 – 6
- 27. Скачать презентацию




















 Хімічні зв’язки
Хімічні зв’язки Минерал клинохлор. Месторождения
Минерал клинохлор. Месторождения Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Нітрати в продуктах харчування
Нітрати в продуктах харчування  Метаморфические горные породы
Метаморфические горные породы Sample Kit Kemira 3f. External
Sample Kit Kemira 3f. External Биологическое значение элементов неорганоненов и их применение в медицине
Биологическое значение элементов неорганоненов и их применение в медицине Формирование навыков научно-исследовательской деятельности школьников 5-7 классов
Формирование навыков научно-исследовательской деятельности школьников 5-7 классов Физические и химические явления
Физические и химические явления Синтетические лекарственные средства
Синтетические лекарственные средства Школьное мероприятие Д. И. Менделеев в высказываниях Автор: Ким Наталья Викторовна учитель химии
Школьное мероприятие Д. И. Менделеев в высказываниях Автор: Ким Наталья Викторовна учитель химии  Алканы. Строение алканов
Алканы. Строение алканов Разработка технологии получения раствора коагулянта в условиях филиала «Азот» АО «ОХК «УРАЛХИМ»
Разработка технологии получения раствора коагулянта в условиях филиала «Азот» АО «ОХК «УРАЛХИМ» Радиоуглеродный анализ
Радиоуглеродный анализ БИОЛОГИЧЕСКИ АКТИВНЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ ВЕЩЕСТВА
БИОЛОГИЧЕСКИ АКТИВНЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ ВЕЩЕСТВА  Презентация Вещества и их свойства
Презентация Вещества и их свойства Химические свойства хрома и его соединений
Химические свойства хрома и его соединений Свинец. Строение атома свинца
Свинец. Строение атома свинца Лекция 10. Химия s-элементов
Лекция 10. Химия s-элементов Аттестационная работа. Влияние электромагнитного излучения смартфонов на жизнедеятельность микроорганизмов
Аттестационная работа. Влияние электромагнитного излучения смартфонов на жизнедеятельность микроорганизмов Медициналық тәжірибедегі потенциометриялар
Медициналық тәжірибедегі потенциометриялар Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть
Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть  Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами
Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами Гидрокаталитические процессы
Гидрокаталитические процессы Гидролиз. Фармацевтический филиал ГБОУ СПО Сомк
Гидролиз. Фармацевтический филиал ГБОУ СПО Сомк Алканы. Задания
Алканы. Задания Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Колообіг води Виконав Проданчук Олег Учень 10-А класу
Колообіг води Виконав Проданчук Олег Учень 10-А класу