Содержание
- 5. Гидролиз Фармацевтический филиал ГБОУ СПО « СОМК» Преподаватель Ведерникова Т.Н.
- 6. План 1. Сущность гидролиза. 2. Возможность протекания гидролиза. 3. Типы гидролиза. 4. Алгоритмы составления уравнений гидролиза.
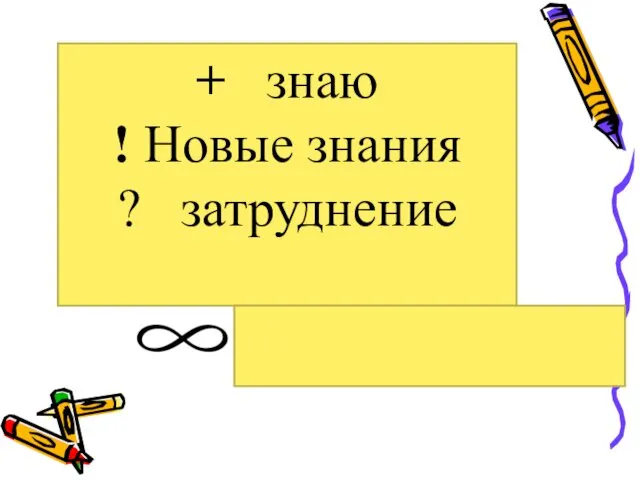
- 7. + знаю ! Новые знания ? затруднение
- 8. Гидролиз солей - это взаимодействие ионов соли с водой с образованием малодиссоцирующих частиц Типы гидролиза Гидролиз
- 9. Гидролиз по катиону Men+ +H-OH ⬄ MeOH(n-1)+ + H+ Гидролиз по катиону приводит к образованию гидроксокатионов
- 10. Гидролиз протекает ступенчато. MeOH(n-1)+ + НОН = Me(OH )n + H+
- 11. Гидролиз по аниону Ann- + H-OH ⬄ HAn(n-1) - +OH- Гидролиз по аниону приводит к образованию
- 12. Совместный гидролиз Характер среды будет определяться константой диссоциации, образующих в результате реакции кислоты и основания.
- 13. Полный гидролиз Соль образована очень слабой кислотой и очень слабым основанием. Подвергаются соли газообразных или неустойчивых
- 14. Полный гидролиз Cоли, образованные слабой кислотой и слабым основанием, ионы этой соли одновременно связывают ионы Н+
- 15. Полностью гидролизуются нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизующиеся соли карбонаты и сульфиды алюминия, хрома(III), железа(III)
- 16. Не подвергаются гидролизу 1 Нерастворимые соли. 2. Соли, образованные катионом сильного основания и анионом сильной кислоты.
- 17. Алгоритм написания уравнений гидролиза 1.Определяем тип написания уравнения гидролиза. CuSO4 ⬄ Cu2+ + SO42– Соль образована
- 18. 2. Пишем ионное уравнение гидролиза, определяем среду Cu2+ + H-OH ⬄ CuOH+ + H+; образуется катион
- 19. 3. Составляем полное ионное уравнение гидролиза Cu2+ + SO4 2- +H2O⬄ CuOH+ + SO4 2- +
- 20. 4. Составляем молекулярное уравнение Из положительных и отрицательных частиц находящихся в растворе, составляем нейтральные частицы. 2CuSO4
- 21. Гидролиз может протекает ступенчато, если многозаряден: анион слабой кислоты CO3 2- PO4 3- B4O7 2- катион
- 22. Гидролиз ортофосфата натрия 1. Определяем тип гидролиза. Na3PO4 ⬄ 3Na+ + PO43– Натрий– щелочной металл, его
- 23. 2. Пишем ионное уравнение гидролиза, определяем среду PO43– + H-OH ⬄ HPO42– + OH– Продукты: гидрофосфат-ион
- 24. 3. Составляем полное ионное уравнение гидролиза. 3Na+ +PO43-+H2O= 3Na++HPO42- + OH-
- 25. 4. Составляем молекулярное уравнение. Na3PO4 + H2O ⬄ Na2HPO4 + NaOH Получили кислую соль – гидрофосфат
- 26. Гидролиз ацетата алюминия 1. Определяем тип гидролиза. Al(CH3COO)3 ⬄ Al3+ + 3CH3COO– Соль слабого основания и
- 27. Ионные уравнения гидролиза, среда. Al3+ + H-OH ⬄ AlOH2+ + H+; CH3COO– + H-OH ⬄ CH3COOH
- 28. 3. Составляем молекулярное уравнение. Al(CH3COO)3 + H2O ⬄ AlOH(CH3COO)2 + CH3COOH Полученную соль назовем ацетат гидроксоалюминия.
- 29. Установите тип гидролиза соли и pH раствора: Zn(CH3COO)2 Li2S (NH4)2SO4 NaHCO3 KNO3 CaCO3 FeCl3 AlCl3 KNO2
- 30. Тип гидролиза Zn(CH3COO)2 Li2S (NH4)2SO4 NaHCO3 KNO3 Совместный По аниону, pH>7 По катиону, pH По аниону,
- 31. Тип гидролиза CaCO3 FeCl3 AlCl3 KNO2 Bi(NO3)3 Неподвергается. По катиону,pH По катиону,pH По аниону, pH>7 По
- 32. Пойдет ли реакция между хлоридом цинка и металлическим цинком: ZnCl2 + Zn … ?
- 33. К раствору ZnCl2 добавляем кусочки Zn и наблюдаем выделение пузырьков водорода. Химизм процесса: Zn2+ + НОН
- 34. Практическое применение. 1.Для обнаружения некоторых ионов 2.Для отделения ионов Al3+ Cr3+ 3.Для усиления или ослабления кислотности
- 35. Практическое применение 5. Известкование почв 6. Гидролиз древесины позволяет получать этанол, глюкозу, фурфурол, метанол, белковые дрожжи.
- 36. Домашнее задание «Гидролиз», Пустовалова Л.М. Неорганическая Химия. Ростов-на- Дону : 2009 год, с. 175 -182. Серебрякова
- 37. Степень гидролиза зависит от химической природы образующихся при гидролизе кислоты (основания) и будет тем больше, чем
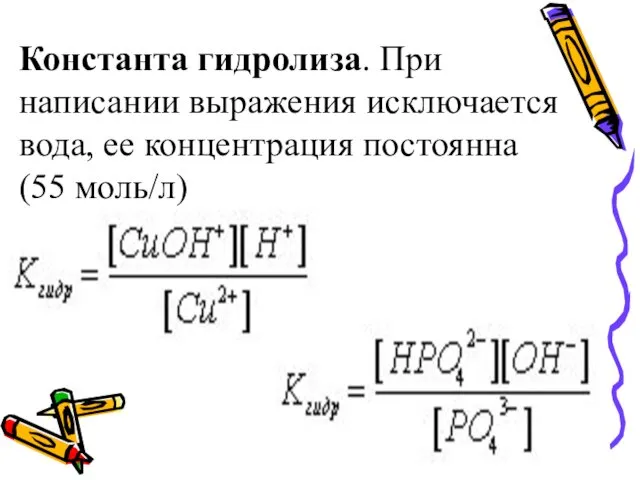
- 38. Константа гидролиза. При написании выражения исключается вода, ее концентрация постоянна (55 моль/л)
- 39. Степень гидролиза (h) -доля вещества подвергающаяся гидролизу. Отношение числа молекул, подвергшихся гидролизу к общему числу растворенных
- 40. Факторы, влияющие на степень гидролиза. Гидролиз обратимая реакция, то на состояние равновесия гидролиза влияют: температура, концентрации
- 41. Температура Реакция гидролиза эндотермическая, повышение температуры смещает равновесие в системе вправо, увеличивает степень гидролиза.
- 42. Концентрация продуктов гидролиза В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода приведет к смещению
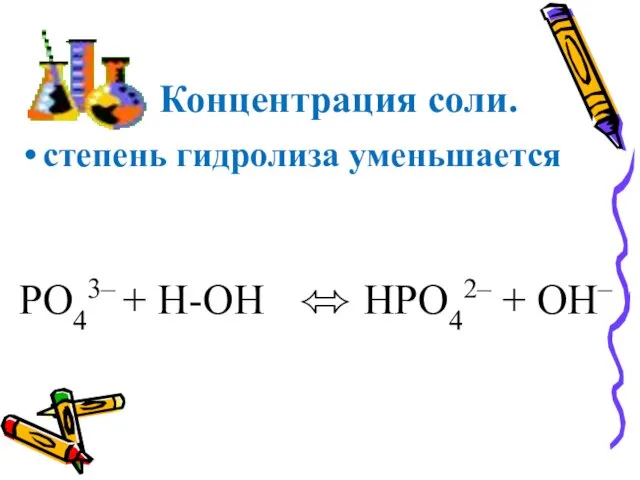
- 43. Концентрация продуктов гидролиза. Степень гидролиза будет уменьшаться при увеличении концентрации гидроксид-ионов для реакции: PO43– + H-OH
- 44. Концентрация соли. степень гидролиза уменьшается PO43– + H-OH ⬄ HPO42– + OH–
- 45. При добавлении соли, фосфат-ионов , равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Из
- 46. Разбавление. Означает уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле
- 47. Cu2+ + HOH ⬄ CuOH+ +H+
- 49. Скачать презентацию








































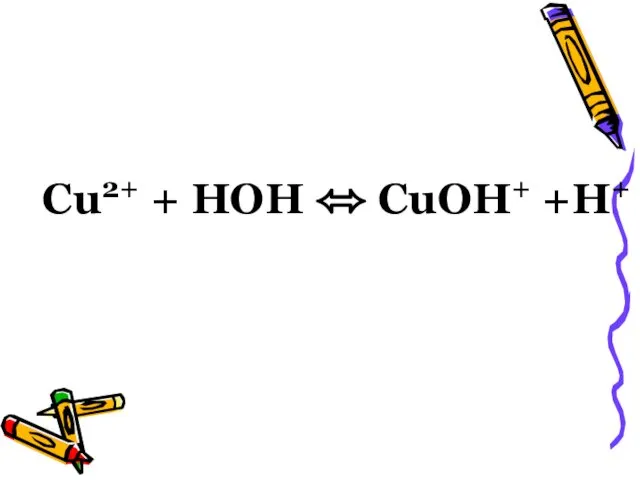
 Строение атома Подготовка к ЕГЭ
Строение атома Подготовка к ЕГЭ Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть
Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть  Фосфор – тіршілік пен ақыл – ой элементі
Фосфор – тіршілік пен ақыл – ой элементі Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна
Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна  Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств
Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности
Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности Фосге́н (дихлорангидрид угольной кислоты)
Фосге́н (дихлорангидрид угольной кислоты) Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Алканы
Алканы Урок-упражнение по веществам
Урок-упражнение по веществам Фенол 10 класс - Презентация по Химии
Фенол 10 класс - Презентация по Химии Все технико-экономические показатели производства определяются на основе материального баланса.
Все технико-экономические показатели производства определяются на основе материального баланса. Кристаллдық және аморфтық күй
Кристаллдық және аморфтық күй Резеңке. Каучук
Резеңке. Каучук Презентация по химии выполнили ученицы 8а класса Соболева Екатерина Кудаева Кристина Учитель Полянская И.В.
Презентация по химии выполнили ученицы 8а класса Соболева Екатерина Кудаева Кристина Учитель Полянская И.В.  Графен. Классические и квантовые низкоразмерные системы. Ковалентная химическая связь: σ- и π-электроны
Графен. Классические и квантовые низкоразмерные системы. Ковалентная химическая связь: σ- и π-электроны Приборы для измерения температуры
Приборы для измерения температуры Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4)
Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4) Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Фосфорное сырье. Применение и обогащение фосфорного сырья
Фосфорное сырье. Применение и обогащение фосфорного сырья Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений