Содержание
- 2. Химия – фундаментальная наука и необходимый инструмент исследования и познания процессов в различных системах, в том
- 3. Роль химической подготовки в системе подготовки врача Современная химия – фундаментальная наука об окружающем мире, научная
- 4. Такие медицинские проблемы как влияние загрязнений окружающей среды, техногенных катастроф, производства удобрений, пестицидов, отравляющих веществ, наркотиков,
- 5. Изучение химии включает постоянное установление причинно-следственных связей, что увеличивает развивающий потенциал этой дисциплины; решение химических задач
- 6. МОДУЛИ КУРСА ХИМИИ Введение. Энергетическая и кинетическая характеристика вещества и хим. реакций. Учение о растворах. Реакции,
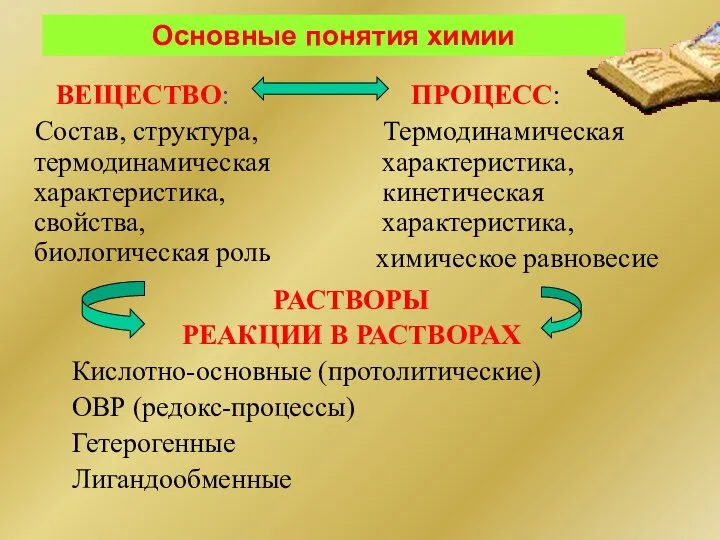
- 7. Основные понятия химии ВЕЩЕСТВО: Состав, структура, термодинамическая характеристика, свойства, биологическая роль ПРОЦЕСС: Термодинамическая характеристика, кинетическая характеристика,
- 8. Термодинамической системой называется любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделенный
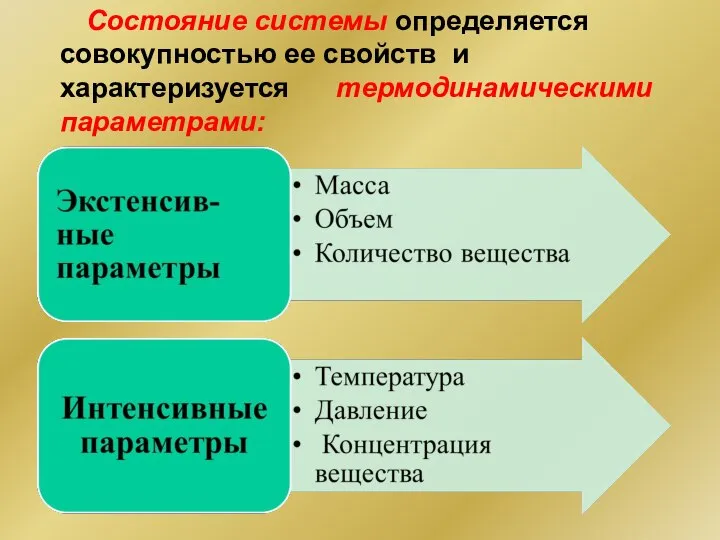
- 9. Состояние системы определяется совокупностью ее свойств и характеризуется термодинамическими параметрами:
- 10. Для характеристики состояния системы используют кроме термодинамических параметров, также функции состояния. Функции состояния системы – всегда
- 11. Внутренняя энергия системы U равна сумме потенциальной и кинетической энергии всех частиц этой системы U =
- 12. Энергетическая характеристика вещества Энтальпия образования простого вещества – Энтальпия образования сложного вещества: 2Сгр + 3Н2(г) +
- 13. Энтальпия сгорания (ΔН °сгор ) – тепловой эффект реакции окисления кислородом 1 моль вещества до образования
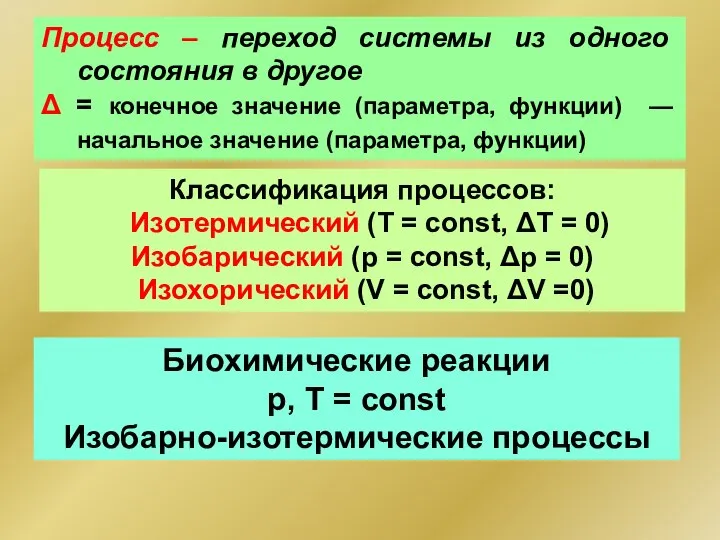
- 14. Процесс – переход системы из одного состояния в другое Δ = конечное значение (параметра, функции) —
- 15. Работа (А) - это энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей
- 16. Если отсутствует теплообмен системы с внешней средой, запас ее внутренней энергии остается постоянным ΔU =0 Сообщенная
- 17. ΔQ = ΔU + р⋅ΔV U + pV = H – энтальпия Q = Δ Н
- 18. Энтальпия реакции, т.е. тепловой эффект реакции при р,T=const , зависит от природы и состояния исходных веществ
- 19. Следствия из закона Гесса ΔН °р-ции =Σni ΔН°обр (кон.прод) — Σni ΔН°обр (исх.в-в) ΔН °р-ции =Σni
- 20. В каком направлении должна самопроизвольно протекать химическая реакция? Самопроизвольный процесс совершается в системе без затраты энергии
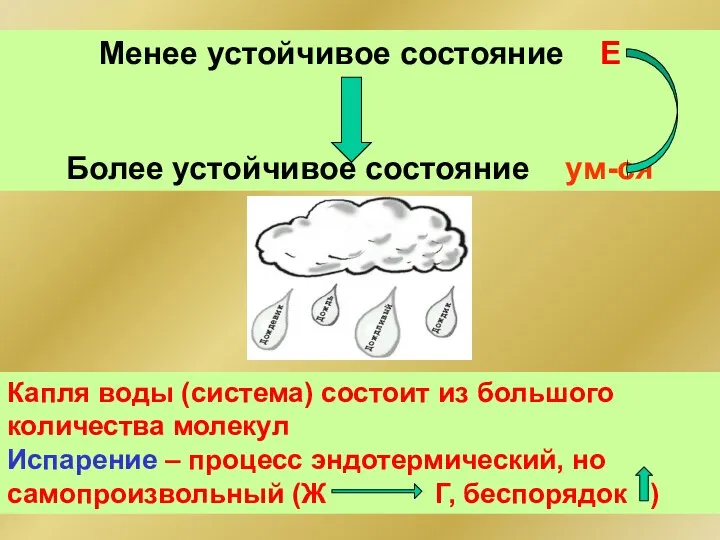
- 21. Менее устойчивое состояние Е Более устойчивое состояние ум-ся Капля воды (система) состоит из большого количества молекул
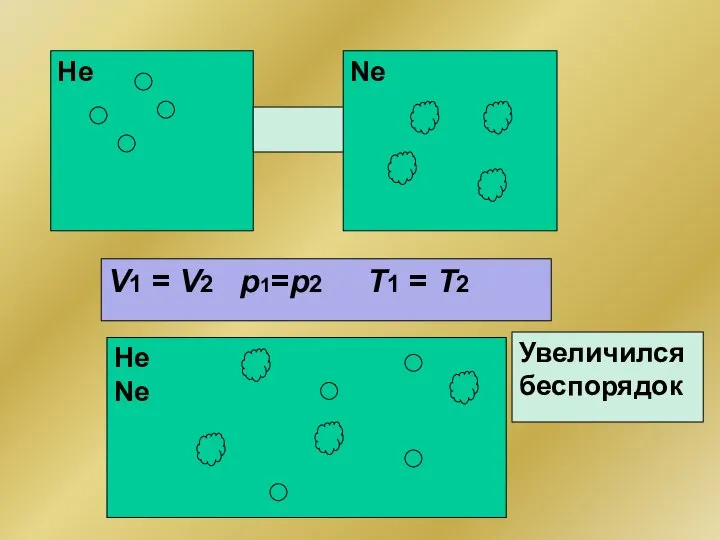
- 22. Не Ne V1 = V2 p1=p2 T1 = T2 Не Nе Увеличился беспорядок
- 23. Второй закон термодинамики ΔS > 0 Любая система, предоставленная сама себе, в среднем будет изменяться в
- 24. Если в процессе степень беспорядка не изменяется (ΔS = 0), то направление процесса определяется изменением энтальпии,
- 25. Дж. Гиббс (1839-1903) В качестве критерия самопроизвольности процессов целесообразно ввести новую функцию состояния, которая учитывает влияние
- 26. Второе начало термодинамики (определение Гиббса) В изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы,
- 27. Факторы, определяющие ход процесса ΔG = ΔH - TΔS
- 28. 1. Принцип энергетического сопряжения: АТФ + Н2О → АДФ + нФ (а) Глюкоза + фруктоза →
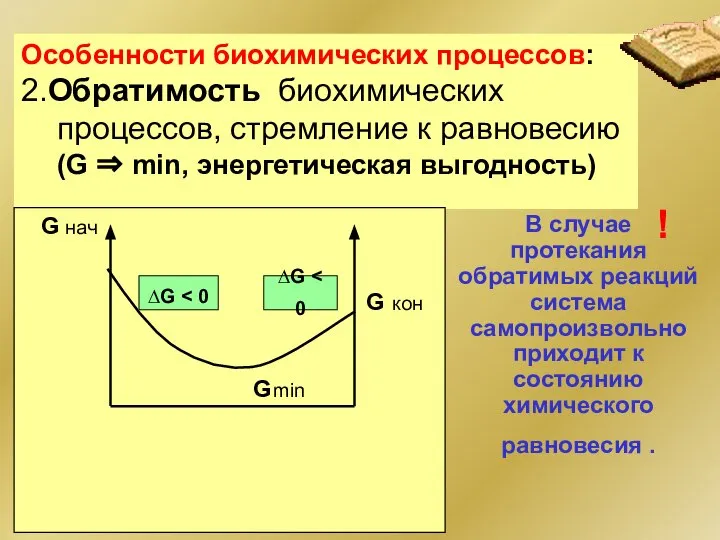
- 29. Особенности биохимических процессов: 2.Обратимость биохимических процессов, стремление к равновесию (G ⇒ min, энергетическая выгодность) G нач
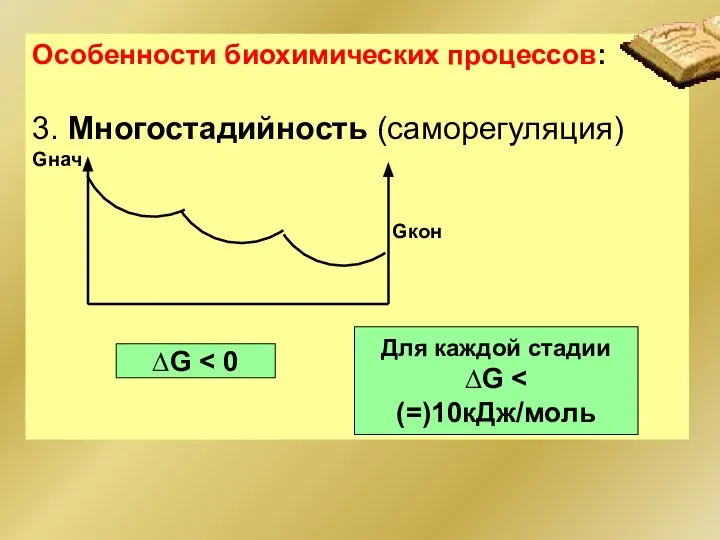
- 30. Особенности биохимических процессов: 3. Многостадийность (саморегуляция) Gнач Gкон ∆G Для каждой стадии ∆G
- 31. Особенности биохимических процессов: 4. Принцип И. Пригожина: в открытой системе в стационарном состоянии прирост энтропии в
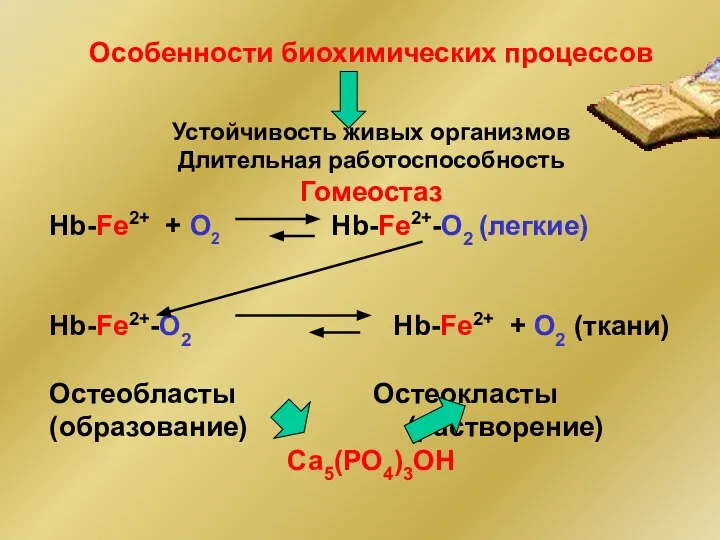
- 32. Особенности биохимических процессов Устойчивость живых организмов Длительная работоспособность Гомеостаз Hb-Fe2+ + O2 Hb-Fe2+-O2 (легкие) Hb-Fe2+-O2 Hb-Fe2+
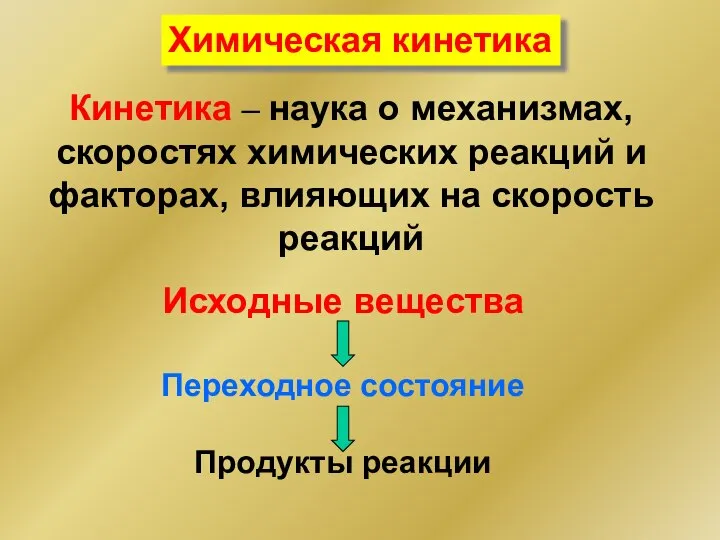
- 33. Кинетика – наука о механизмах, скоростях химических реакций и факторах, влияющих на скорость реакций Химическая кинетика
- 34. Гомогенные реакции а) в растворе NH3(г) + HCl (р-р) NH4Cl(р-р) б) в газовой фазе 2SO2(г) +
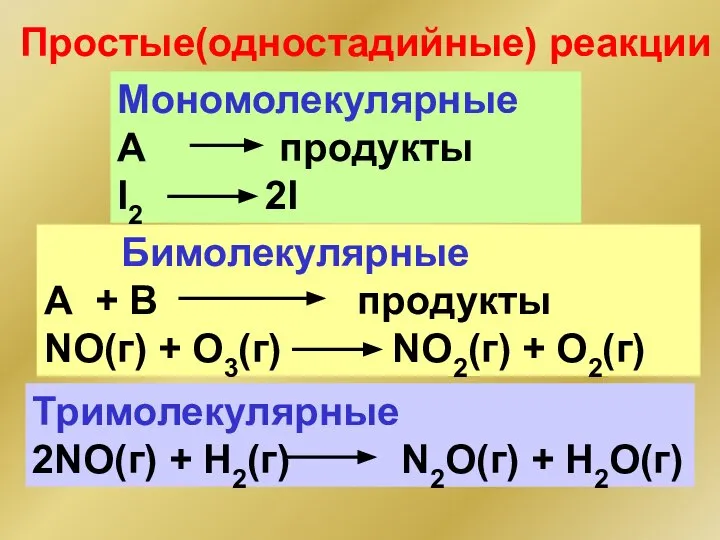
- 35. Простые(одностадийные) реакции Мономолекулярные А продукты I2 2I Тримолекулярные 2NO(г) + H2(г) N2O(г) + H2O(г) Бимолекулярные А
- 36. Сложные реакции – протекают в несколько стадий, каждая из которых является простой реакцией Циклические A В
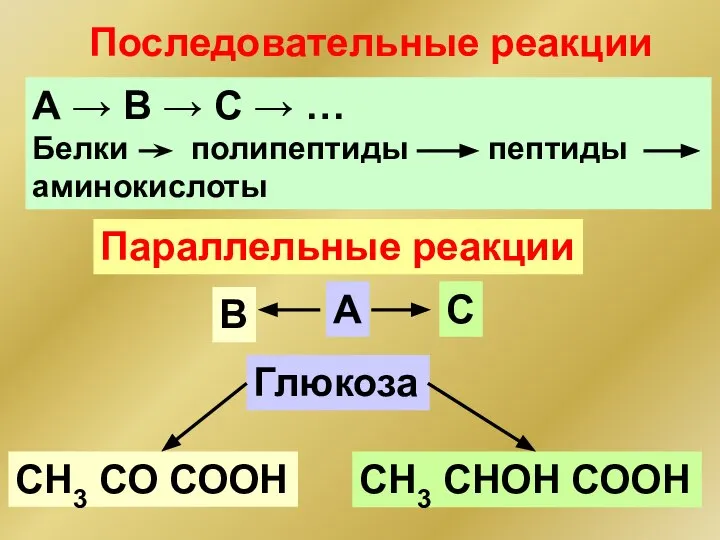
- 37. Последовательные реакции А → B → C → … Белки полипептиды пептиды аминокислоты Параллельные реакции A
- 38. Сопряженные реакции C6H12O6 + 6O2 → 6CO2 + 6H2O АДФ + Ф → АТФ Цепные реакции
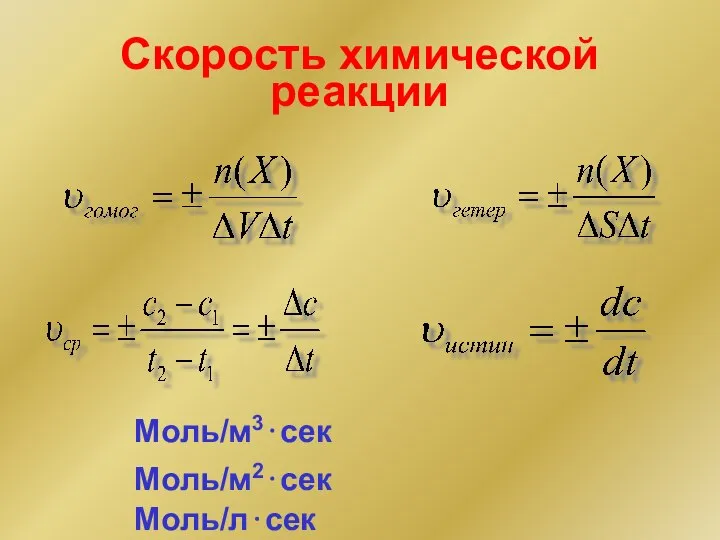
- 39. Скорость химической реакции Моль/м3⋅сек Моль/м2⋅сек Моль/л⋅сек
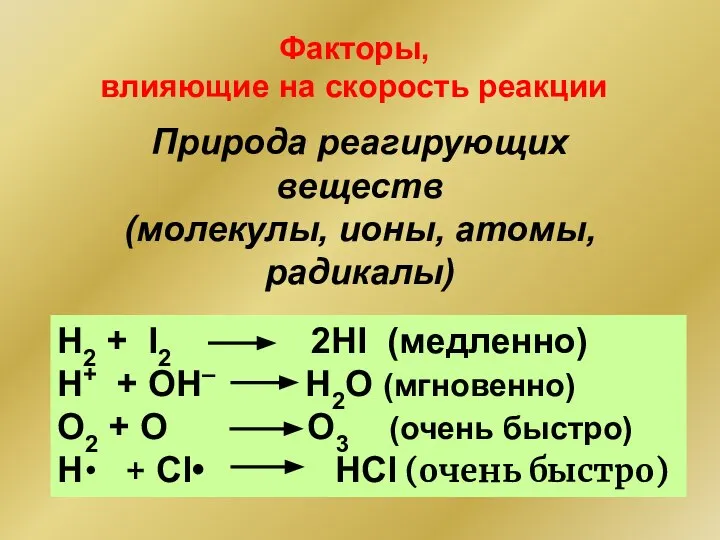
- 40. Факторы, влияющие на скорость реакции Природа реагирующих веществ (молекулы, ионы, атомы, радикалы) Н2 + I2 2НI
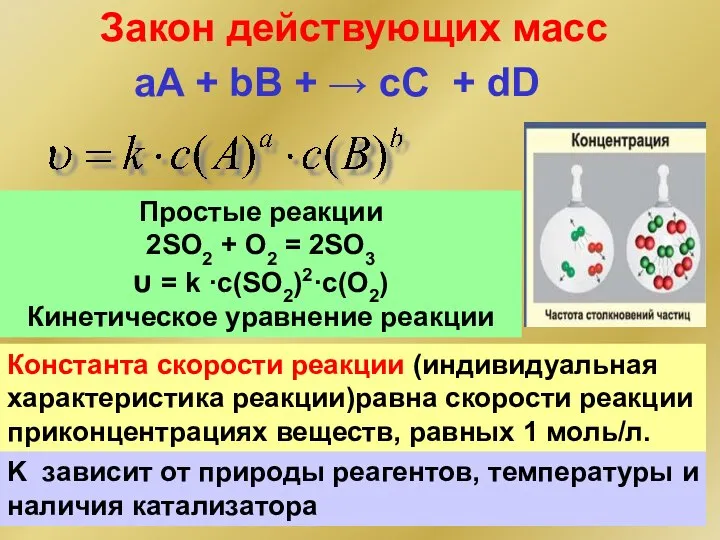
- 41. Закон действующих масс Константа скорости реакции (индивидуальная характеристика реакции)равна скорости реакции приконцентрациях веществ, равных 1 моль/л.
- 42. Эффективные соударения
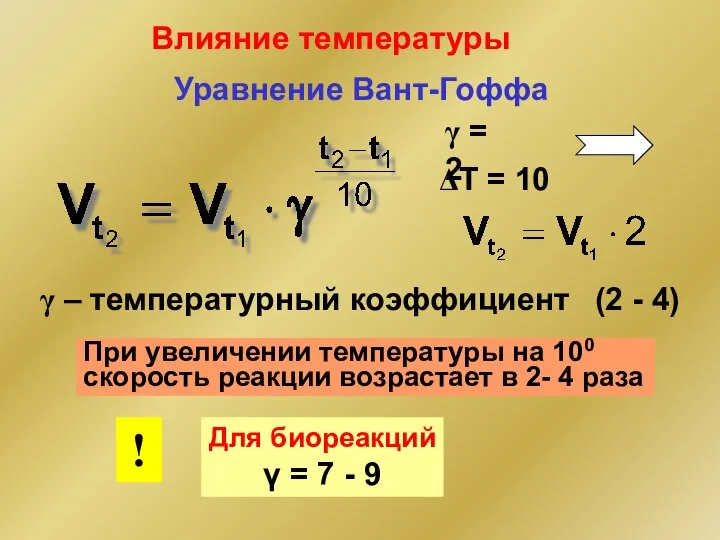
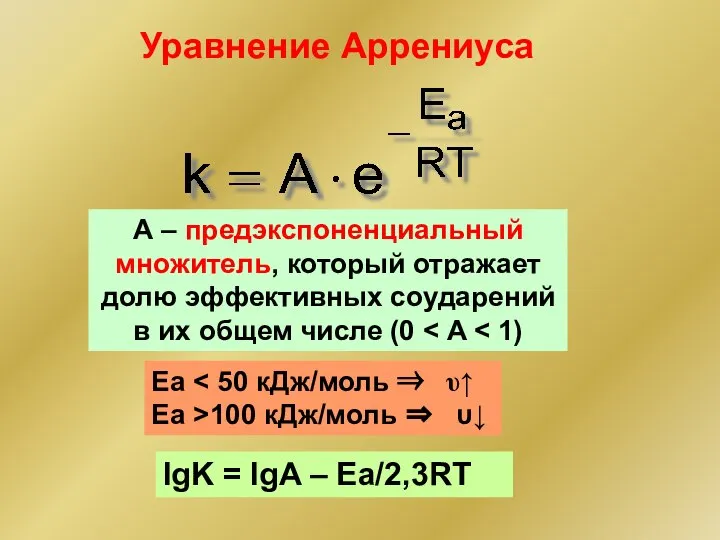
- 43. Уравнение Вант-Гоффа – температурный коэффициент (2 - 4) γ = 2 ΔT = 10 При увеличении
- 44. Еа Еа >100 кДж/моль ⇒ υ↓ Уравнение Аррениуса А – предэкспоненциальный множитель, который отражает долю эффективных
- 45. КАТАЛИЗ Положительный Отрицательный Основные принципы катализа Каt ускоряет только ТД возможные реакции Снижение Еа υ↑ 3.
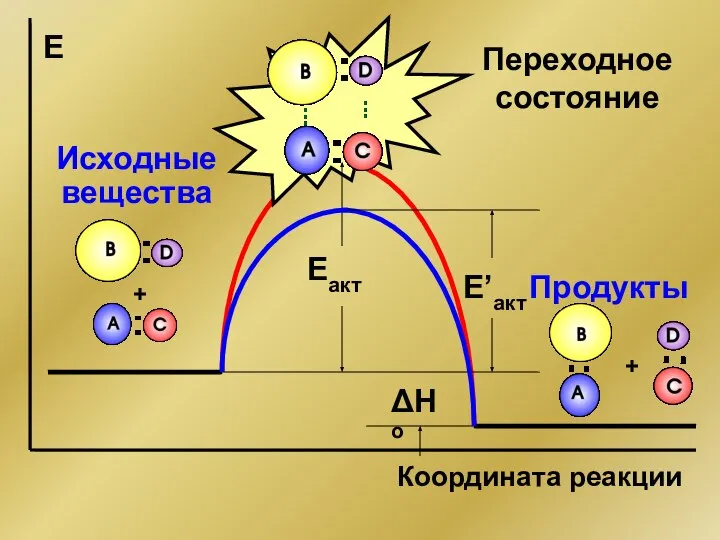
- 46. + + ΔHo Eакт Е Координата реакции Продукты Исходные вещества Переходное состояние E’акт
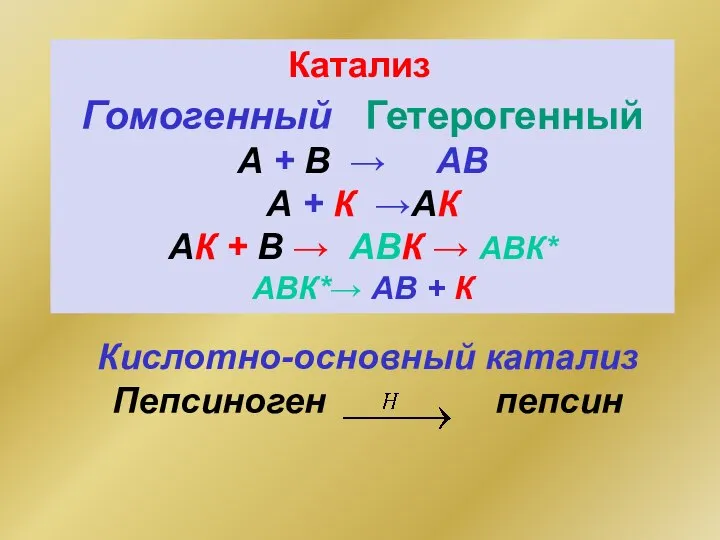
- 47. Гомогенный Гетерогенный А + В → АВ А + К →АК АК + В → АВК
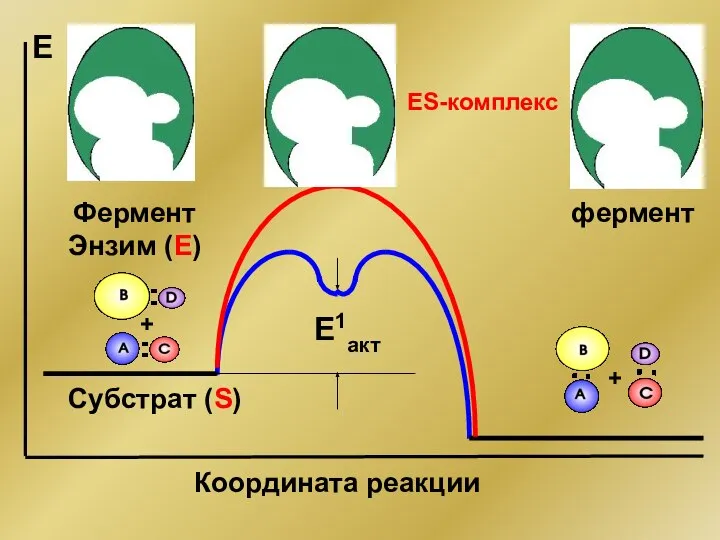
- 48. Ферментативный катализ Условия: рН, температурный оптимум Белковая природа Размер 10-5-10-7 м Высокая активность υ Кинетика [S]
- 49. + + E1акт Е Координата реакции Фермент Энзим (Е) фермент ES-комплекс Субстрат (S)
- 50. aA + bB cC + dD Обратимость – способность реакции протекать в двух направлениях Химическое равновесие
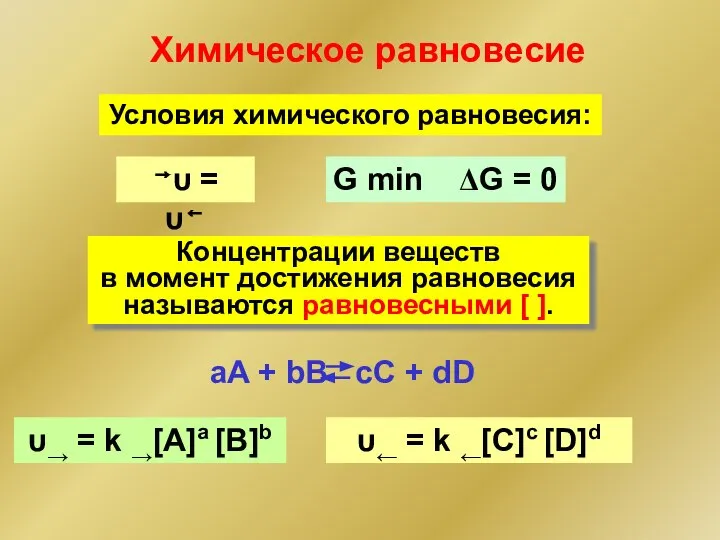
- 51. Условия химического равновесия: G min ΔG = 0 →υ = υ← Концентрации веществ в момент достижения
- 52. Химическое равновесие υ → = υ ← k →[A]a [B]b = k←[С]с [D]d Так как Ю
- 53. Способы выражения константы равновесия Kc, Kp, Ka
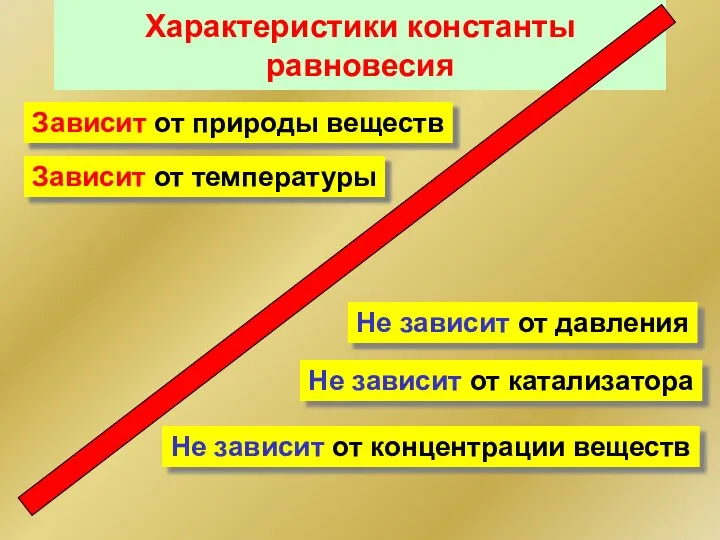
- 54. Характеристики константы равновесия Не зависит от концентрации веществ Не зависит от давления Не зависит от катализатора
- 55. Смещение химического равновесия Принцип Ле-Шателье Если на равновесную систему производится внешнее воздействие, то равновесие смещается в
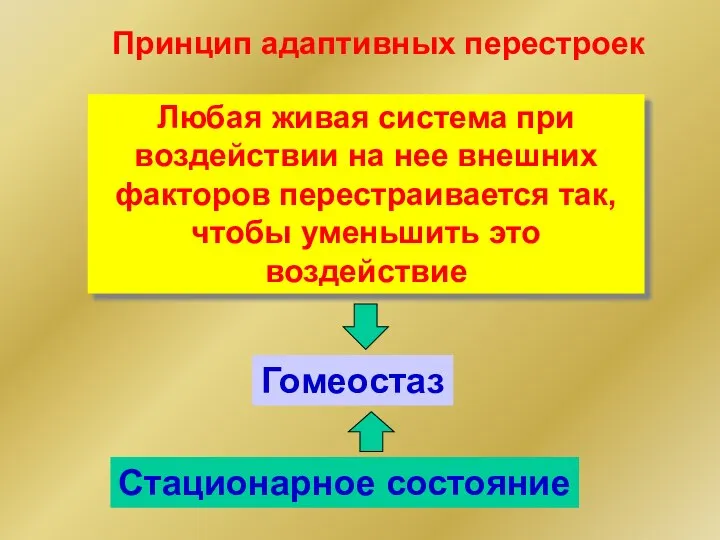
- 56. Принцип адаптивных перестроек Любая живая система при воздействии на нее внешних факторов перестраивается так, чтобы уменьшить
- 57. Растворы. Реакции, протекающие в растворах 1. Кислотно-основные (протолитические) 2. ОВР (редокс-процессы) 3. Гетерогенные 4. Лигандообменные
- 58. Растворы Истинные растворы – гомогенные системы, в которых структурной единицей растворенного вещества являются ионы или молекулы.
- 59. Коллигативные свойства растворов Диффузия, осмос, осмотическое давление Давление насыщенного пара растворителя над раствором Температура кристаллизации раствора
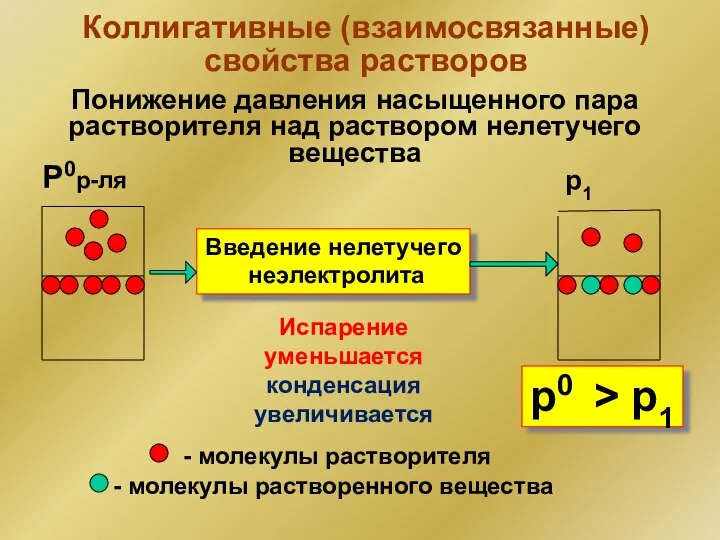
- 60. Коллигативные (взаимосвязанные) свойства растворов Понижение давления насыщенного пара растворителя над раствором нелетучего вещества - молекулы растворителя
- 61. I Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества
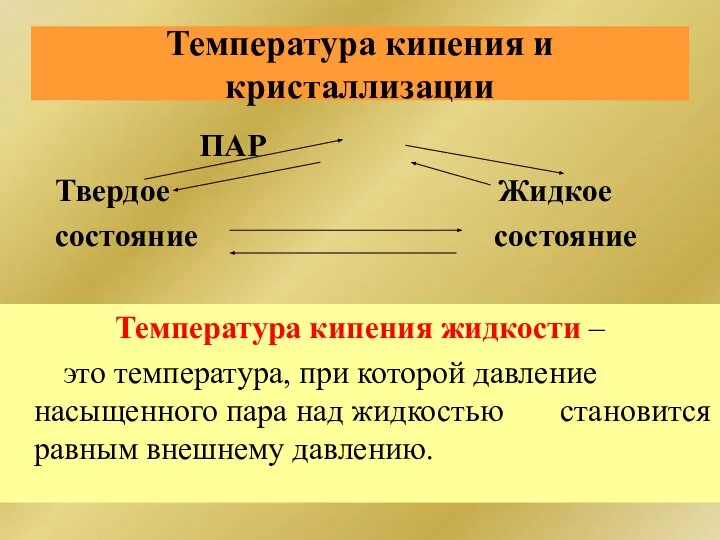
- 62. Температура кипения и кристаллизации ПАР Твердое Жидкое состояние состояние Температура кипения жидкости – это температура, при
- 63. Температура кипения и замерзания 2 закон Рауля Температура кристаллизации (замерзания) жидкости – это температура, при которой
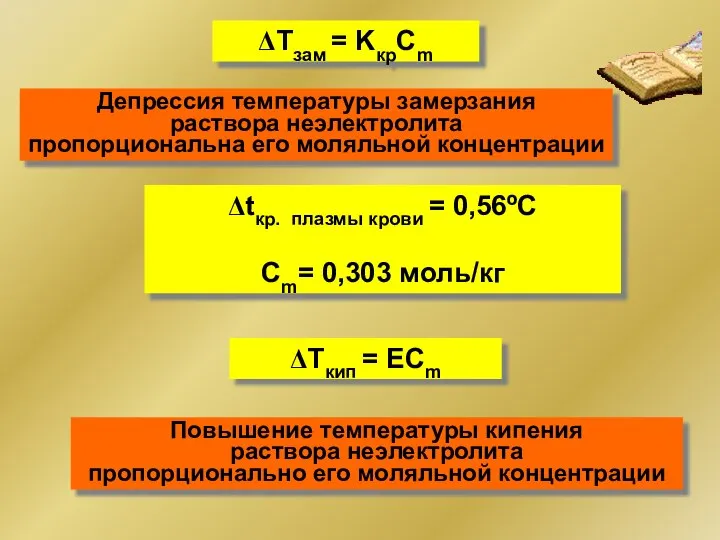
- 64. ΔTзам = KкрCm Депрессия температуры замерзания раствора неэлектролита пропорциональна его моляльной концентрации ΔTкип = ЕCm Повышение
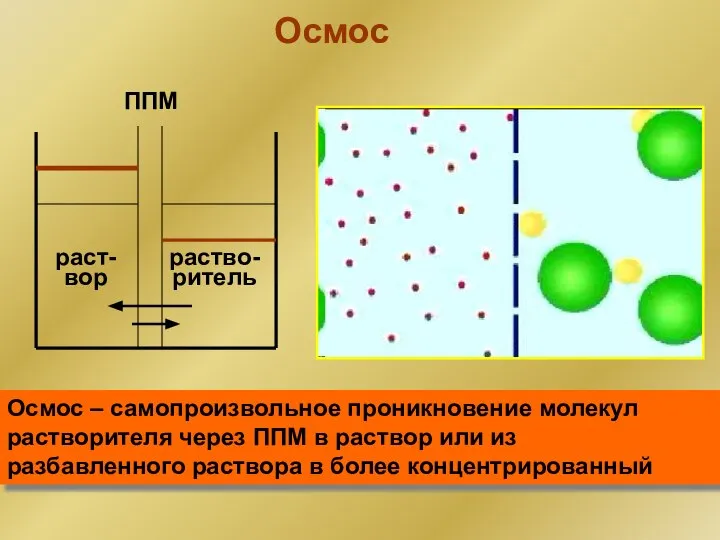
- 65. Осмос ППМ раст- вор раство- ритель Осмос – самопроизвольное проникновение молекул растворителя через ППМ в раствор
- 68. Расчет осмотического давления Условие существования человека и высших животных : ИЗООСМИЯ Росм жидкостей человека = 7,62
- 69. Типы растворов, используемых в медицине - гипертонические (росм > pосм крови) - гипотонические (росм - изотонические
- 70. Растворы электролитов (сильные и слабые) Pосм= iсRT i – изотонический коэффициент co – начальная концентрация электролита
- 71. Слабые электролиты СН3СООН СН3СОО– + Н+ Kдис (константа равновесия) зависит от Природы вещества Природы растворителя Температуры
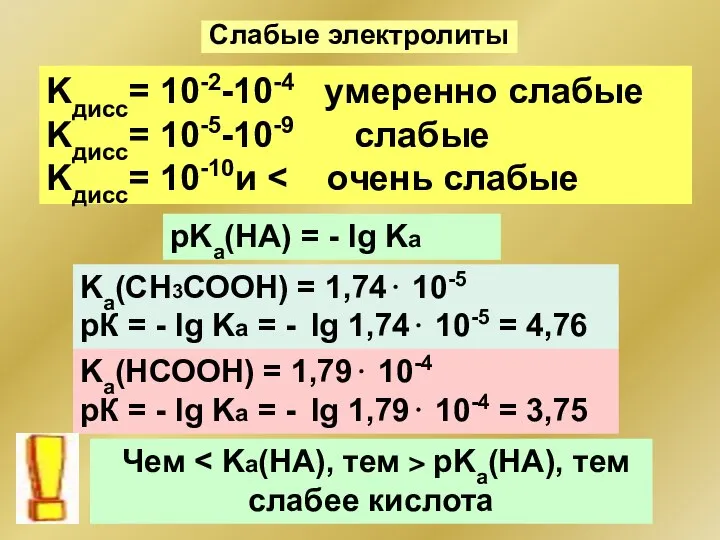
- 72. Слабые электролиты Kдисс= 10-2-10-4 умеренно слабые Kдисс= 10-5-10-9 слабые Kдисс= 10-10и рKa(HA) = - lg Ka
- 73. Закон разведения Оствальда С увеличением концентрации слабого электролита степень его диссоциации уменьшается СН3СООН СН3СОО– + Н+
- 74. Сильные электролиты Активность иона а(Хi) – эффективная концентрация иона Хi , соответственно которой он участвует во
- 75. Кэффициент активности a = C0γ γ − коэффициент активности γ− − коэффициент активности аниона γ+ −
- 76. Ионная сила раствора I – ионная сила раствора – величина, характеризующая интенсивность электростатического поля всех ионов
- 77. Электролиты биосред Клетка концентрированнее плазмы Обязательно присутствие катионов Na, K, Mg, Ca В плазме Na >
- 78. Na K Ca Ca Na Mg Mg HCO3- HCO3- Cl K HPO42- белок SO42- белок 142
- 79. Теория кислот и оснований Бренстеда-Лоури Основание – молекула или ион, способные присоединить протон : CN– +
- 80. АМФОЛИТЫ Амфолиты – молекулы или ионы, способные как отдавать, так и присоединять протоны: Н2О + HCl
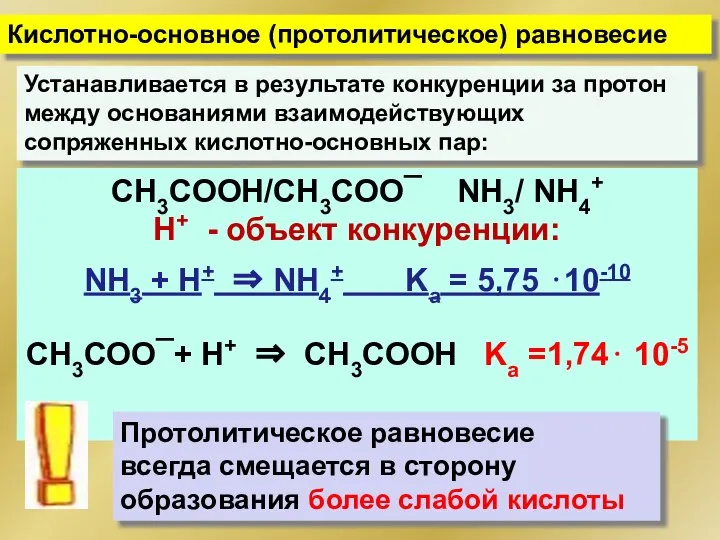
- 81. Устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар: Кислотно-основное (протолитическое) равновесие СН3СООН/СН3СОО¯
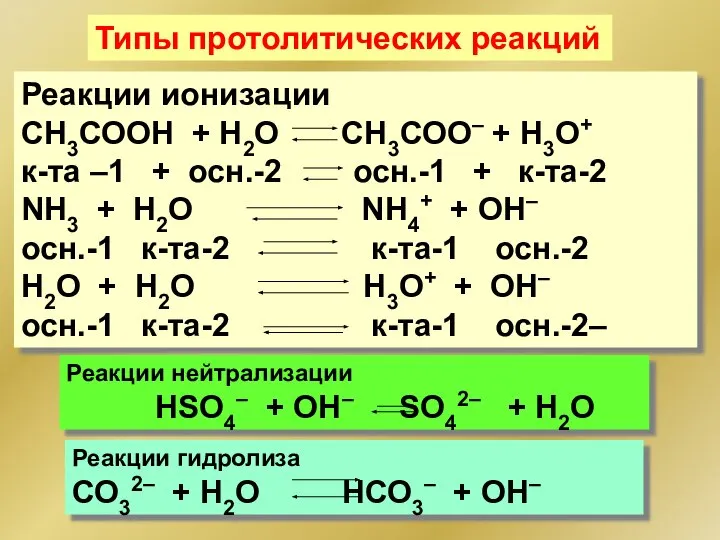
- 82. Типы протолитических реакций Реакции ионизации СН3СООН + Н2О СН3СОО– + Н3О+ к-та –1 + осн.-2 осн.-1
- 83. Ионное произведение воды В разбавленных водных растворах произведение концентраций ионов водорода и гидроксила есть величина постоянная
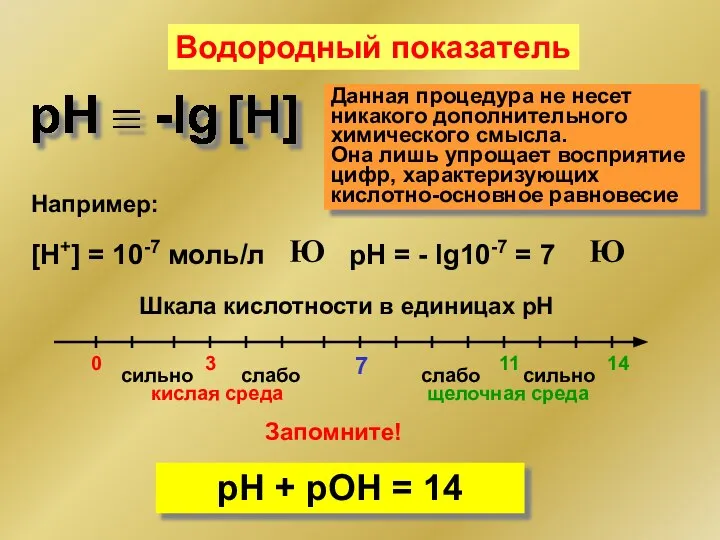
- 84. Водородный показатель Данная процедура не несет никакого дополнительного химического смысла. Она лишь упрощает восприятие цифр, характеризующих
- 85. рН можно определить: Колориметрическим методом с помощью индикаторов Потенциометрическим методом рН биологических жидкостей: рН плазмы крови
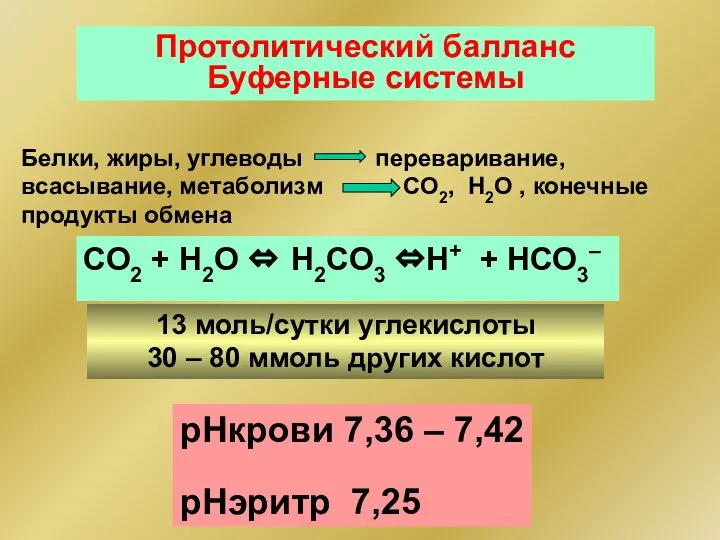
- 86. Протолитический балланс Буферные системы Белки, жиры, углеводы переваривание, всасывание, метаболизм СО2, Н2О , конечные продукты обмена
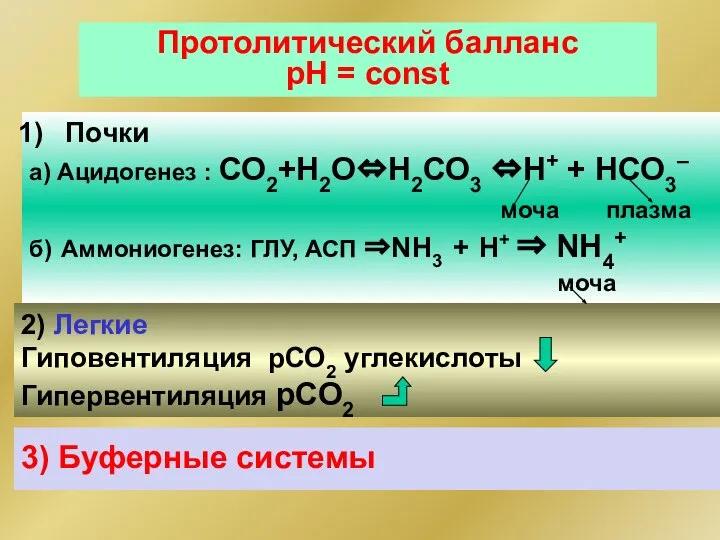
- 87. Протолитический балланс рН = const Почки а) Ацидогенез : СО2+Н2О⇔Н2СО3 ⇔Н+ + НСО3– моча плазма б)
- 88. Протолитический балланс Буферные системы Буферная система – протолитическая (кислотно-основная) система, способная поддерживать постоянство рН при разбавлении
- 89. Буферные системы Основные буферные системы: Слабое основание – акцептор протонов Соль этого основания (сопряженная кислота) –донор
- 90. Уравнение буферных систем (Гендерсона-Хассельбаха) [H+] = Ka ·
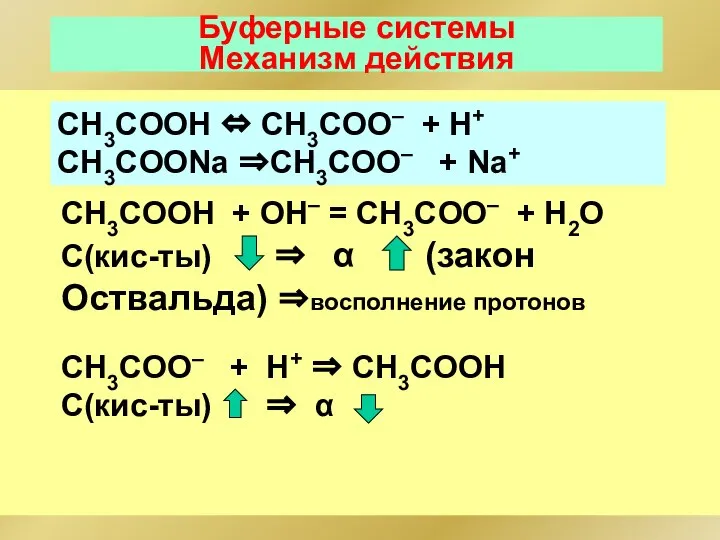
- 91. Буферные системы Механизм действия CH3COOH ⇔ CH3COO– + H+ CH3COONa ⇒CH3COO– + Na+ CH3COOH + ОН–
- 92. Буферная емкость Буферная емкость зависит : От соотношения компонентов (рН=рК, В ) От концентрации компонентов 0,1/0,1М
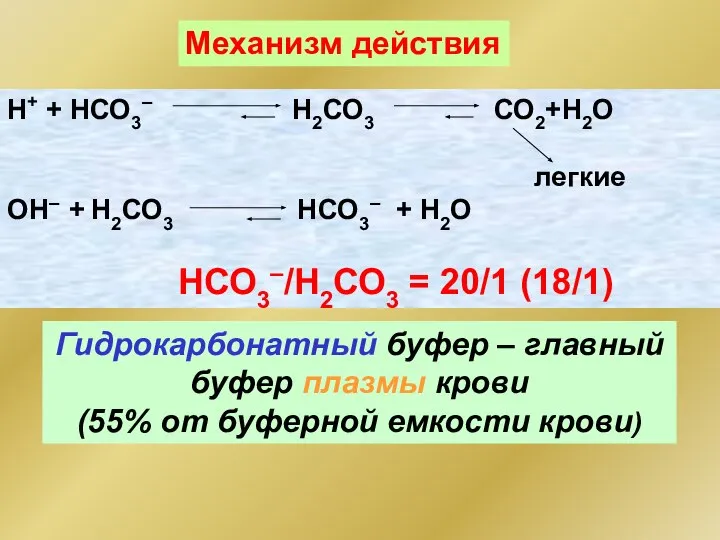
- 93. Буферные системы организма Гидрокарбонатная буферная система СО2+Н2О ⇔ Н2СО3 ⇔ Н+ + НСО3– Открытая система быстрого
- 94. Гидрокарбонатный буфер – главный буфер плазмы крови (55% от буферной емкости крови) Н+ + НСО3– Н2СО3
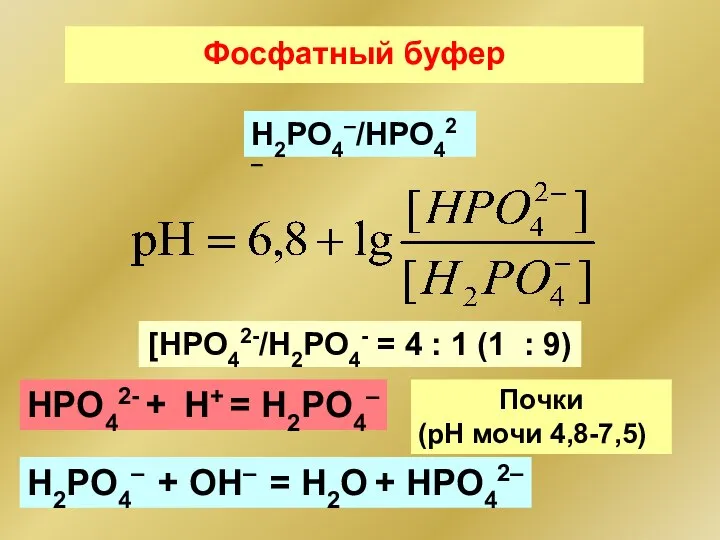
- 95. Фосфатный буфер HPO42- + H+ = H2PO4– H2PO4–/НРО42– H2PO4– + ОН– = H2О + HPO42– [HPO42-/H2PO4-
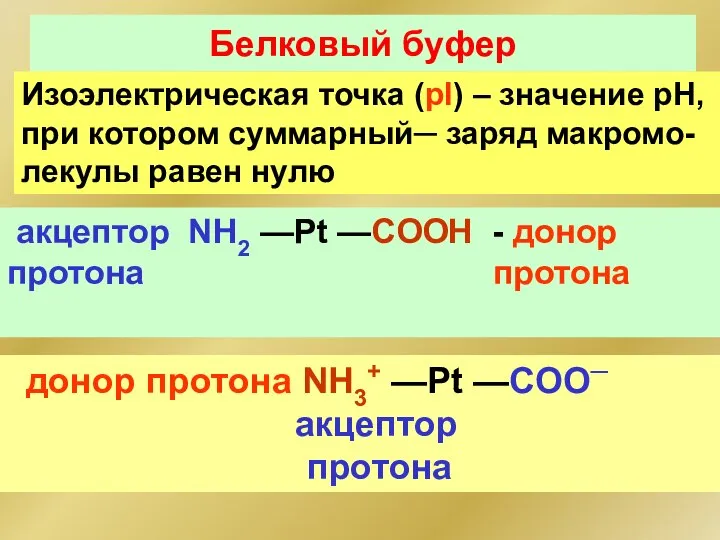
- 96. Белковый буфер Изоэлектрическая точка (pI) – значение рН, при котором суммарный─ заряд макромо- лекулы равен нулю
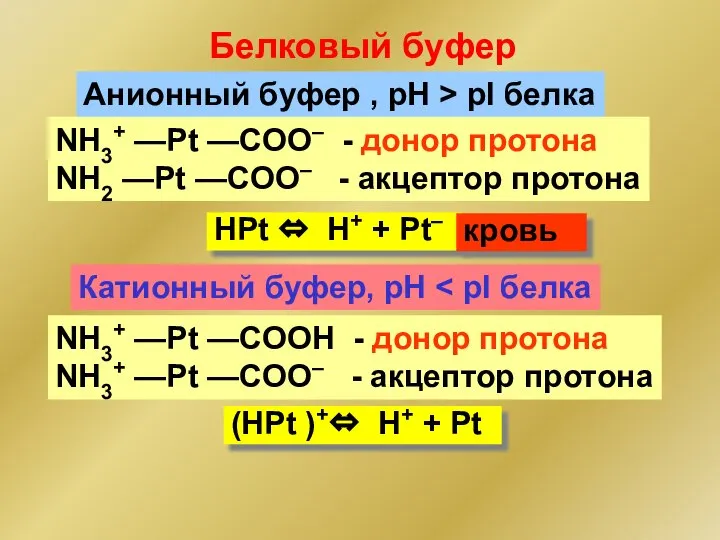
- 97. Белковый буфер Анионный буфер , рН > pI белка Катионный буфер, рН НPt ⇔ H+ +
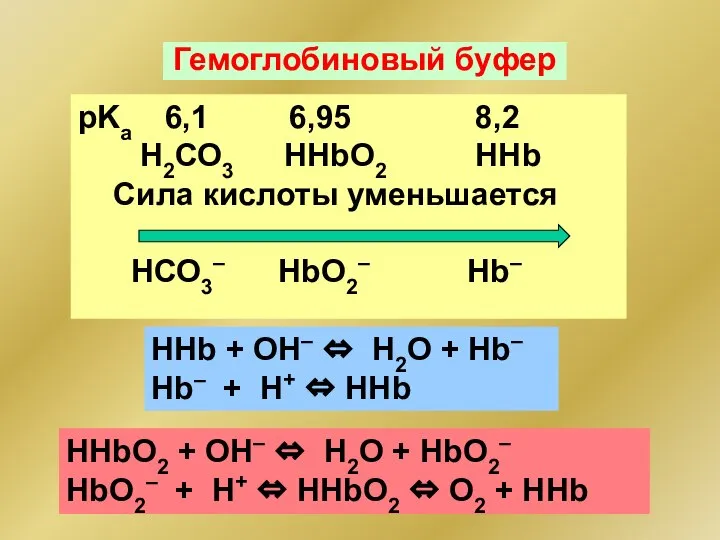
- 98. Гемоглобиновый буфер рKа 6,1 6,95 8,2 Н2СО3 HHbO2 HHb Сила кислоты уменьшается НСО3– HbO2– Hb– HHb
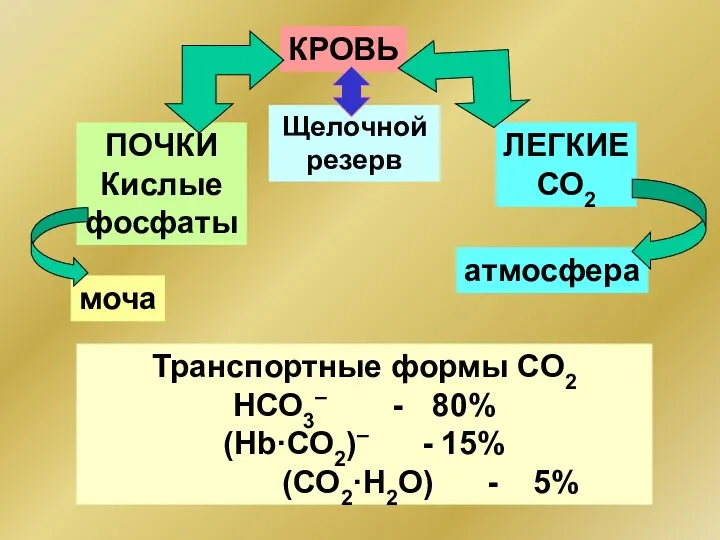
- 99. КРОВЬ ПОЧКИ Кислые фосфаты Транспортные формы CО2 НСО3– - 80% (Hb·СО2)– - 15% (СО2·Н2О) - 5%
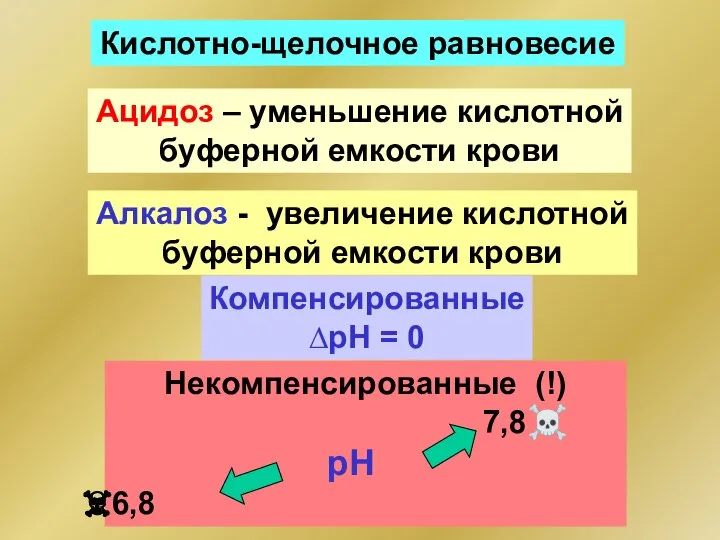
- 100. Кислотно-щелочное равновесие Ацидоз – уменьшение кислотной буферной емкости крови Алкалоз - увеличение кислотной буферной емкости крови
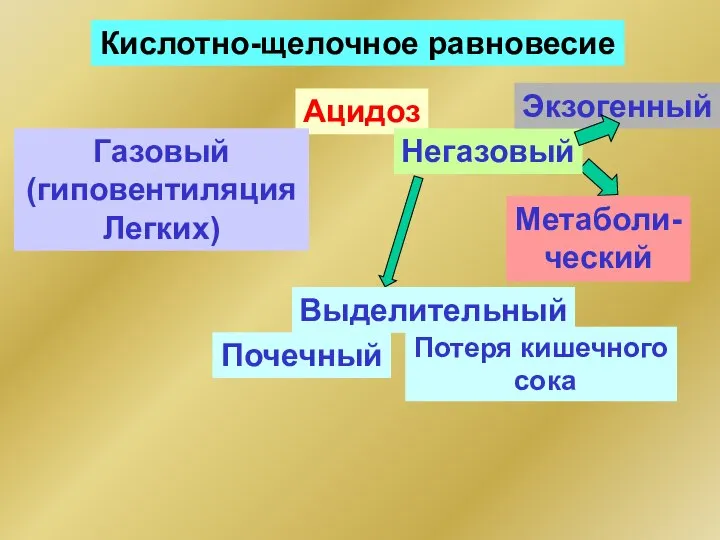
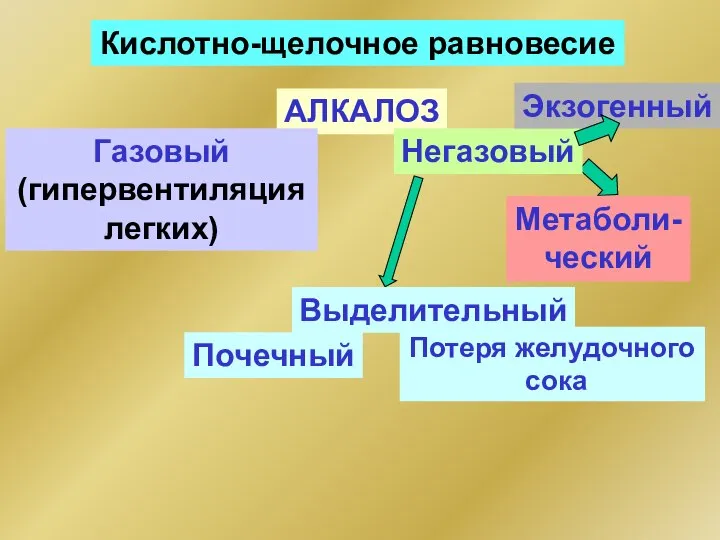
- 101. Кислотно-щелочное равновесие Ацидоз Газовый (гиповентиляция Легких) Негазовый Метаболи- ческий Экзогенный Выделительный Почечный Потеря кишечного сока
- 102. Кислотно-щелочное равновесие АЛКАЛОЗ Газовый (гипервентиляция легких) Негазовый Метаболи- ческий Экзогенный Выделительный Почечный Потеря желудочного сока
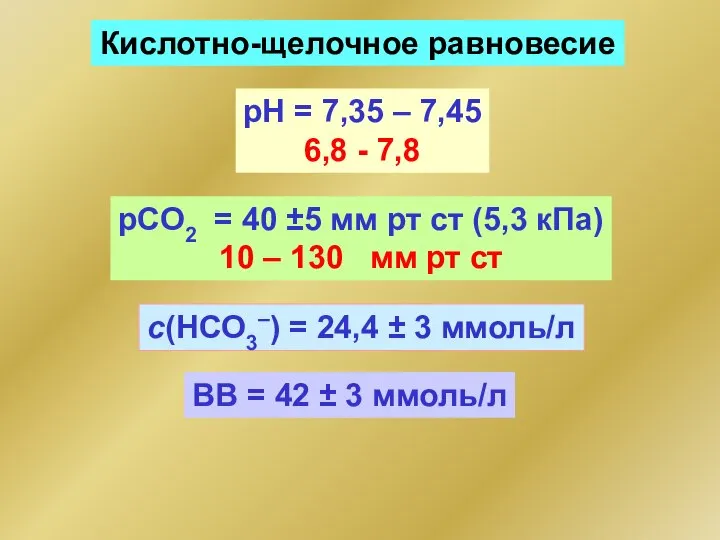
- 103. Кислотно-щелочное равновесие рН = 7,35 – 7,45 6,8 - 7,8 с(НСО3–) = 24,4 ± 3 ммоль/л
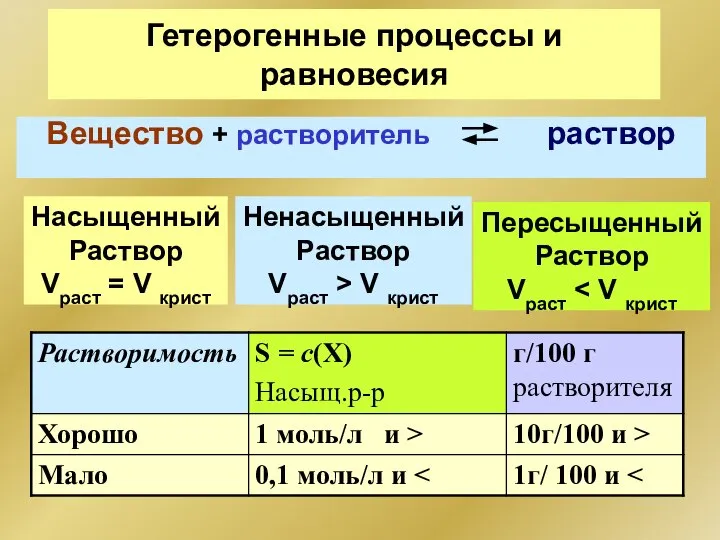
- 104. Гетерогенные процессы и равновесия Насыщенный Раствор Vраст = V крист Вещество + растворитель раствор Ненасыщенный Раствор
- 105. Гетерогенные процессы и равновесия BaSO4 Осадок (тв) раствор (ионы) Kравн Kравн·[BaSO4]=Ks(ПР)= [Ba2+]·[SO42-] Раствор Ba2+ + SO42–
- 106. Константа расторимости, Ks (ПР) Са3(РО4)2 Кs – произведение равновесных концентраций ионов малорастворимого электролита в его насыщенном
- 107. Значение Кs Кs зависит от: Природы малорастворимого эл-та Природы растворителя Температуры
- 108. S = √Ks Кs и s Бинарный электролит: AgCl (тв) Ag+(р-р) + Cl–(р-р) Ks = [Ag+]·[Cl–]
- 109. Са5(РO4)3ОН(тв) 5Са2+(р-р) + + 3РО43–(р-р) + ОН–(р-р) [Ca2+] = 5s [PO43–] = 3s [OH–] = s
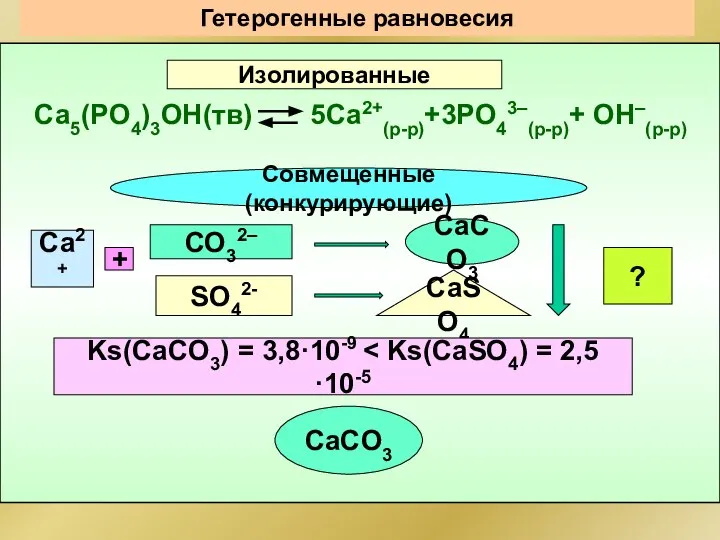
- 110. Гетерогенные равновесия Изолированные Са5(РO4)3ОН(тв) 5Са2+(р-р)+3РО43–(р-р)+ ОН–(р-р) Совмещенные(конкурирующие) Са2+ СО32– SO42- + CaCO3 CaSO4 ? Ks(CaCO3) =
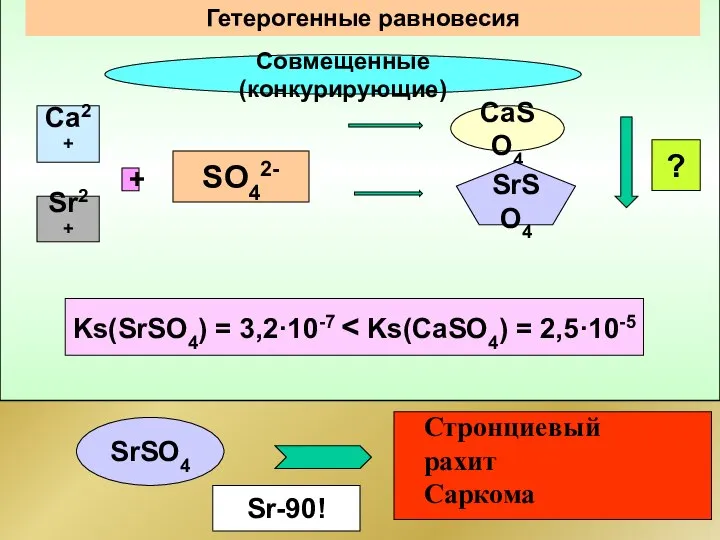
- 111. Гетерогенные равновесия Совмещенные(конкурирующие) Са2+ Sr2+ SO42- + CaSO4 ? Ks(SrSO4) = 3,2·10-7 SrSO4 SrSO4 Стронциевый рахит
- 112. Гетерогенные равновесия Совмещенные(конкурирующие) AgCl(тв) Ag+(р-р)+ Cl-(р-р) Ag+(р-р)+ 2NH3 [Ag(NH3)2]+ Mg(OH)2 (тв) Mg2+(р-р + 2OH- (р-р) 2Н+
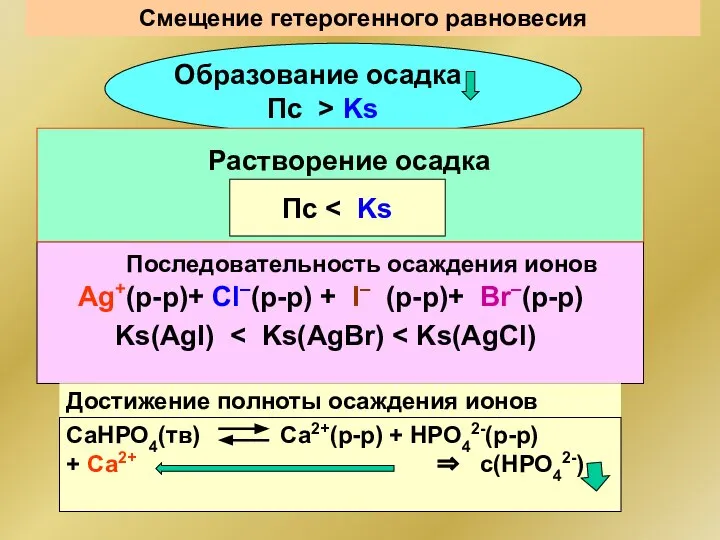
- 113. Cмещение гетерогенного равновесия Достижение полноты осаждения ионов Образование осадка Пс > Ks Растворение осадка Пс Ks(AgI)
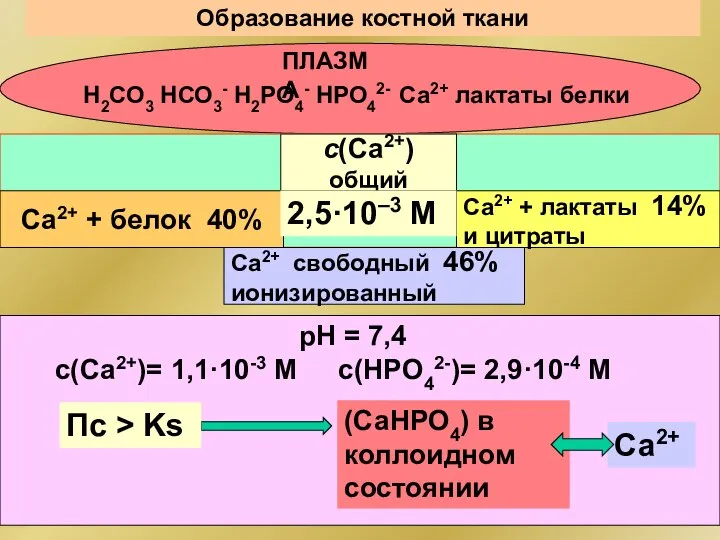
- 115. Образование костной ткани рН = 7,4 с(Са2+) общий ПЛАЗМА Н2СО3 НСО3- Н2РО4- НРО42- Са2+ лактаты белки
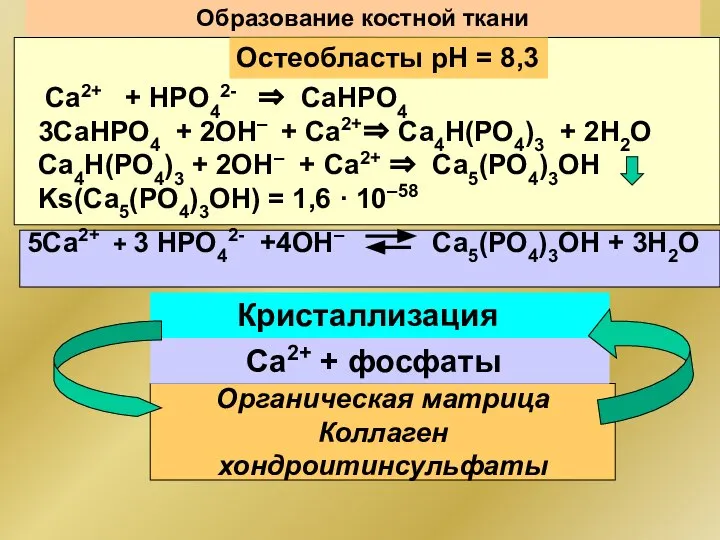
- 116. Образование костной ткани Органическая матрица Коллаген хондроитинсульфаты Остеобласты рН = 8,3 Са2+ + НРО42- ⇒ СаНРО4
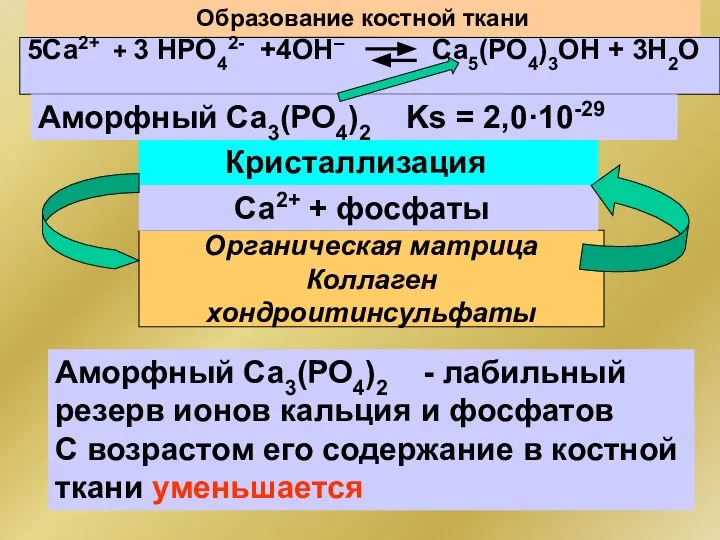
- 117. Образование костной ткани Органическая матрица Коллаген хондроитинсульфаты 5Са2+ + 3 НРО42- +4ОН– Са5(РО4)3ОН + 3Н2О Кристаллизация
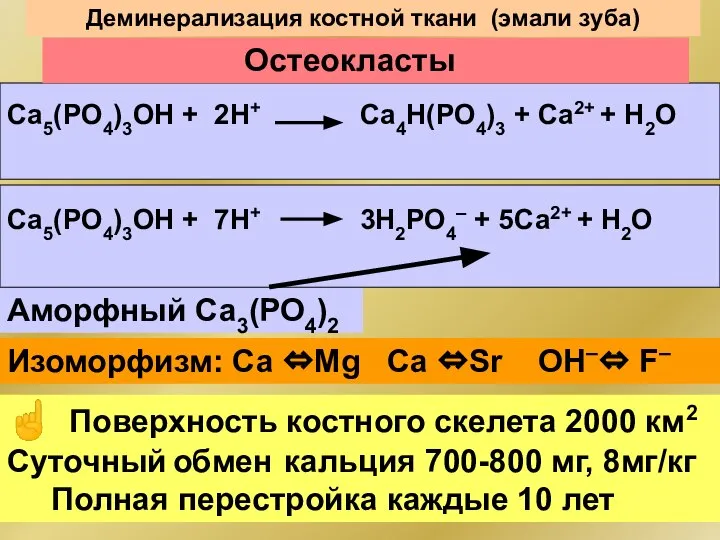
- 118. Деминерализация костной ткани (эмали зуба) Са5(РО4)3ОН + 2Н+ Са4Н(РО4)3 + Са2+ + Н2О Аморфный Са3(РО4)2 ☝
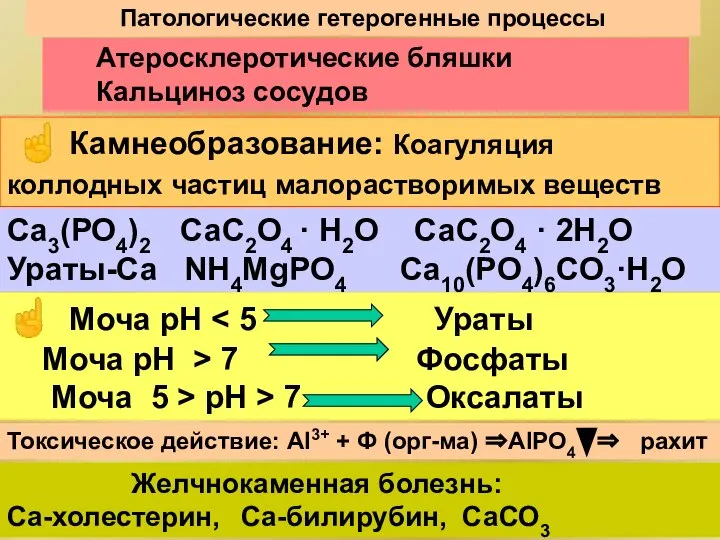
- 119. Патологические гетерогенные процессы Са3(РО4)2 СаС2О4 · Н2О СаС2О4 · 2Н2О Ураты-Са NH4MgPO4 Ca10(PO4)6CO3·H2O ☝ Моча рН
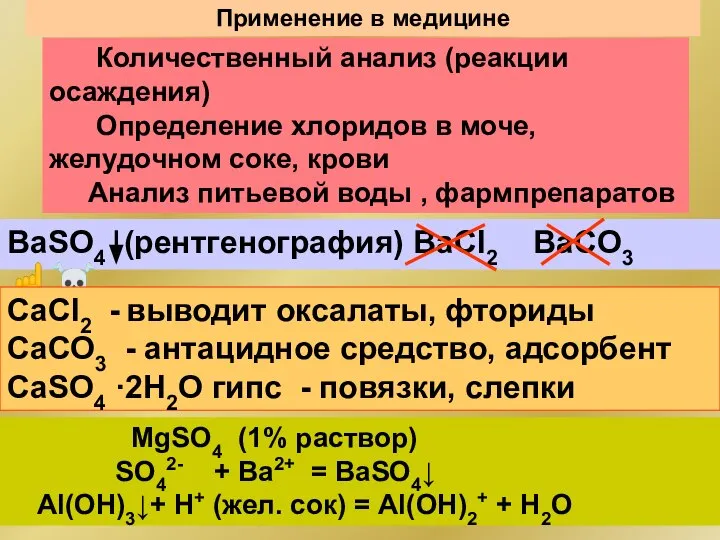
- 120. Применение в медицине BaSO4 (рентгенография) BaCl2 BaCO3 ☝☠ Количественный анализ (реакции осаждения) Определение хлоридов в моче,
- 121. Биогенные элементы Комплексные соединения
- 122. Бионеорганическая химия – это химия ионов биометаллов и их биокомплексов Биогенные элементы (необходимые для жизни) Макроэлементы
- 124. Микроэлементы - организаторы жизни (>10-5%): Fe2+aq, Zn2+aq, Co2+aq, Cu2+aq, Mn2+aq, Fe3+aq, Co3+aq, Cu+aq, Mn3+aq В организме:
- 125. Биогенные элементы Классификация по функции Органогенные С, H, O, N, S, P 2. Регуляторы Микроэлементы Металлы
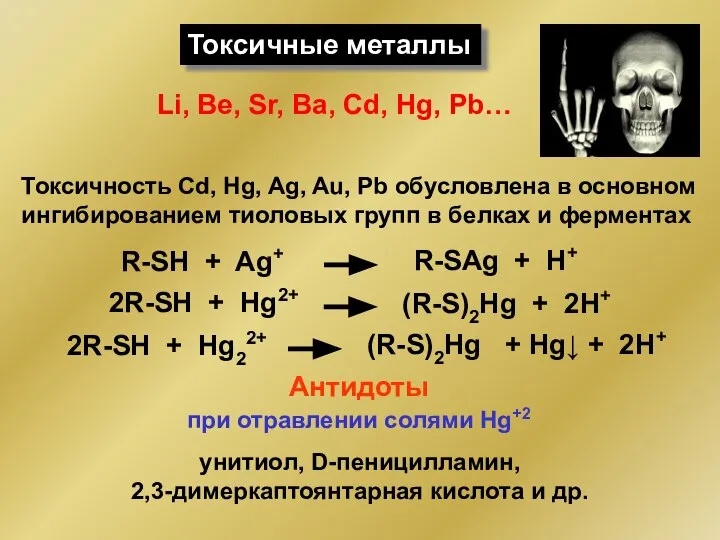
- 126. Токсичные металлы Токсичность Сd, Hg, Ag, Au, Pb обусловлена в основном ингибированием тиоловых групп в белках
- 129. Строение атома
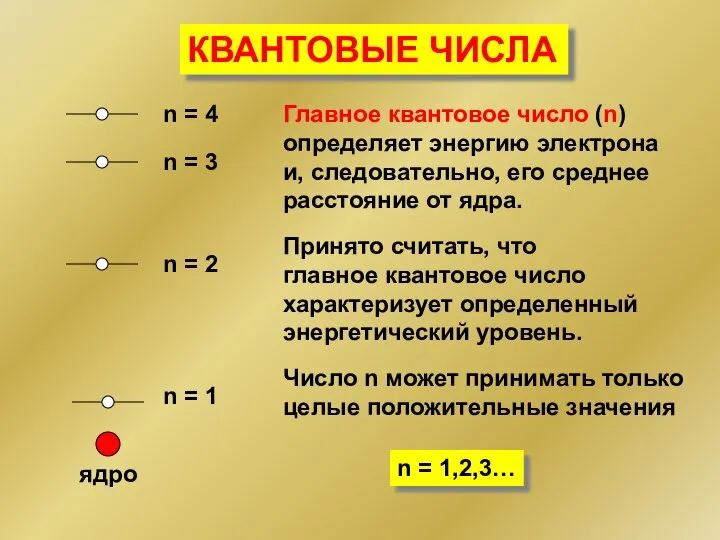
- 130. n = 1 n = 3 n = 4 n = 2 Главное квантовое число (n)
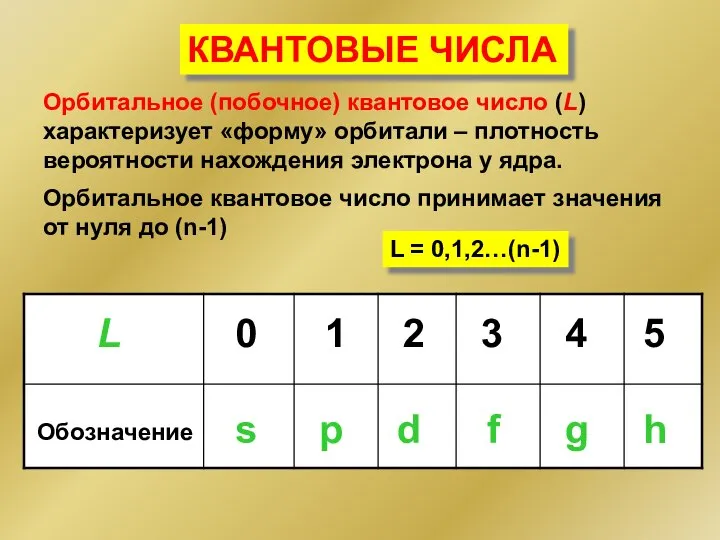
- 131. L Обозначение 0 1 2 3 4 5 s p d f h g Орбитальное (побочное)
- 132. Магнитное квантовое число (ml) определяет ориентацию орбитали в пространстве Численные значения числа ml выражаются следующей зависимостью:
- 133. Спиновое квантовое число (ms или S) Характеризует собственное вращательное движение электрона – «спин» Поскольку возможны только
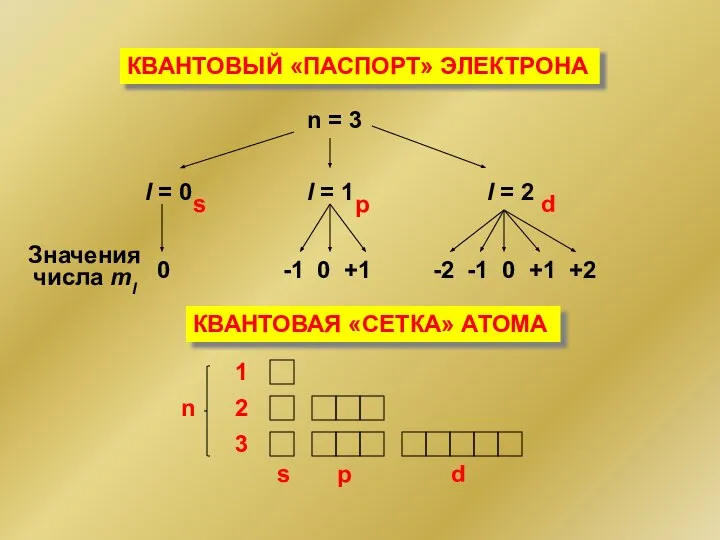
- 134. КВАНТОВЫЙ «ПАСПОРТ» ЭЛЕКТРОНА n = 3 l = 0 l = 1 l = 2 Значения
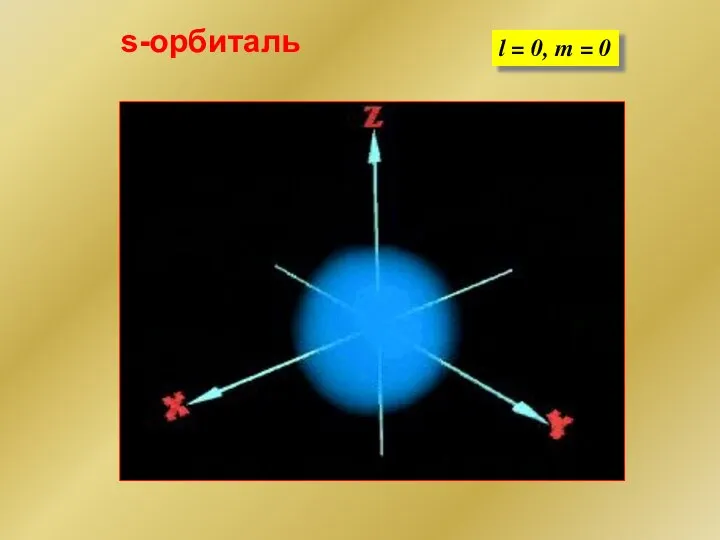
- 135. s-орбиталь l = 0, m = 0
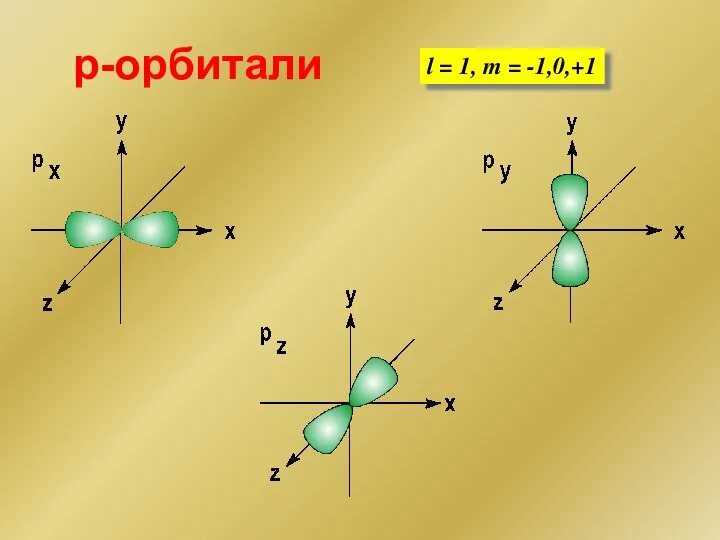
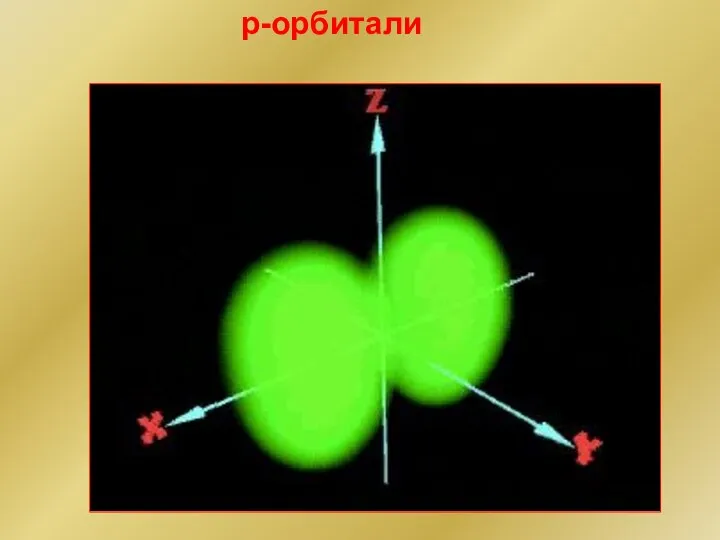
- 136. p-орбитали l = 1, m = -1,0,+1
- 137. p-орбитали
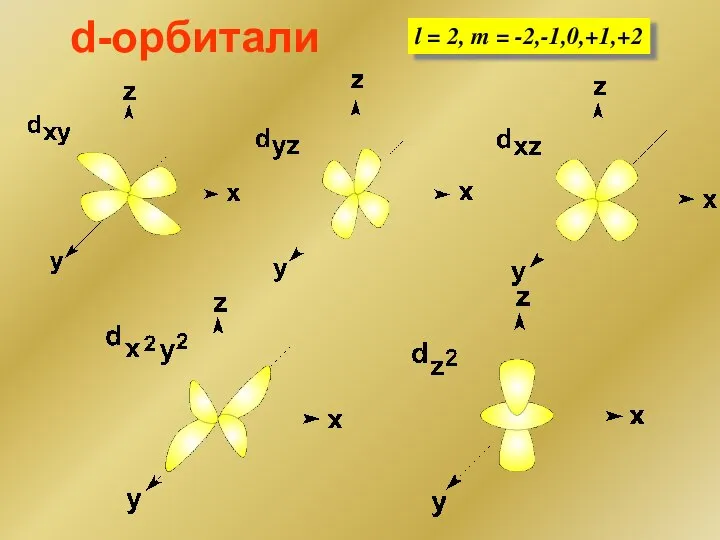
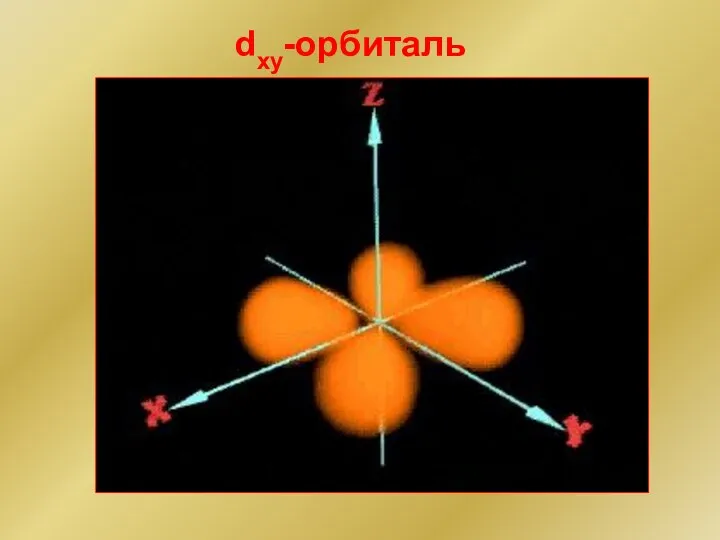
- 138. d-орбитали l = 2, m = -2,-1,0,+1,+2
- 139. dxy-орбиталь
- 140. Многоэлектронный атом Принцип минимума энергии 1s Фундаментальные закономерности ПРАВИЛА КЛЕЧКОВСКОГО
- 141. Из двух конкурентных орбиталей первой заполняется та, для которой меньше сумма Значений главного и орбитального квантового
- 142. Принцип Паули В атома не может быть двух электронов с одинаковым набором значений всех четырех квантовых
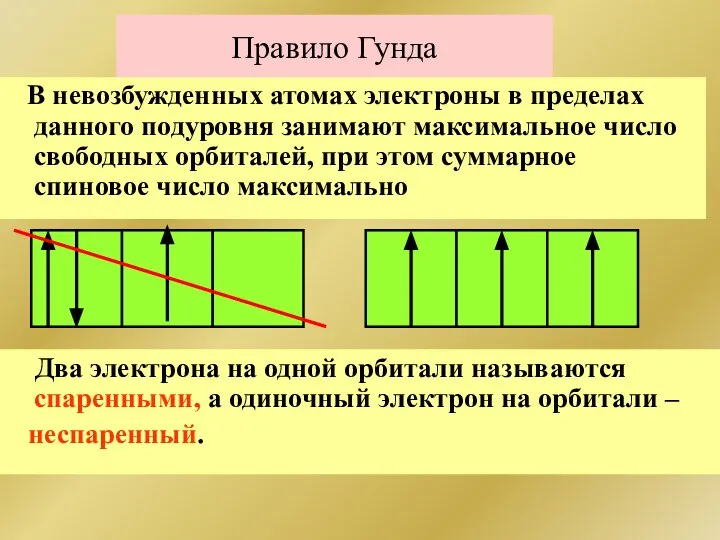
- 143. Правило Гунда В невозбужденных атомах электроны в пределах данного подуровня занимают максимальное число свободных орбиталей, при
- 144. Химическая связь
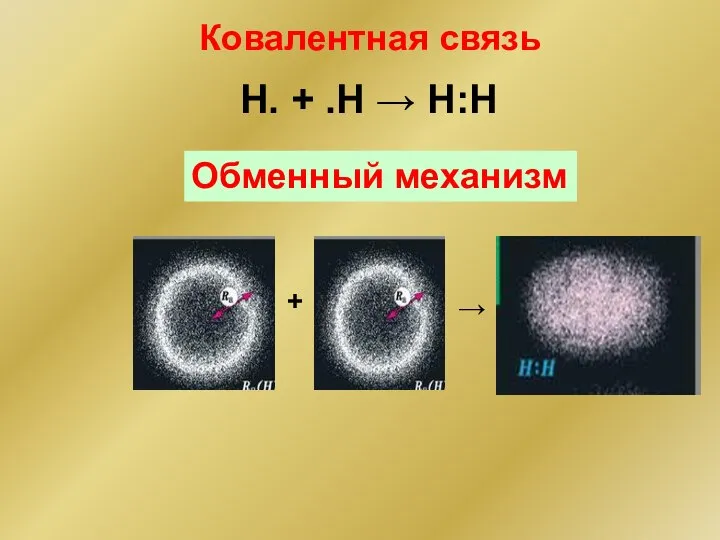
- 145. Ковалентная связь H. + .H → H:H Обменный механизм + →
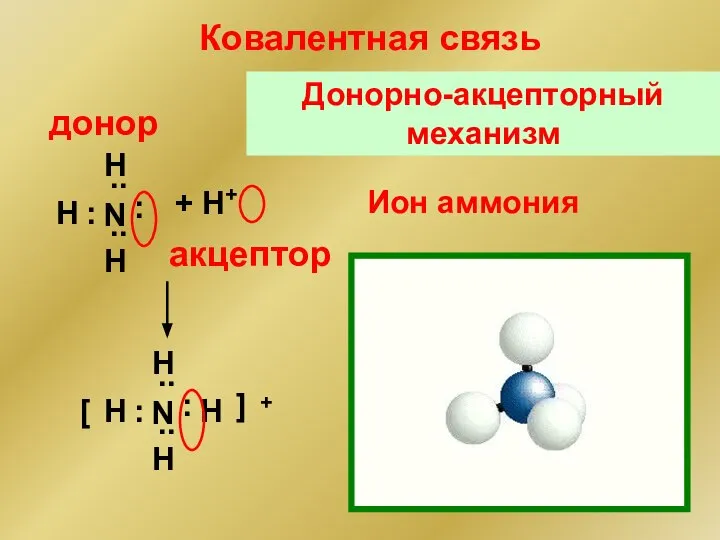
- 146. Ион аммония N .. .. : : H H H + H+ N .. .. :
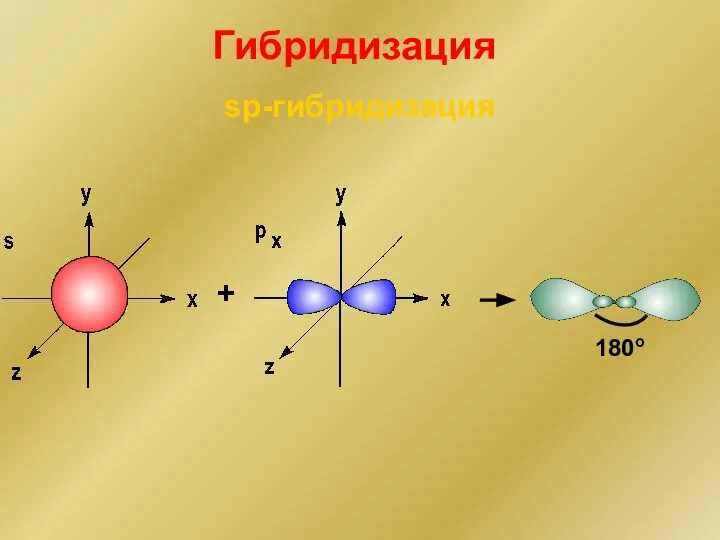
- 147. sp-гибридизация + 180o Гибридизация
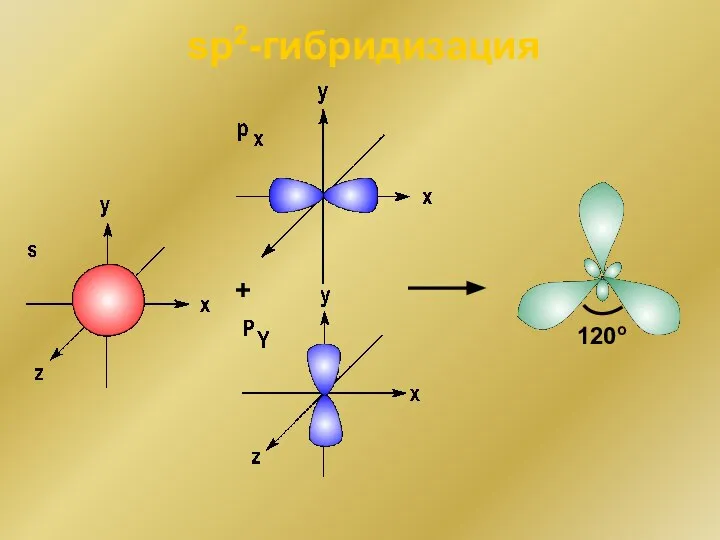
- 148. + sp2-гибридизация 120o
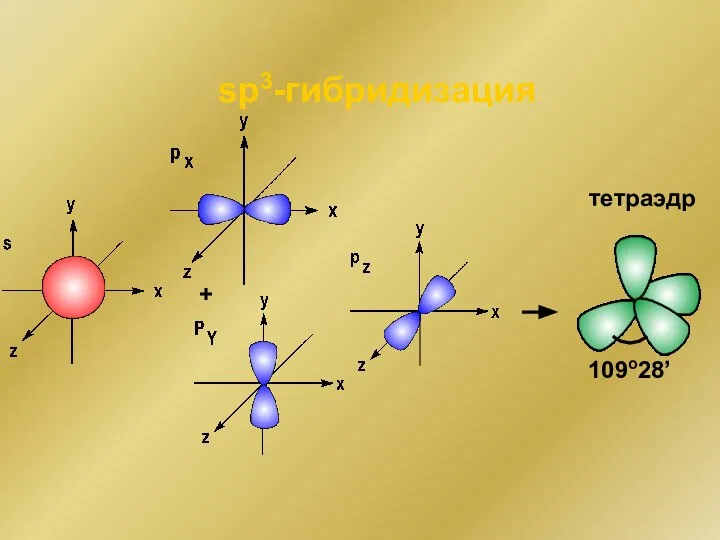
- 149. sp3-гибридизация 109o28’ + тетраэдр
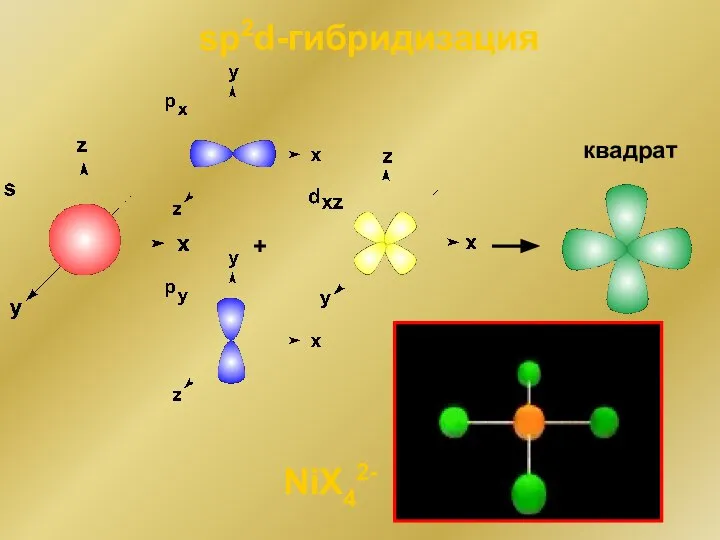
- 150. + sp2d-гибридизация квадрат NiX42-
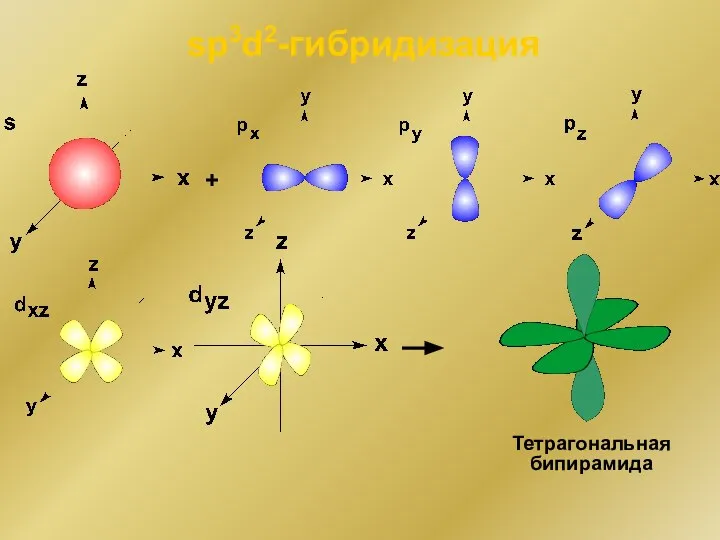
- 151. + sp3d2-гибридизация Тетрагональная бипирамида
- 152. Теория кислот и оснований Льюиса Кислоты – вещества, имеющие атом со свободной валентной орбиталью. Основания –
- 153. Fe (CN) 6 [ ] III K3 комплексообразователь число лигандов лиганд внутренняя сфера заряд комплексо- образователя
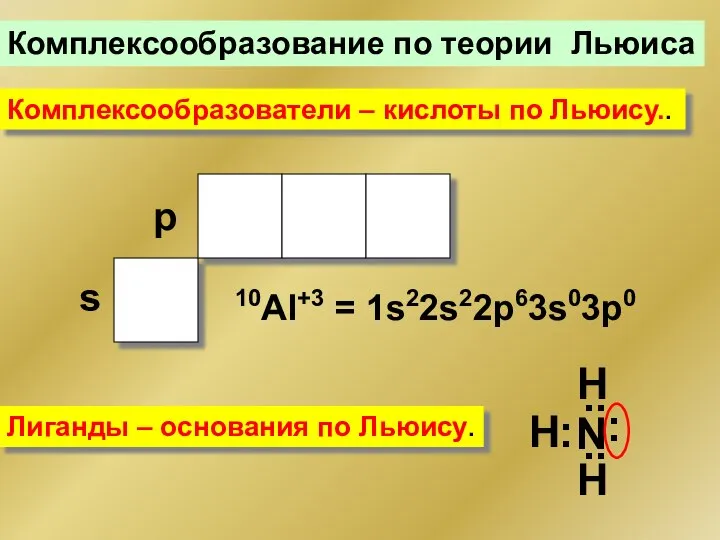
- 154. Комплексообразование по теории Льюиса Комплексообразователи – кислоты по Льюису.. Лиганды – основания по Льюису. 10Al+3 =
- 155. Комплексообразователи - катионы всех s-, d- и f-металлов, иногда - p-элементов (Al3+, Sn2+...) Лиганды: анионы -
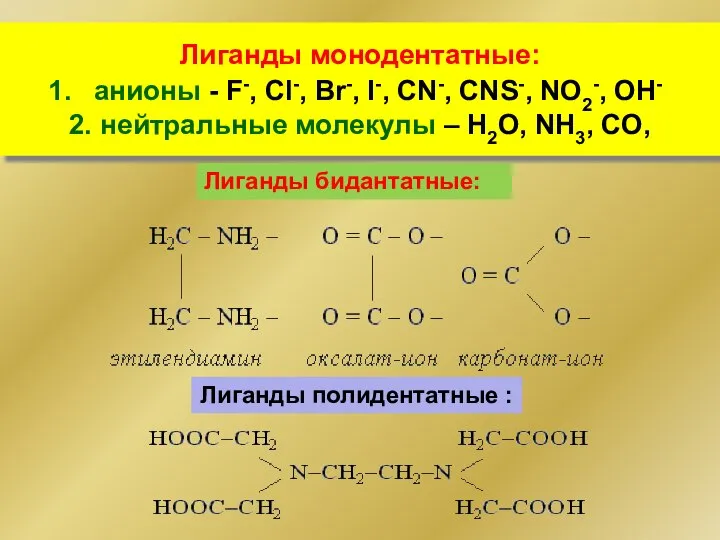
- 156. Лиганды монодентатные: анионы - F-, Cl-, Br-, I-, CN-, CNS-, NO2-, OH- 2. нейтральные молекулы –
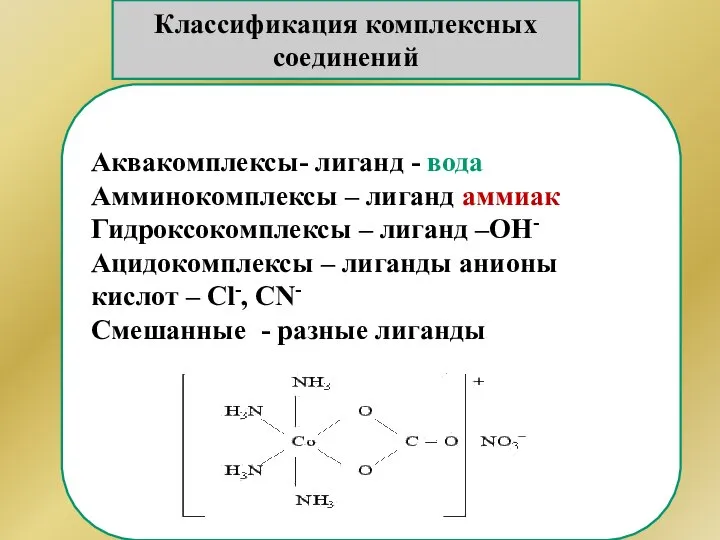
- 157. Классификация комплексных соединений Аквакомплексы- лиганд - вода Амминокомплексы – лиганд аммиак Гидроксокомплексы – лиганд –ОН- Ацидокомплексы
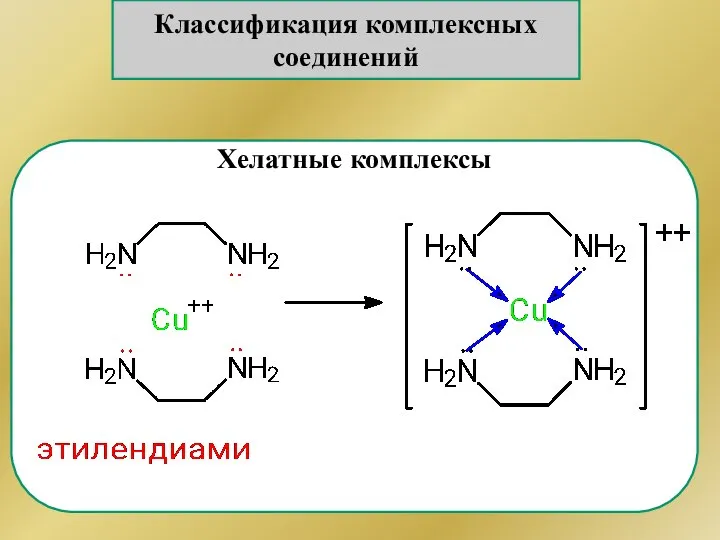
- 158. Классификация комплексных соединений Хелатные комплексы
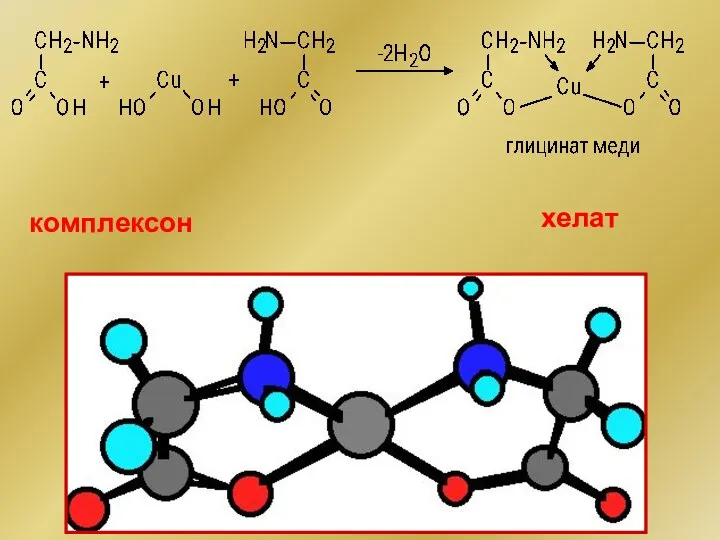
- 159. комплексон хелат
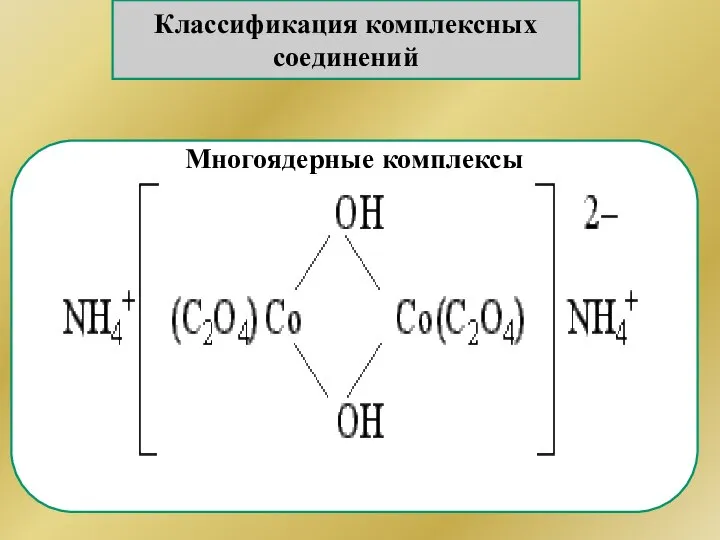
- 160. Классификация комплексных соединений Многоядерные комплексы
- 161. К.ч. = числу лигандов, если лиганд монодентатный, например, H2[CuCl4] К.ч. ≠ числу лигандов, если лиганд би-
- 162. Заряд I+ II+ III+ IV+ К. ч. Пример [Ag(NH3)2]Cl K2[HgI4], K4[Fe(CN)6] K3[Fe(CN)6], K[Al(OH)4] H2[SiF6] 4 6
- 163. Ag+ …4d10 d 4 5 .. .. sp-гибридизация [AgCN2] - Строение комплексного иона Ag0 …4d105s1 5s0
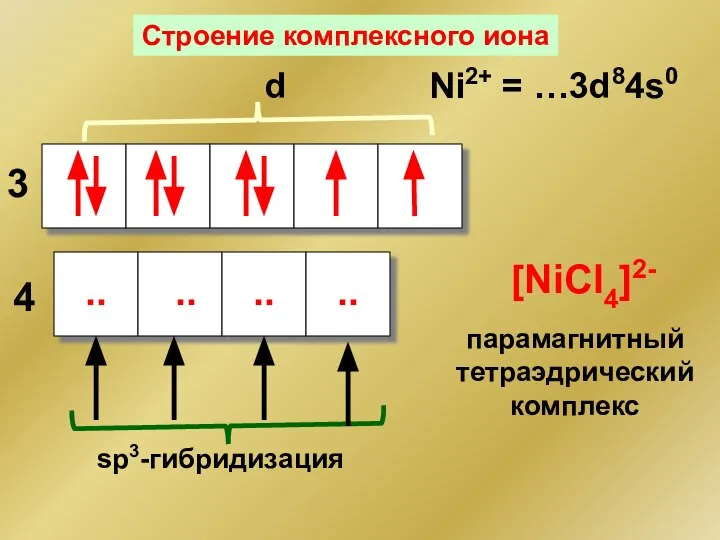
- 164. Ni2+ = …3d84s0 d 3 4 .. .. .. .. sp3-гибридизация [NiCl4]2- парамагнитный тетраэдрический комплекс Строение
- 165. [NiCl4]2-
- 166. Ni2+ = …3d84s0 d 3 4 .. .. .. .. sp2d-гибридизация [Ni(CN)4]2- Диамагнитный квадратный комплекс
- 167. [Ni(CN)4]2-
- 168. Транс-[Pt(NH3)2Cl2] Цис-[Pt(NH3)2Cl2]
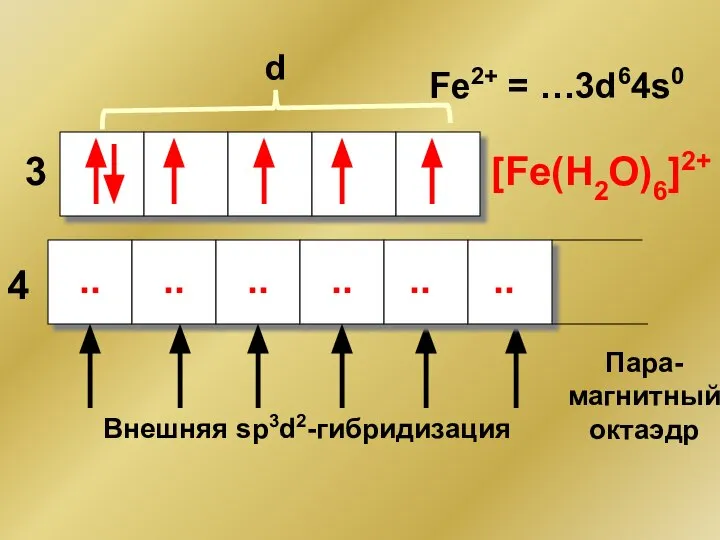
- 169. Fe2+ = …3d64s0 d 3 4 .. .. .. Внешняя sp3d2-гибридизация [Fe(H2O)6]2+ Пара- магнитный октаэдр ..
- 170. [Fe(H2O)6]2+
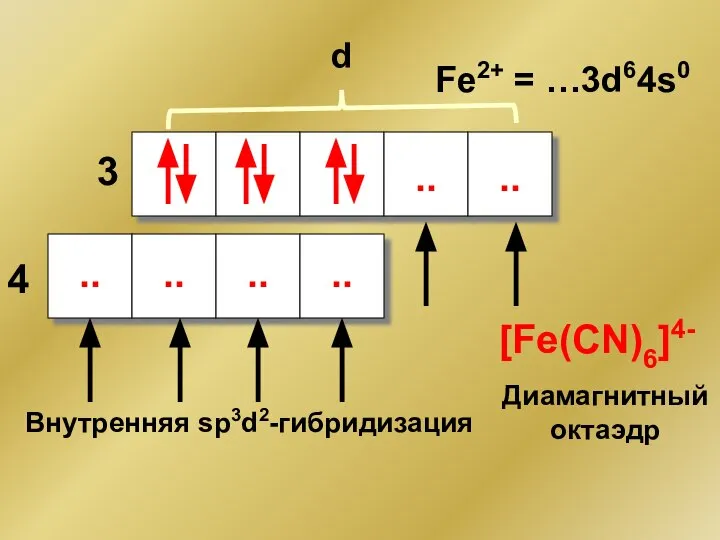
- 171. Fe2+ = …3d64s0 d 3 4 .. .. .. Внутренняя sp3d2-гибридизация [Fe(CN)6]4- Диамагнитный октаэдр .. ..
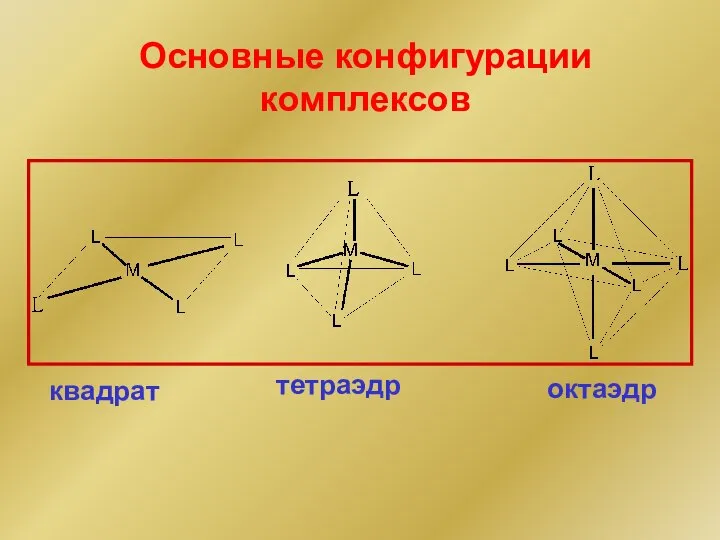
- 172. квадрат тетраэдр октаэдр Основные конфигурации комплексов
- 173. Изолированные [Cu(NH3)4]SO4 Равновесия в растворах комплексных соединений [Сu(NH3)4]2+ + SO42- Первичная диссоциация [Сu(NH3)4]2+ Сu2+ + 4NH3
- 174. Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за лиганд [Сu(NH3)4]2+ Kн=1,07•10-12 Лиганд - NH3 Комплексообразователи
- 175. Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за комплексообразователь [Сu(NH3)4]2+ Kн=1,07•10-12 Лиганды - NH3, CN-
- 176. Биокомплексообразователи Fe(II) в составе миоглобина, гемоглобина, ферментов Fe(III) в составе цитохромов Co(III) в витамине В12 Cu(I),
- 177. Биолиганды Кислород Оксид углерода(II) Азот Аминокислоты Пептиды Нуклеотиды Углеводы Лекарства Метаболиты
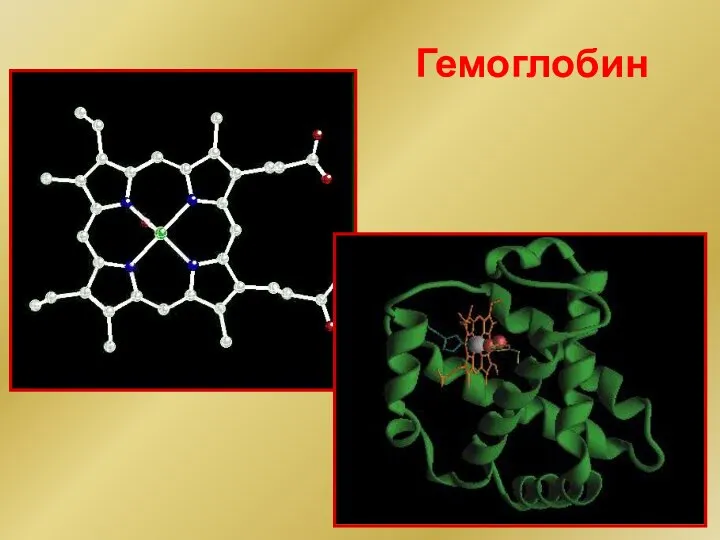
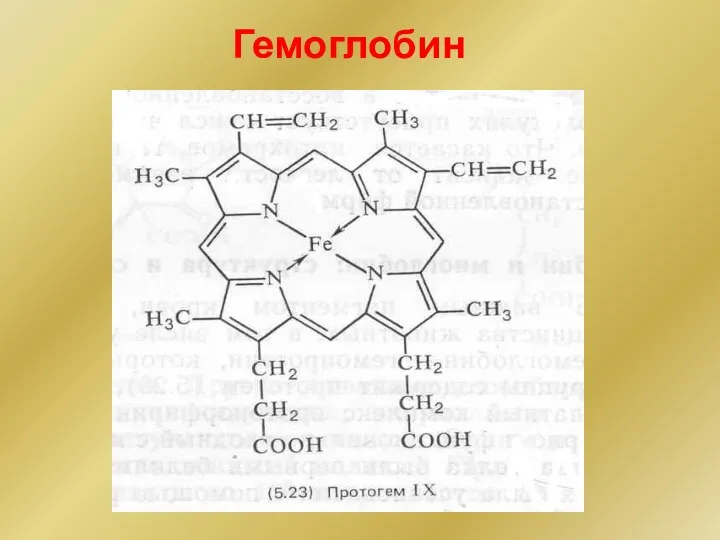
- 178. Гемоглобин
- 179. Гемоглобин
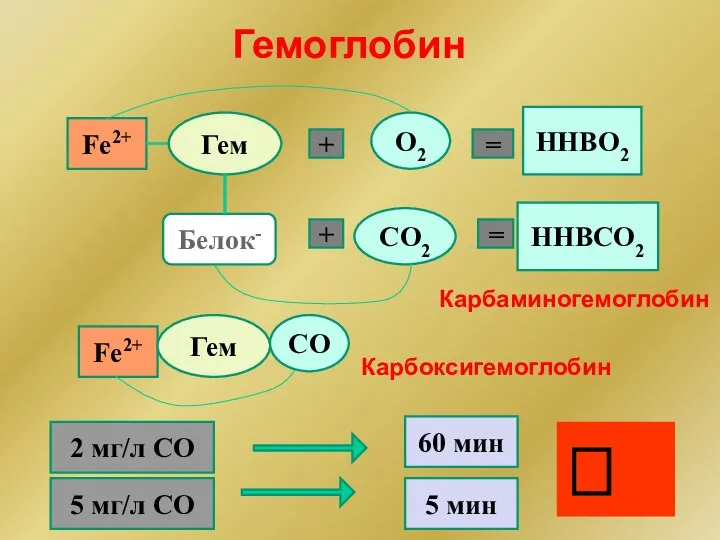
- 180. Гемоглобин Fe2+ Гем + О2 = ННBO2 + CО2 = ННBCO2 Белок- Fe2+ Гем СО Карбаминогемоглобин
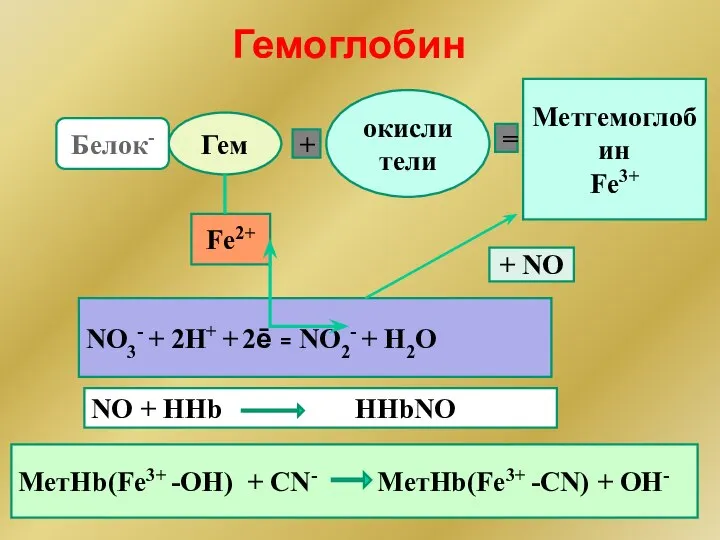
- 181. Гемоглобин Fe2+ Гем + окислители Метгемоглобин Fe3+ = Белок- NO3- + 2H+ + 2ē = NO2-
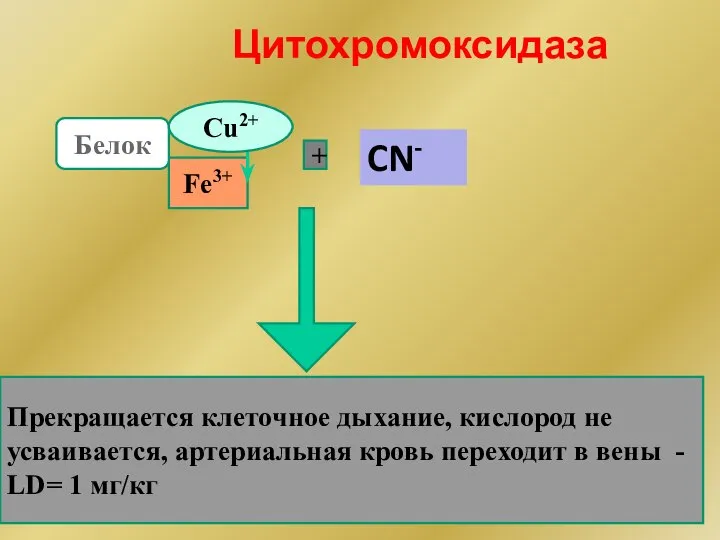
- 182. Цитохромоксидаза Fe3+ + Белок Прекращается клеточное дыхание, кислород не усваивается, артериальная кровь переходит в вены -
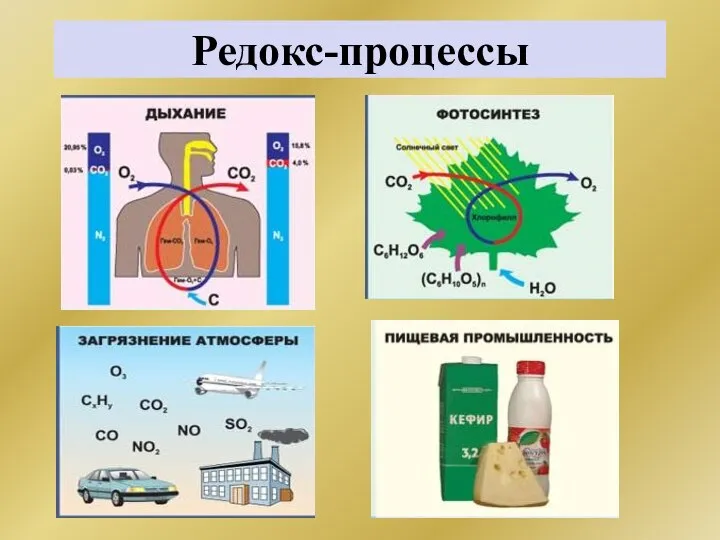
- 183. Редокс-процессы
- 184. РОЛЬ ОВР ОВР лежат в основе метаболизма любых организмов. Аэробный метаболизм: окислитель – О2 (дыхание) ,
- 185. 2) оксигеназный путь (включение в субстрат одного атома кислорода - монооксигеназный путь, двух атомов кислорода -
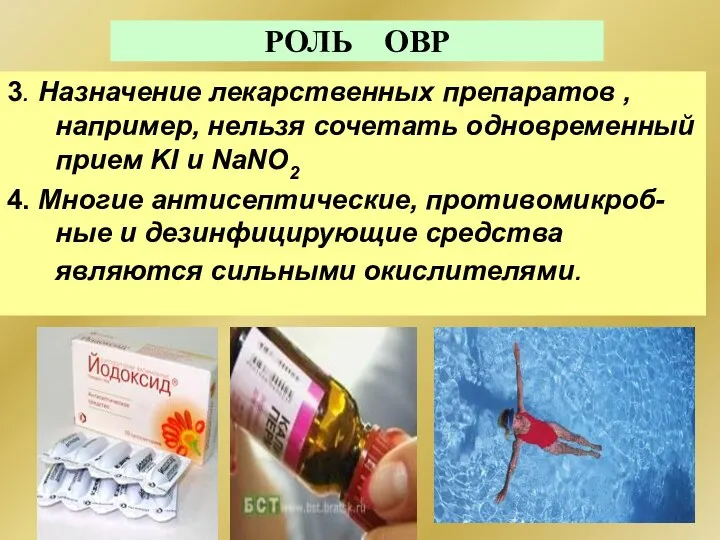
- 186. РОЛЬ ОВР 3. Назначение лекарственных препаратов , например, нельзя сочетать одновременный прием KI и NaNO2 4.
- 187. Окисление, восстановление Окисление можно определить как: потеря электронов веществом; удаление водорода из какого-либо вещества; присоединение кислорода
- 188. Направление ОВР В основе определения направления самопроизвольного протекания ОВР лежит правило: Самопроизвольно ОВР протекают всегда в
- 189. Редокс-потенциал Окислительно-восстановительный потенциал (ОВП, ϕr) – количественная мера окислительно-восстановительной способности. Величина ϕr зависит от: а) природы
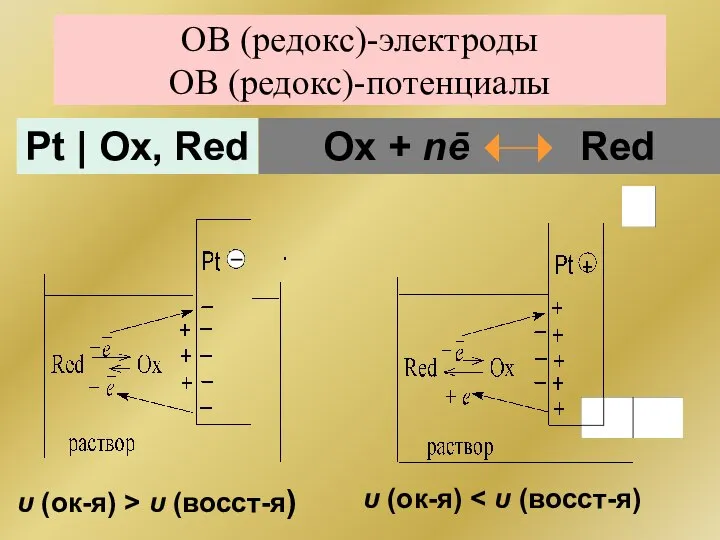
- 190. ОВ (редокс)-электроды ОВ (редокс)-потенциалы Pt | Ох, Red Ох + nē Red υ (ок-я) > υ
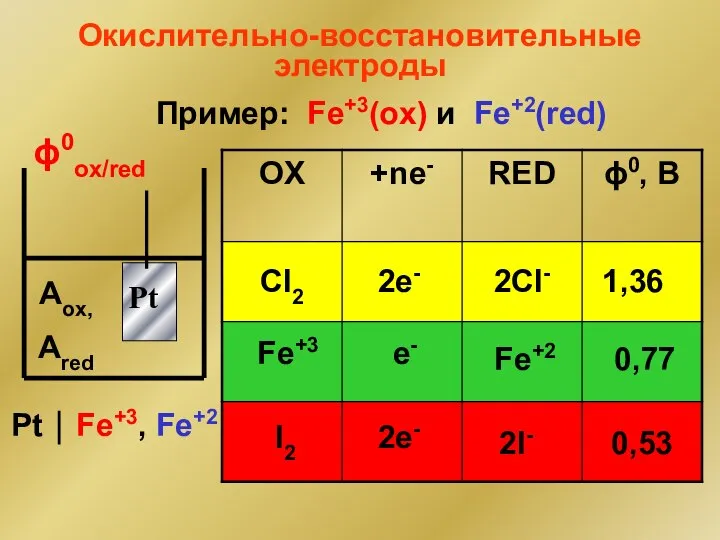
- 191. Окислительно-восстановительные электроды ϕ0ox/red Pt ⏐ Fe+3, Fe+2 Aox, Ared Cl2 Fe+3 I2 2e- e- 2e- 2Cl-
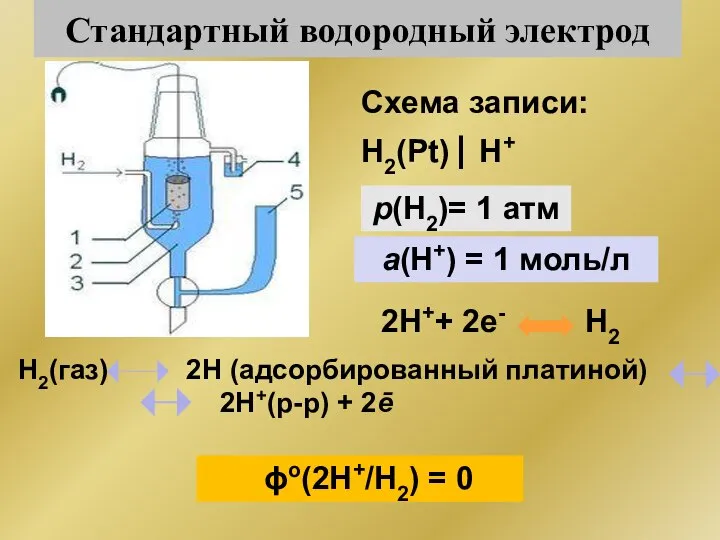
- 192. Стандартный водородный электрод Н2(газ) 2Н (адсорбированный платиной) 2Н+(р-р) + 2ē ϕо(2Н+/Н2) = 0 р(Н2)= 1 атм
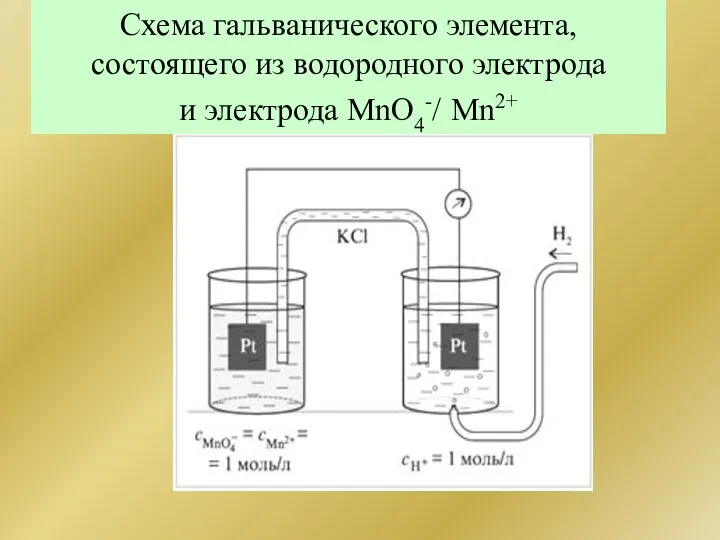
- 193. Схема гальванического элемента, состоящего из водородного электрода и электрода MnO4-/ Mn2+
- 194. ОВ (редокс)-электроды ОВ (редокс)-потенциалы Уравнение Нернста - Петерса: Значения, которое принимает ϕr при концентрациях равных 1
- 195. Направление ОВР Сравнивая потенциалы ОВ пар, участвующих в ОВР, можно заранее определить направление, в котором будет
- 196. Направление ОВР I2 + 2e = 2I– ϕ1 = 0,54 В (первая ОВ пара) окисленная восстановленная
- 197. Действием какого галогена (Cl2 или I2) можно окислить Fe+2 до Fe+3? Процесс идет самопроизвольно, если: ϕox
- 198. Биохимические ОВР 1.Все биохимические ОВР – каталитические Ферменты – оксидоредуктазы. Оксидоредуктазы – сложные белки: Белок +
- 199. Биохимические ОВР рН уменьшается ϕ увеличивается 3. В биохимии исполь- зуют нормальный восстановитель ный потенциал ϕ°′,
- 200. Биохимические ОВР Природные сопряженные ОВ-пары имеют потенциалы в пределах:– 0,42 ÷ + 0,82 В При ϕ
- 201. Редокс-потенциалы дыхательной цепи Дыхательная цепь митохондрий Перенос электронов Дыхание
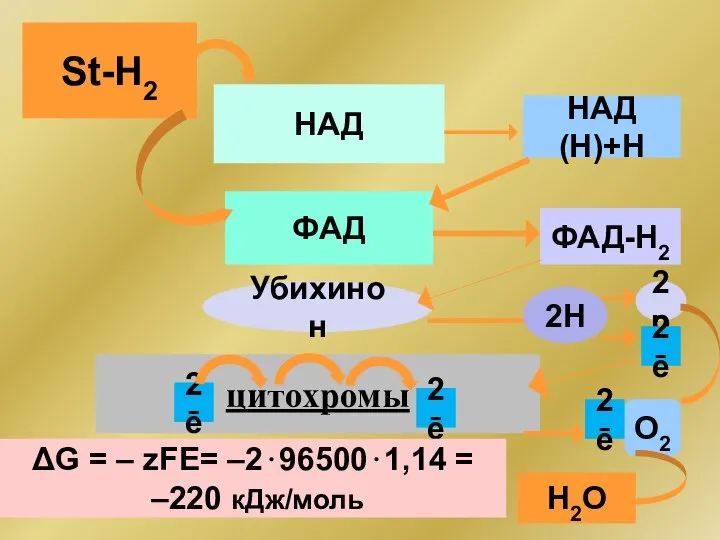
- 202. St-H2 НАД НАД(Н)+Н ФАД ФАД-Н2 Убихинон 2Н 2р цитохромы 2ē О2 2ē Н2О 2ē 2ē ΔG
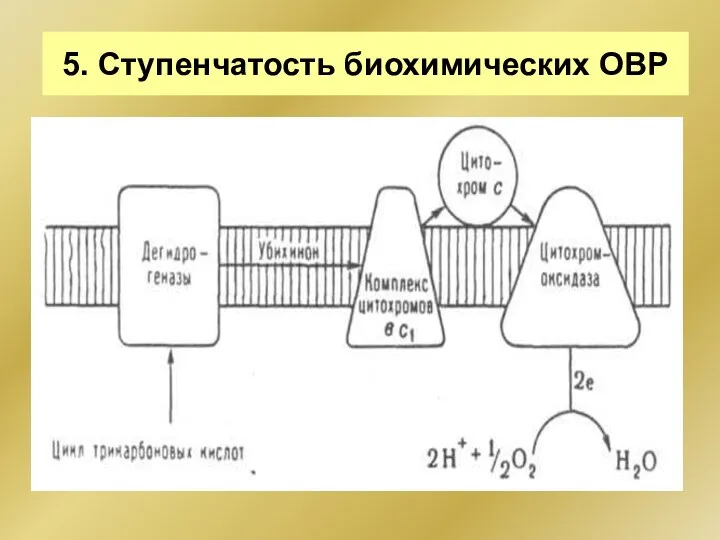
- 203. 5. Ступенчатость биохимических ОВР
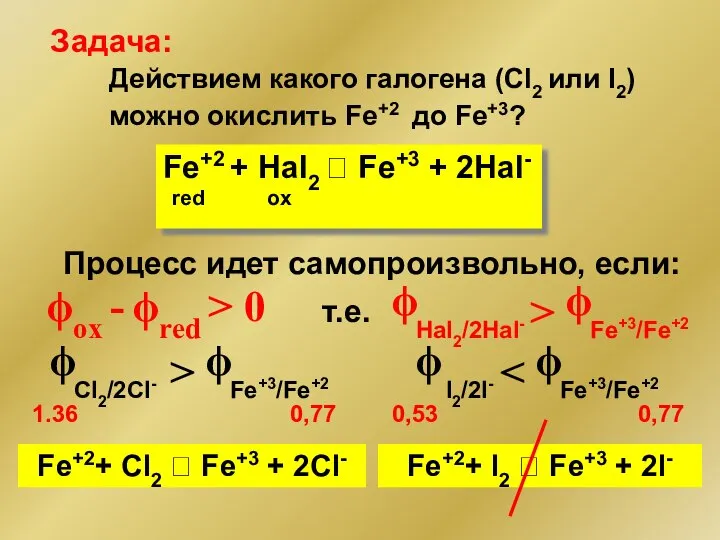
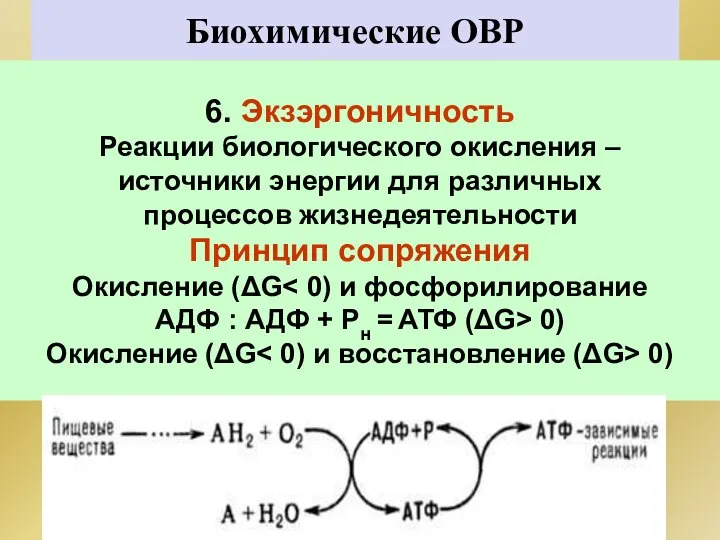
- 204. Биохимические ОВР 6. Экзэргоничность Реакции биологического окисления – источники энергии для различных процессов жизнедеятельности Принцип сопряжения
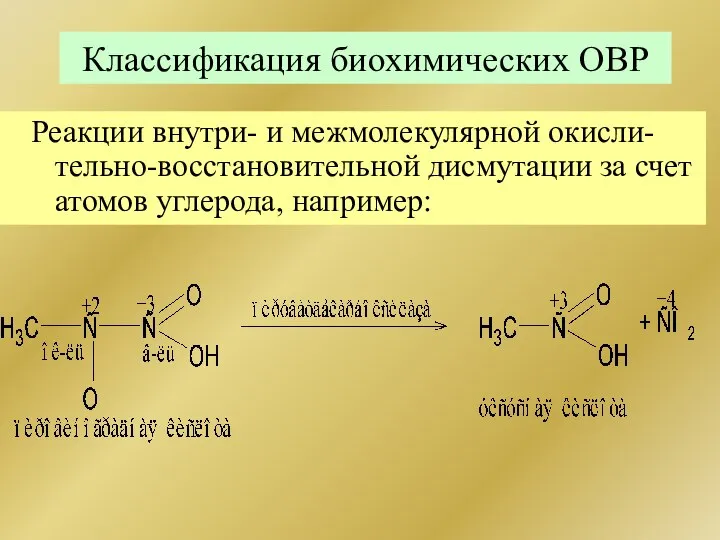
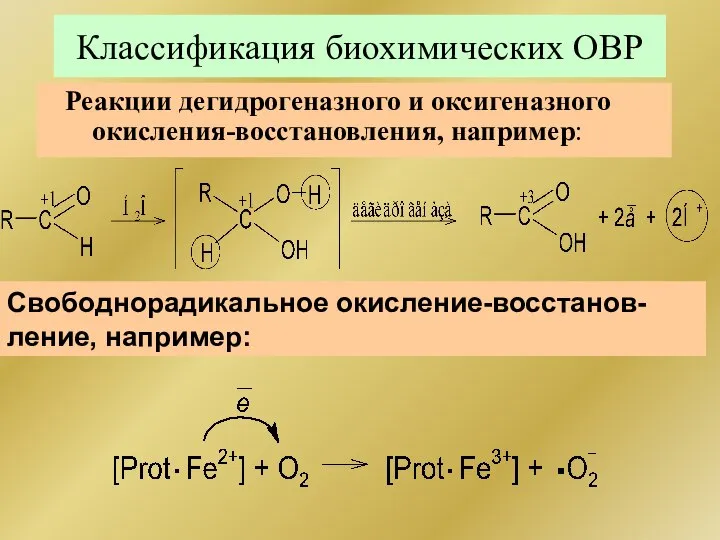
- 205. Классификация биохимических ОВР Реакции внутри- и межмолекулярной окисли-тельно-восстановительной дисмутации за счет атомов углерода, например:
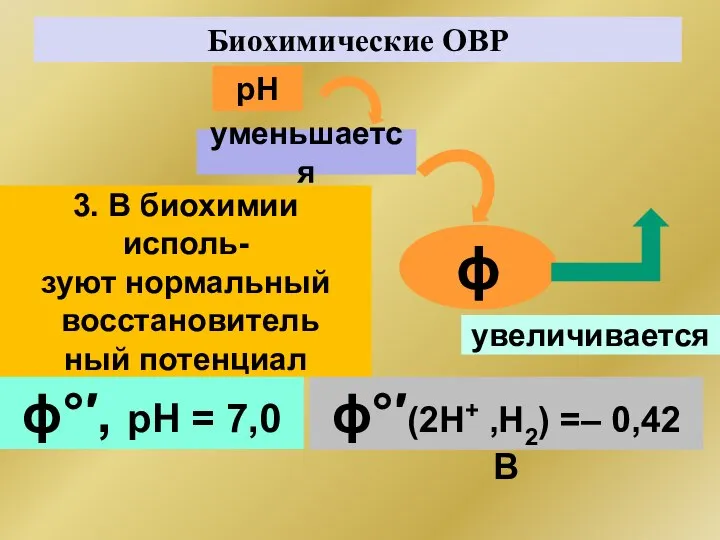
- 206. Классификация биохимических ОВР Реакции дегидрогеназного и оксигеназного окисления-восстановления, например: Свободнорадикальное окисление-восстанов- ление, например:
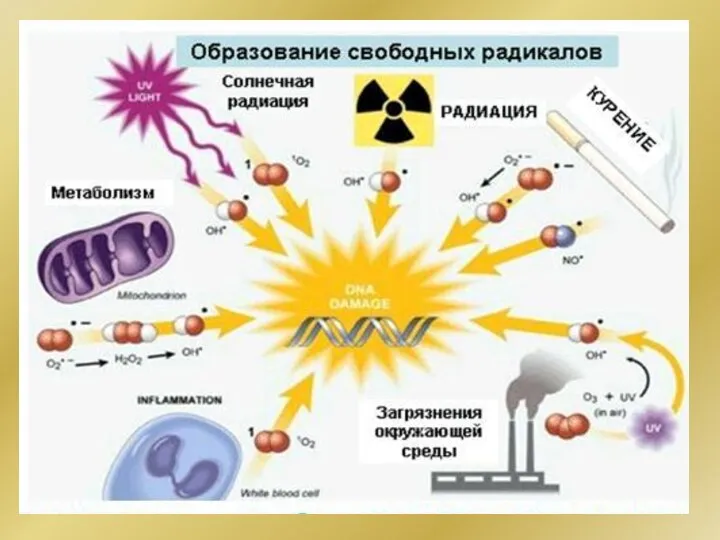
- 207. Главный источник радикалов в организме - молекулярный кислород, а в случае радиационного воздействия – вода. К
- 208. Радиация → радиолиз Н2О (небольшая энергия) → Н∙ + НО∙ ; Н∙+ О2 → НО∙ +
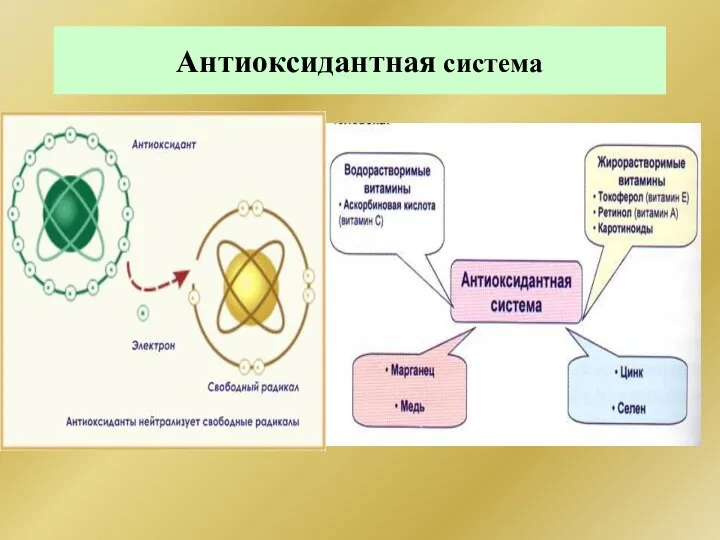
- 210. Антиоксидантная система Антиоксиданты - соединения, способные уменьшать интенсивность свободнорадикального окисления, нейтрализовать свободные радикалы за счет обмена
- 211. Антиоксидантная система
- 212. Антиоксидантная система 1. Антиоксидантные ферменты (супероксиддисмутаза (СОД), церулоплазмин, каталаза, глутатион-зависимые ферменты) обеспечивают комплексную антирадикальную защиту биополимеров.
- 213. Антиоксидантная система Первая линия защиты - ферменты антиоксидантной системы, ингибирующие инициацию перекисного окисления липидов и предотвращающие
- 214. Антиоксидантная система
- 215. Поверхностные явления Дисперсные системы Растворы ВМС Модуль «Основы коллодной химии» Коллоидная химия [kolla (греч.) – клей]
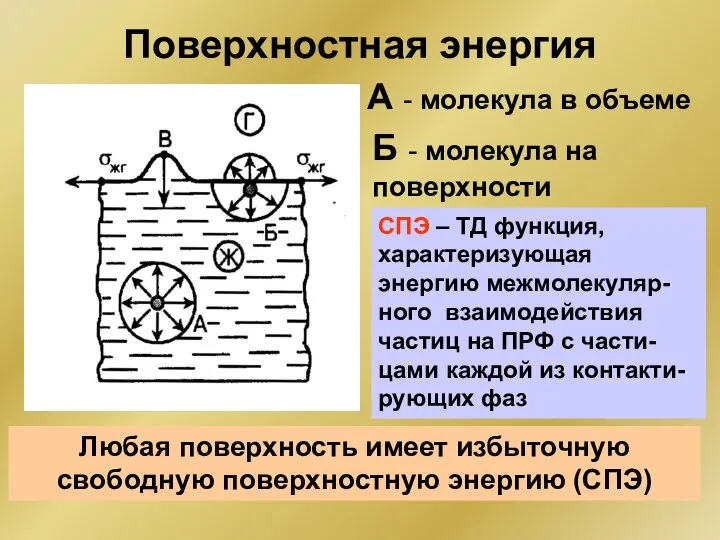
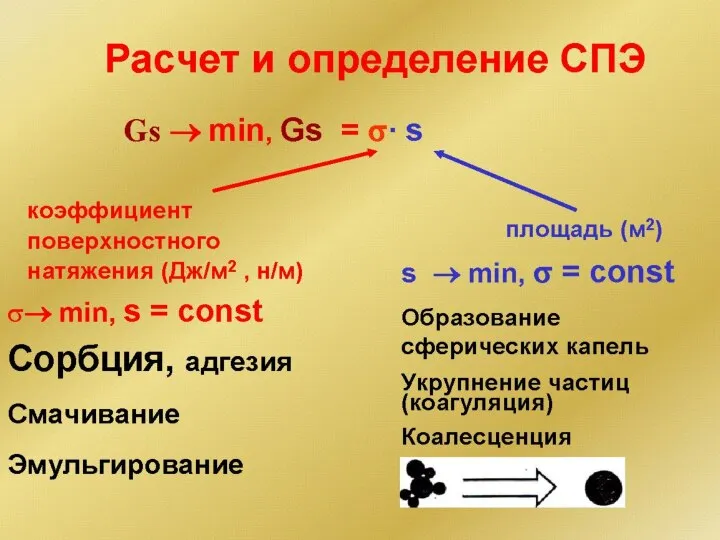
- 216. Поверхностная энергия А - молекула в объеме Б - молекула на поверхности Любая поверхность имеет избыточную
- 218. СПЭ в биологии и медицине Полная альвеолярная поверхность легких при вдохе равна 70—80 м2, что примерно
- 219. К с.р. >> 1 Классификация Сорбент + сорбат Сорбция Адсорбция Абсорбция Неподвижная пов-ть: г/тв, ж/тв Подвижная
- 220. Адсорбция Химическая: образование хим. связи Е 40 - 400 кДж/моль Необратимость, специфичность, локализованность Физическая: межмолекулярные взаимод-я
- 221. Адсорбция – поглощение газов, паров или жидкостей поверхностным слоем твердого тела.
- 222. ПАВ на границе вода-воздух вода σ ×103 н/м 72,5 масляная кислота 26,5 Начальное состояние СH3CH2CH2COOH Гидрофобный
- 223. Гемосорбция, лимфосорбция, плазмосорбция – удаление ядовитых веществ из кровяного русла
- 224. ХРОМАТОГРАФИЯ Основана на различном распределении компонентов смеси между двумя фазами - неподвижной (стационарной) и подвижной. Физико-химический
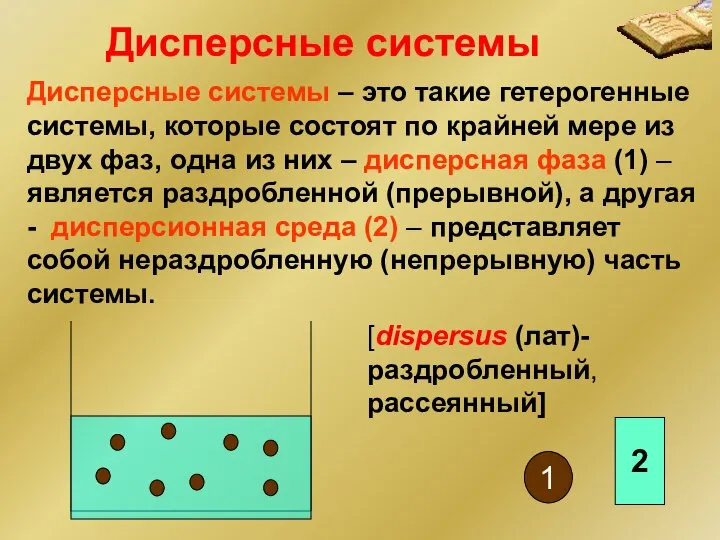
- 225. Дисперсные системы – это такие гетерогенные системы, которые состоят по крайней мере из двух фаз, одна
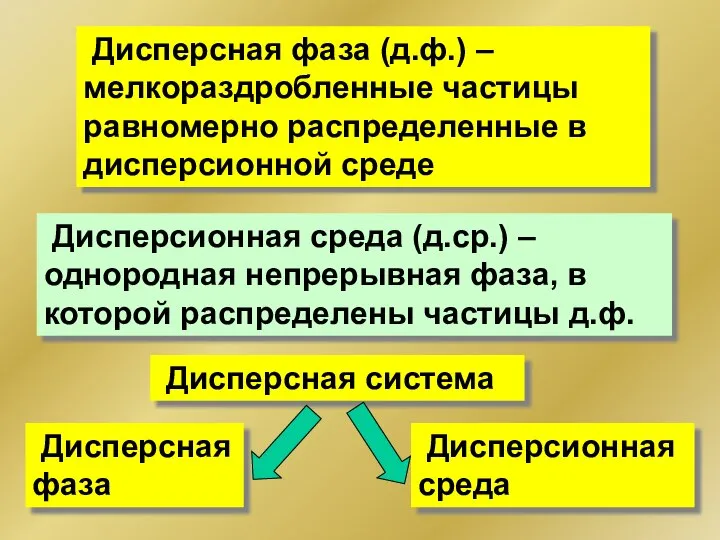
- 226. Дисперсная фаза (д.ф.) – мелкораздробленные частицы равномерно распределенные в дисперсионной среде Дисперсионная среда (д.ср.) – однородная
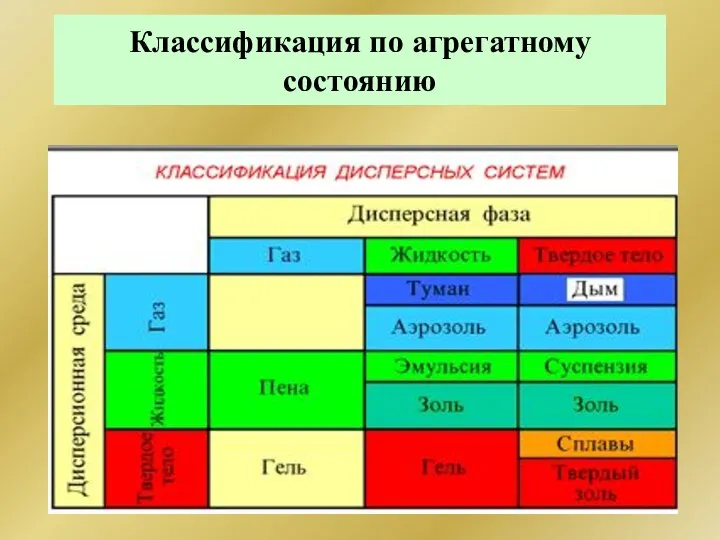
- 227. Классификация по агрегатному состоянию
- 228. Примеры дисперсных систем
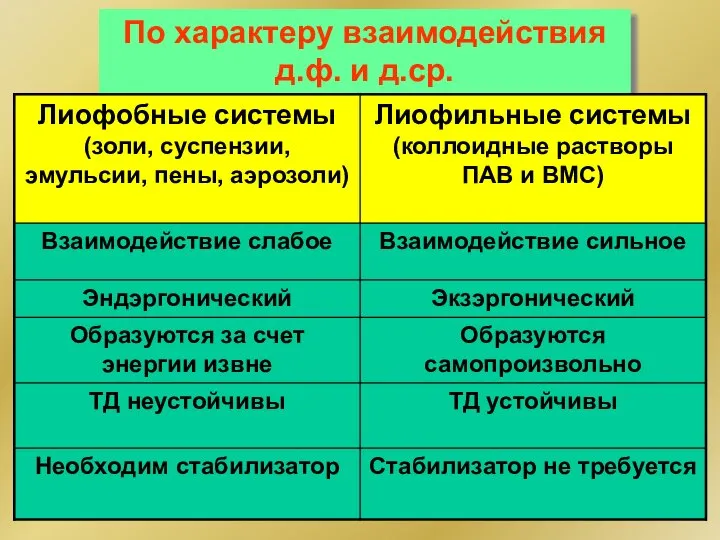
- 229. По характеру взаимодействия д.ф. и д.ср.
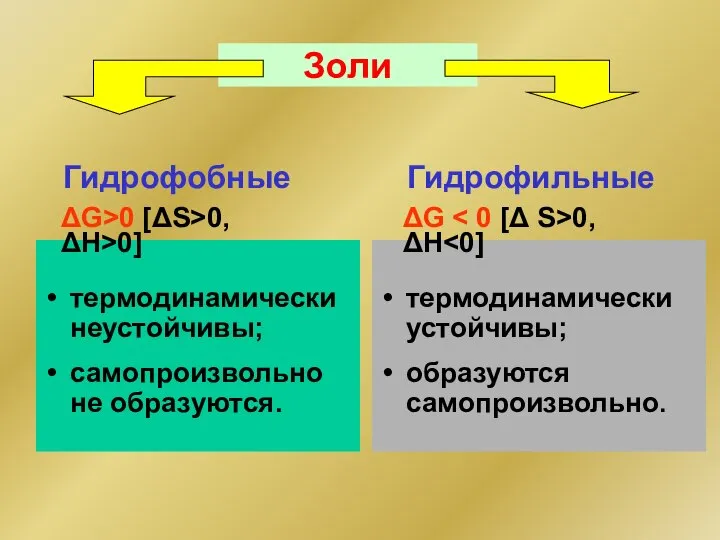
- 230. Золи Гидрофобные Гидрофильные термодинамически неустойчивы; самопроизвольно не образуются. термодинамически устойчивы; образуются самопроизвольно. ΔG>0 [ΔS>0, ΔH>0] ΔG
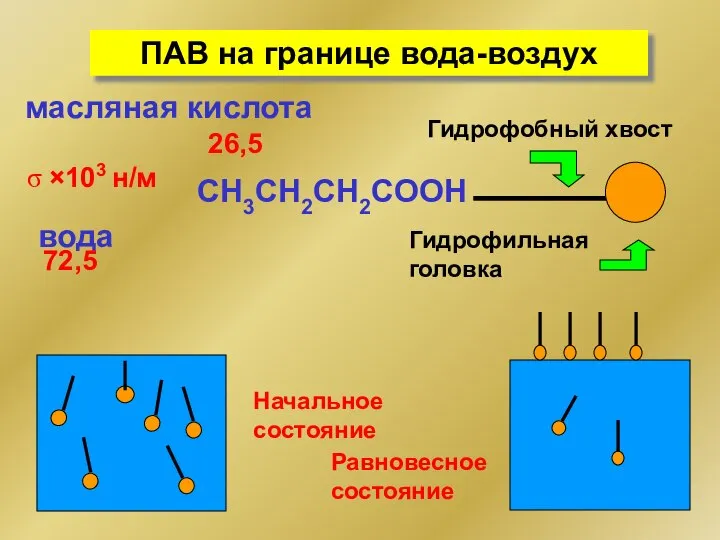
- 231. По характеру взаимодействия частиц д.ф.
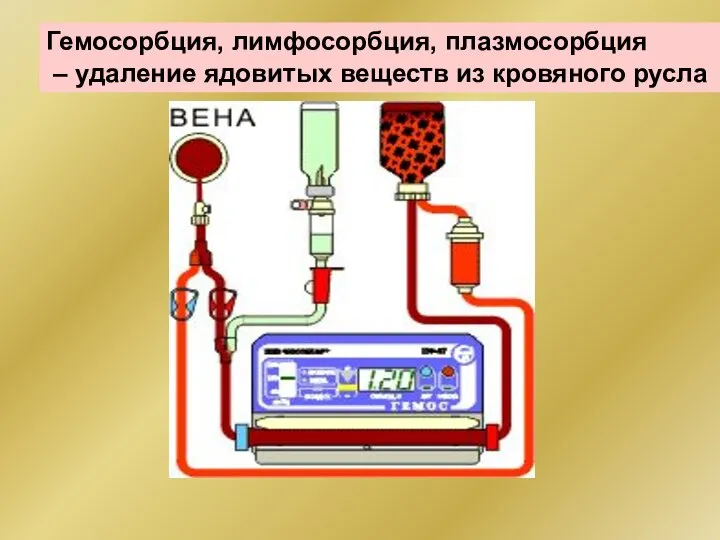
- 232. Лиофобные коллоидные растворы (ЗОЛИ) Условия образования: Малая растворимость д.ф. в д.среде (низкое сродство фазы и среды);
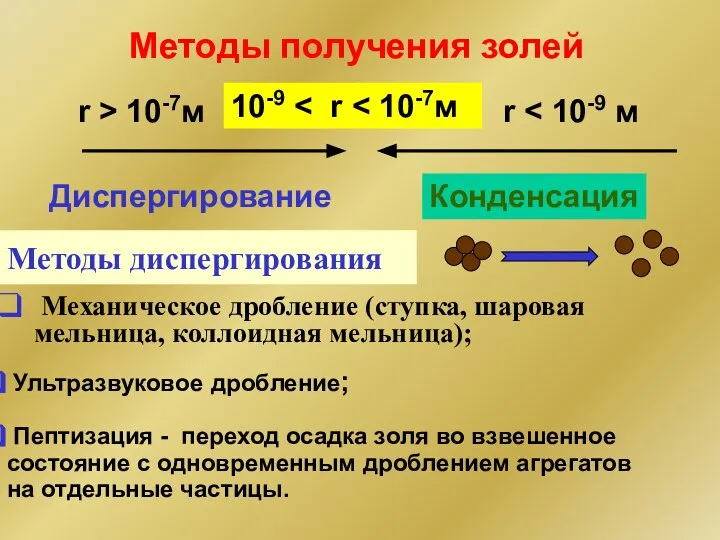
- 233. Методы получения золей 10-9 r r > 10-7м Диспергирование Конденсация Методы диспергирования Механическое дробление (ступка, шаровая
- 234. Методы конденсации Физическая конденсация (замена растворителя; Химическая конденсация – любая реакция, приводящая к образованию осадка. Окислительно-восстановительные
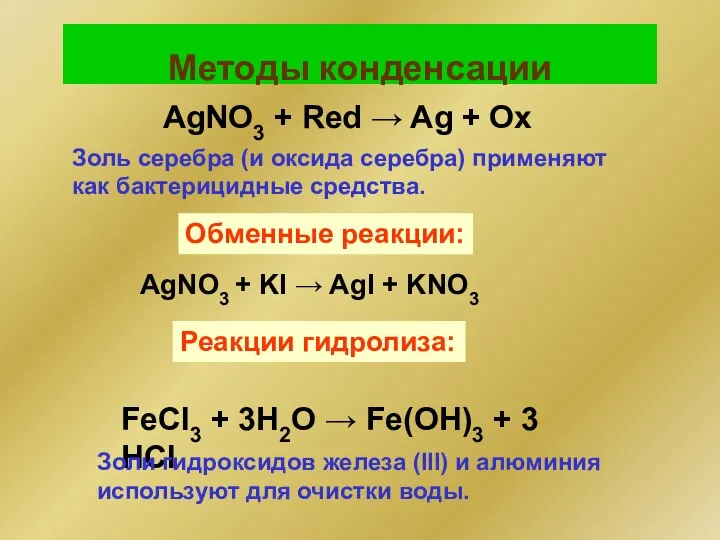
- 235. Методы конденсации AgNO3 + Red → Ag + Ox Золь серебра (и оксида серебра) применяют как
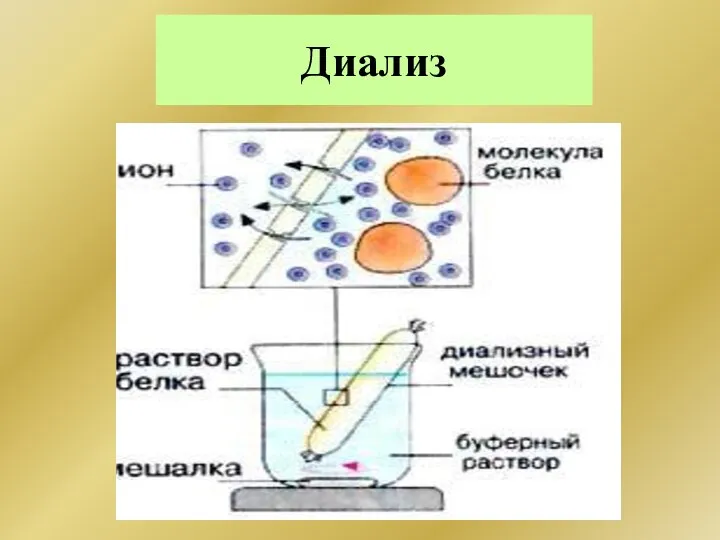
- 236. Диализ
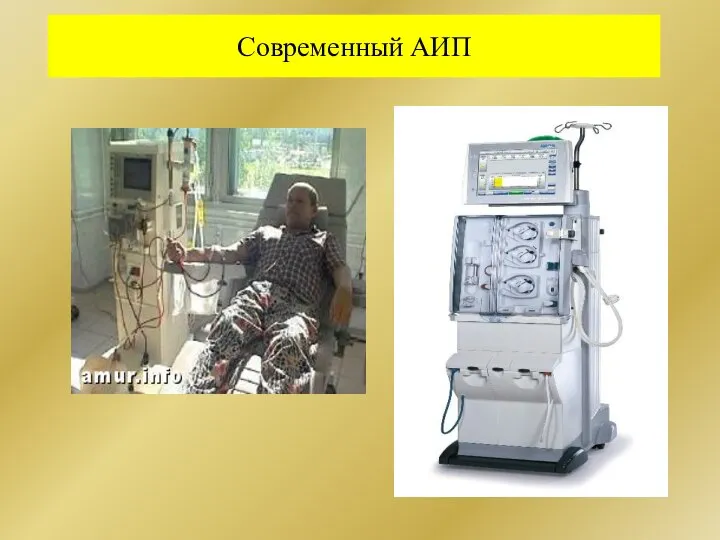
- 237. АИП (Дж. Абель,1913 г. –аппарат для диализа, основа конструкции, В. Колф, 1944 – первая на практике
- 238. Современный АИП
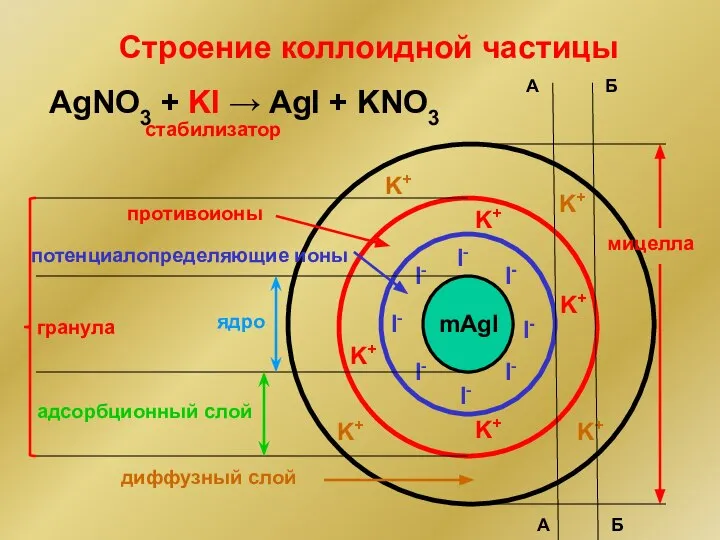
- 239. Строение коллоидной частицы Мицелла – частица дисперсной фазы золя вместе с окружающей ее сольватной оболочкой из
- 240. Строение коллоидной частицы AgNO3 + KI → AgI + KNO3 mAgI I- I- I- I- I-
- 241. Строение коллоидной частицы Межфазный потенциал (ϕмф) – потенциал ДЭС на границе тв/ж (межфазная граница) Значение ϕмф
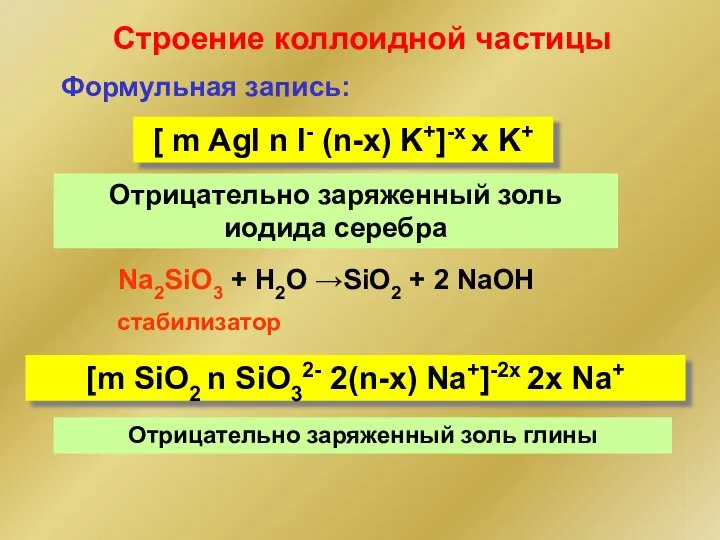
- 242. Строение коллоидной частицы Формульная запись: [ m AgI n I- (n-x) K+]-x x K+ Na2SiO3 +
- 243. Свойства золей Молекулярно-кинетические а) броуновское движение б) диффузия в) осмос Росм (р-р сахарозы, w =1%) =
- 244. Окраска золей (абсорбция света) полихромия Рассеяние света Точечный источник света Эффект Тиндаля Боковое освещение Голубая опалесценция
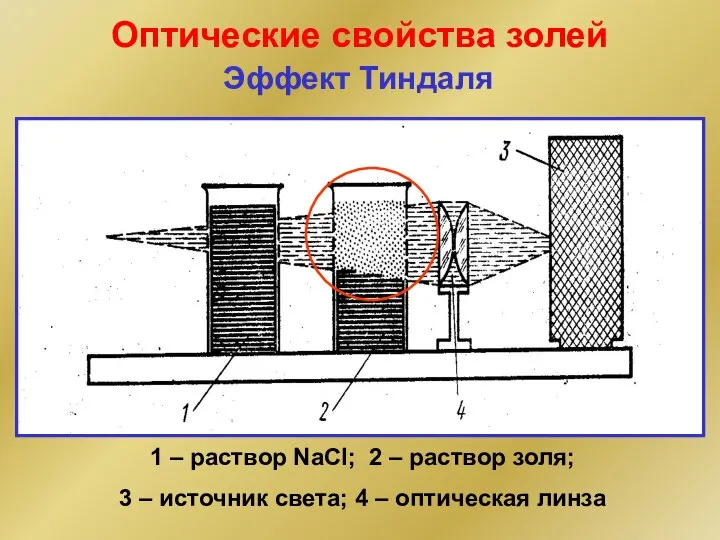
- 245. Оптические свойства золей 1 – раствор NaCl; 2 – раствор золя; 3 – источник света; 4
- 246. Эффект Тиндаля
- 247. Устойчивость дисперсных систем, золей Седиментационная устойчивость – способность частиц д.ф. находиться во взвешенном состоянии и не
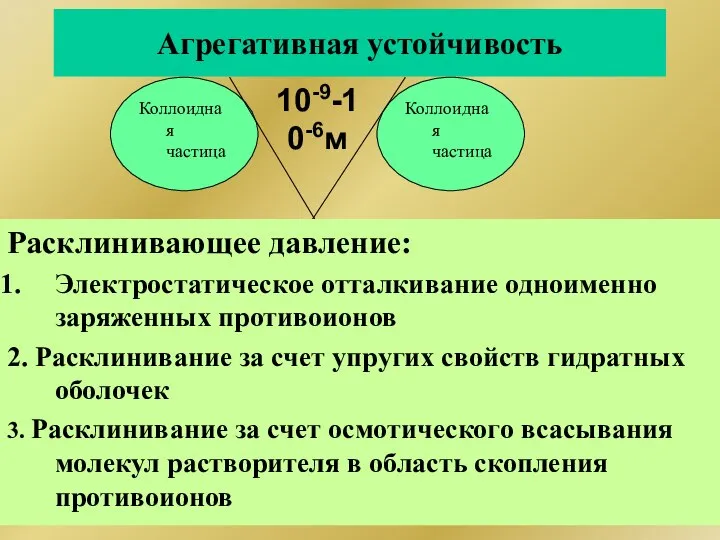
- 248. Агрегативная устойчивость Коллоидная частица Коллоидная частица 10-9-10-6м Расклинивающее давление: Электростатическое отталкивание одноименно заряженных противоионов 2. Расклинивание
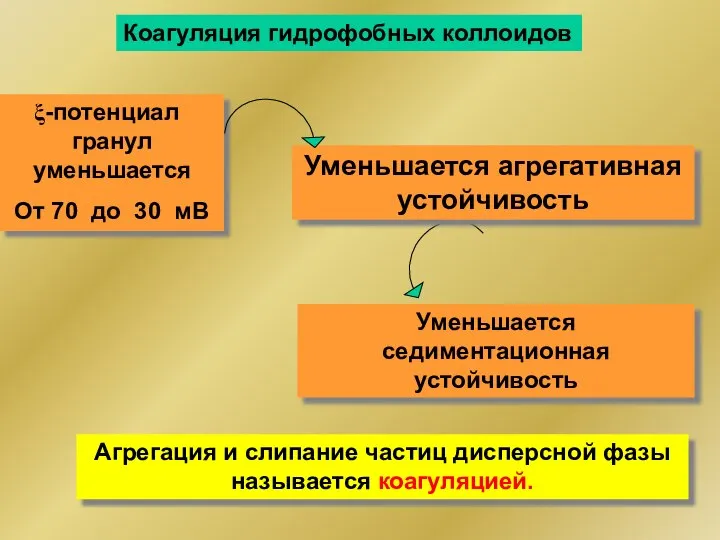
- 249. Агрегация и слипание частиц дисперсной фазы называется коагуляцией. Коагуляция гидрофобных коллоидов -потенциал гранул уменьшается От 70
- 250. Коагуляция Происходит самопроизвольно или под воздействием внешних факторов (изменение температуры, увеличение концентрации, действие ультразвука, электромагнитного поля,
- 251. Минимальное количество электролита (ммоль), вызывающее видимую коагуляцию литра золя, называется порогом коагуляции (Спк, ммоль/л) Электролитная коагуляция
- 252. Коагуляцию вызывает ион, заряд которого противоположен заряду гранулы Чем выше заряд коагулирующего иона, тем меньше его
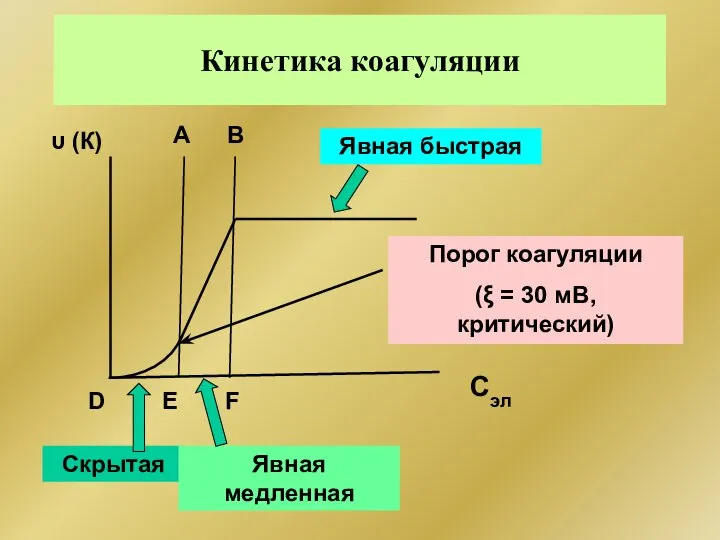
- 253. Кинетика коагуляции Сэл А В D E F Скрытая Явная медленная Явная быстрая Порог коагуляции (ξ
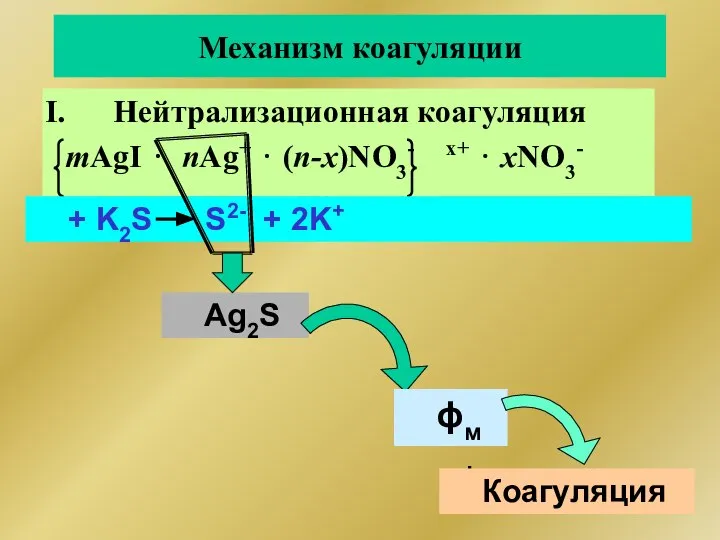
- 254. Механизм коагуляции Нейтрализационная коагуляция mAgI ⋅ nAg+ ⋅ (n-x)NO3- x+ ⋅ xNO3- + K2S S2- +
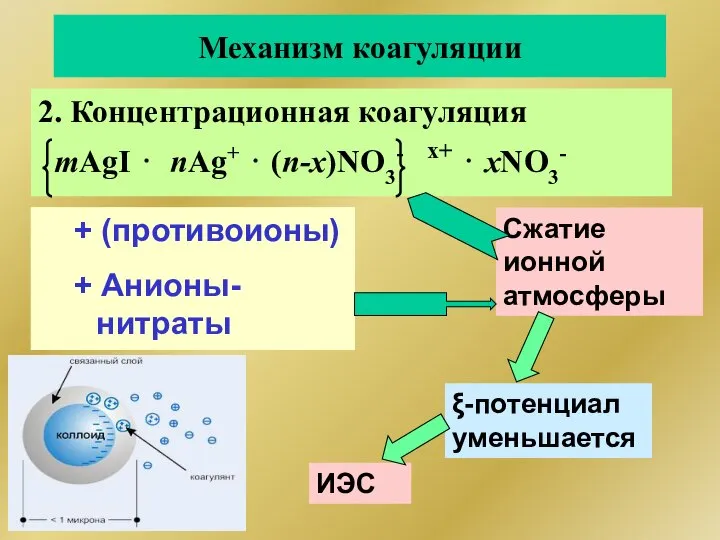
- 255. Механизм коагуляции 2. Концентрационная коагуляция mAgI ⋅ nAg+ ⋅ (n-x)NO3- x+ ⋅ xNO3- + (противоионы) +
- 256. Коагуляция смесями электролитов Аддитивность – суммирование коагулирующего действия ионов-коагулянтов. Ионы-коагулянты не взаимодействуют между собой. Антагонизм –
- 257. Коагуляция смесями электролитов Синергизм – усиление коагулирующего действия одного электролита в присутствии другого. Ионы-коагулянты взаимодействуют между
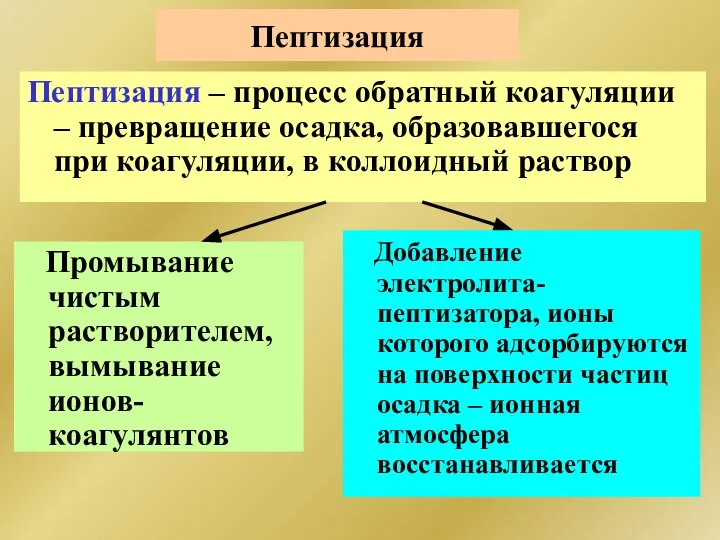
- 258. Пептизация Пептизация – процесс обратный коагуляции – превращение осадка, образовавшегося при коагуляции, в коллоидный раствор Промывание
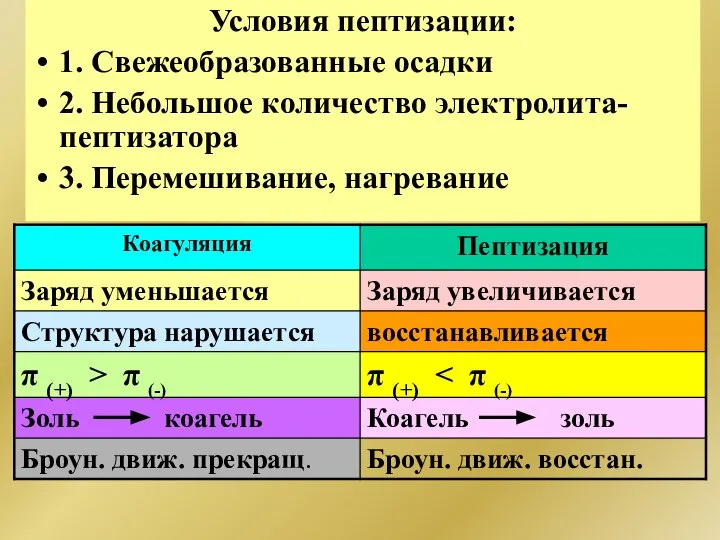
- 259. Условия пептизации: 1. Свежеобразованные осадки 2. Небольшое количество электролита-пептизатора 3. Перемешивание, нагревание
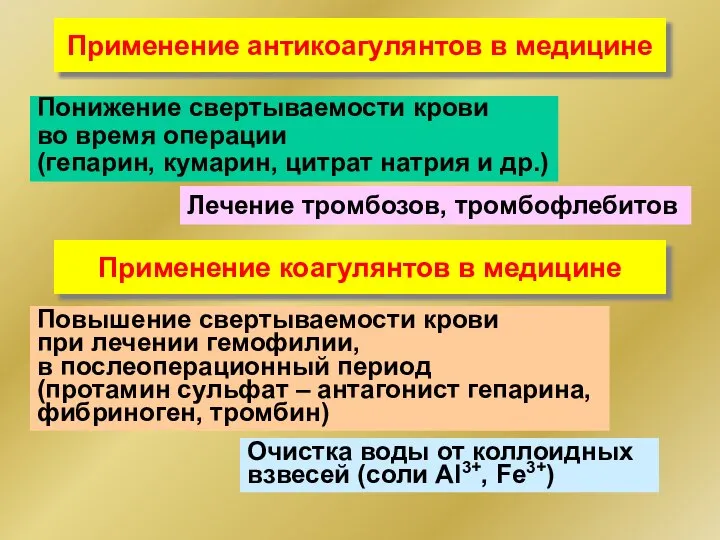
- 260. Применение антикоагулянтов в медицине Лечение тромбозов, тромбофлебитов Понижение свертываемости крови во время операции (гепарин, кумарин, цитрат
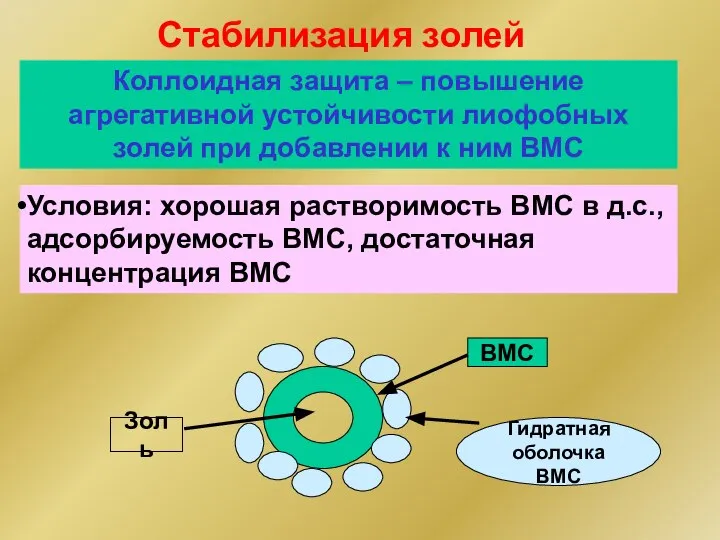
- 261. Условия: хорошая растворимость ВМС в д.с., адсорбируемость ВМС, достаточная концентрация ВМС Стабилизация золей Коллоидная защита –
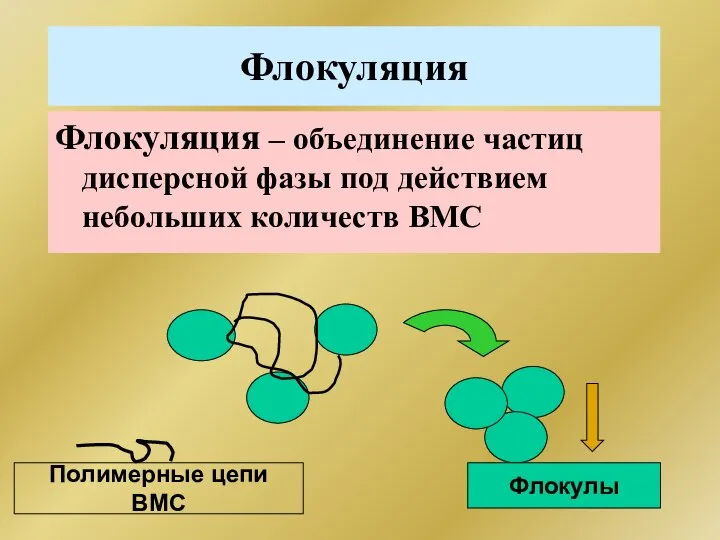
- 262. Флокуляция Флокуляция – объединение частиц дисперсной фазы под действием небольших количеств ВМС Полимерные цепи ВМС Флокулы
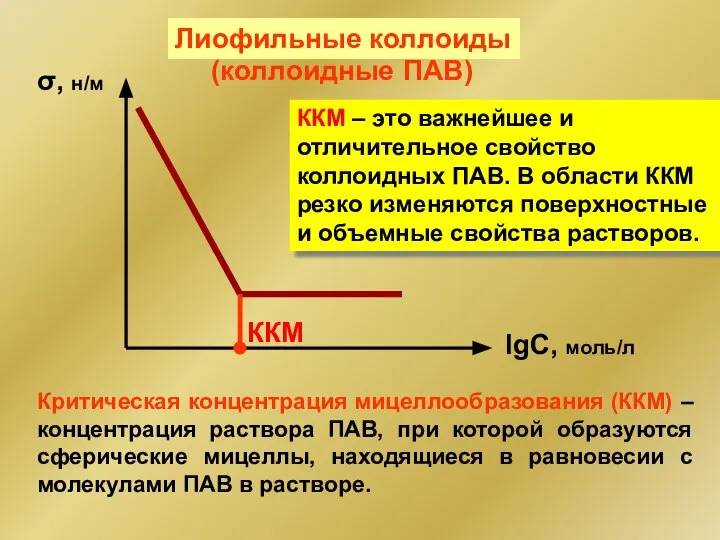
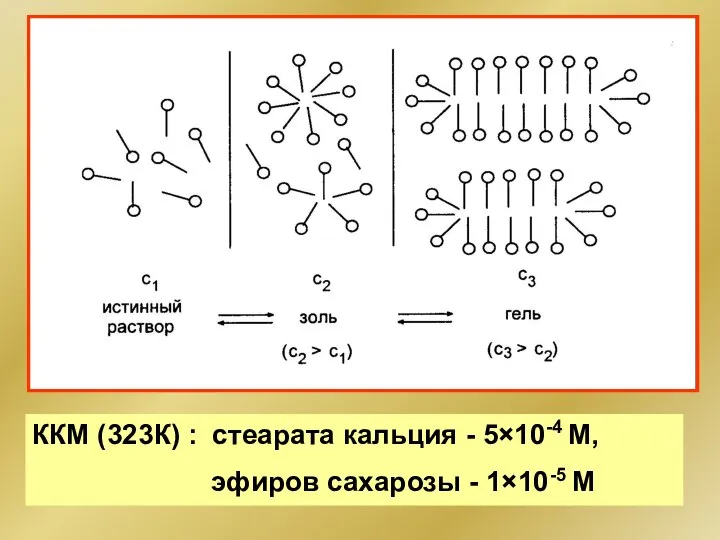
- 263. σ, н/м lgC, моль/л ККМ (коллоидные ПАВ) Лиофильные коллоиды Критическая концентрация мицеллообразования (ККМ) – концентрация раствора
- 264. ККМ: 10-4 – 10-5 М неионогенные ПАВ 10-2 – 10-3 М ионогенные ПАВ 10 -8 –
- 265. ККМ (323К) : стеарата кальция - 5×10-4 М, эфиров сахарозы - 1×10-5 М
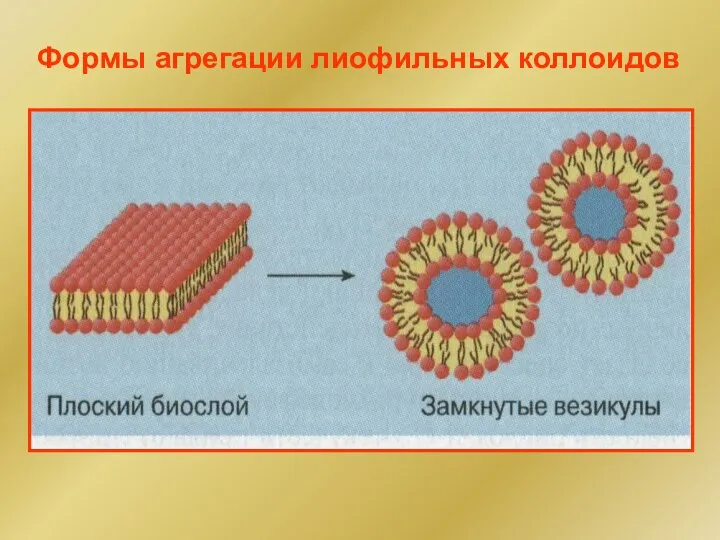
- 266. Формы агрегации лиофильных коллоидов
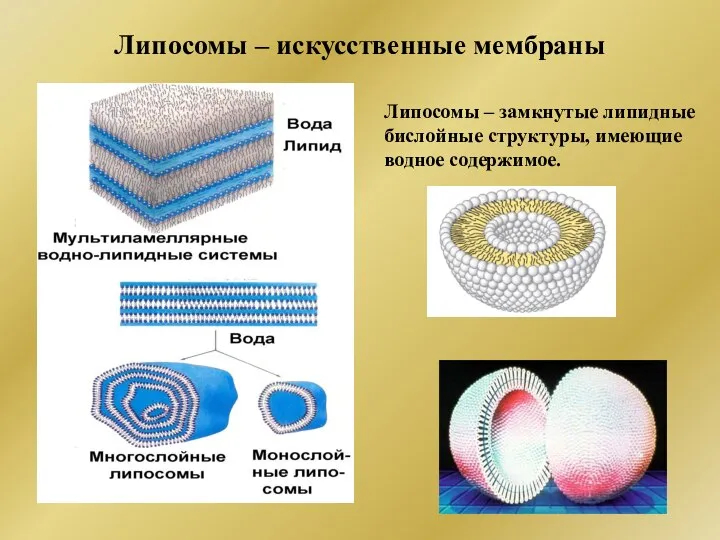
- 267. Липосомы – искусственные мембраны Липосомы – замкнутые липидные бислойные структуры, имеющие водное содержимое.
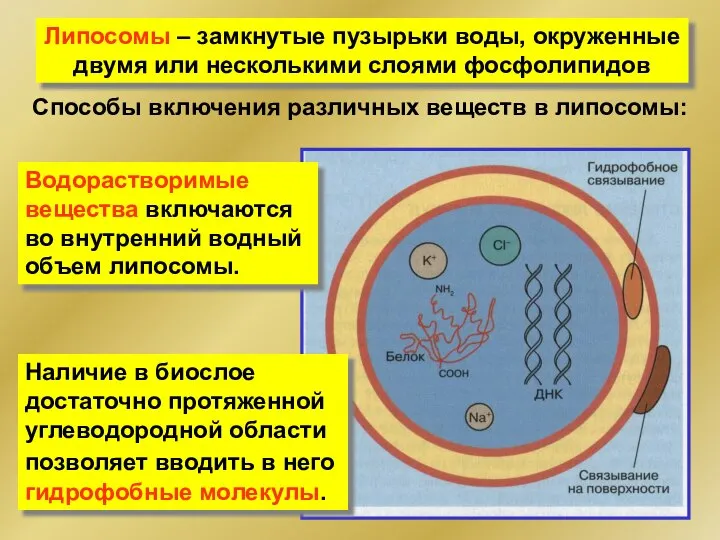
- 268. Липосомы – замкнутые пузырьки воды, окруженные двумя или несколькими слоями фосфолипидов Способы включения различных веществ в
- 269. Использование липосом 1. Модельные системы (включение белков и др.). 2. Средства доставки БАС (ДНК, олигонуклеотиды, белки,
- 270. Липосомы - средства доставки БАС Липосомы как средства микрокапсулирования БАС должны удовлетворять следующим требованиям: биологическая совместимость
- 271. Липосомы - средства доставки БАС Липосомы как средства микрокапсулирования БАС должны удовлетворять следующим требованиям: способность эффективно
- 272. Липосомальная терапия применяется при лечении онкологических, инфекционных заболеваний, диабета и ряда др. ИТАК: Липосомы – 1)
- 273. Получение – самопроизвольно при ККМ Лиофильные коллоиды Свойства: Устойчивость, мощная сольватная оболочка, динамичность МКС и оптические
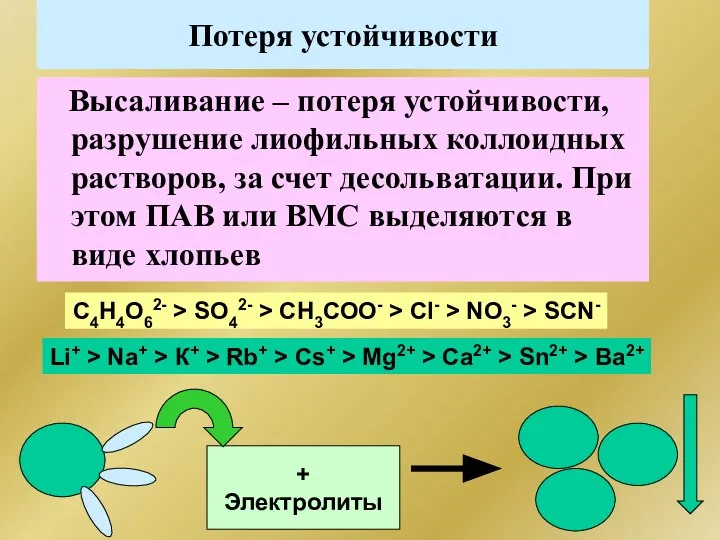
- 274. Потеря устойчивости Высаливание – потеря устойчивости, разрушение лиофильных коллоидных растворов, за счет десольватации. При этом ПАВ
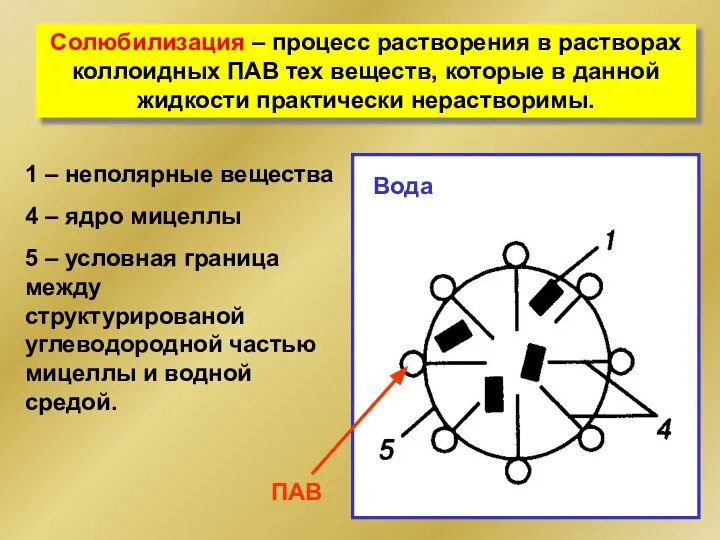
- 275. Солюбилизация – процесс растворения в растворах коллоидных ПАВ тех веществ, которые в данной жидкости практически нерастворимы.
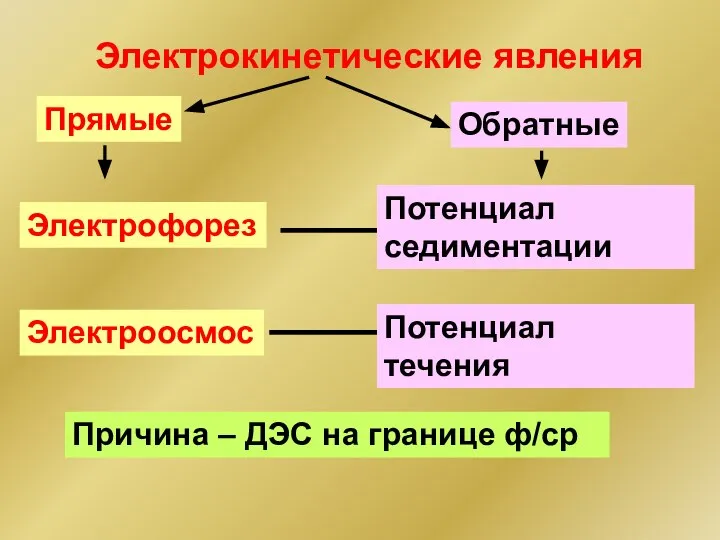
- 276. Электрокинетические явления Прямые Обратные Электроосмос Потенциал седиментации Электрофорез Потенциал течения Причина – ДЭС на границе ф/ср
- 277. Электрофорез – движение частиц дисперсной фазы под действием внешнего электрического поля. Электрокинетические явления Лекарственный электрофорез –
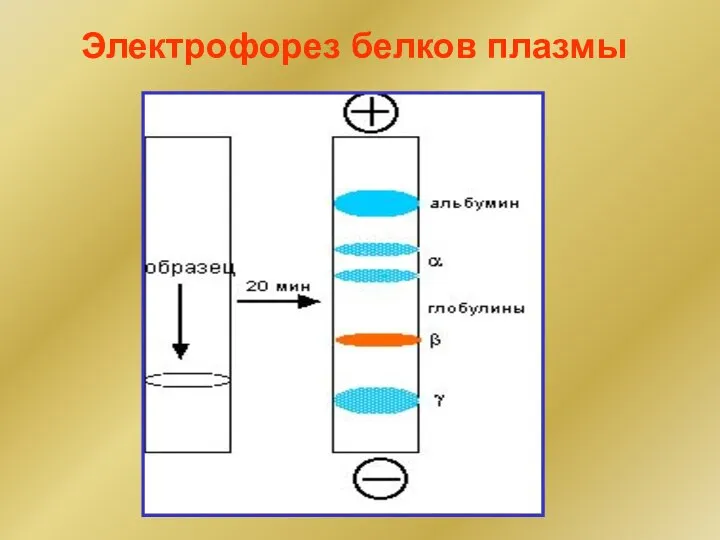
- 278. Электрофорез белков плазмы
- 279. ЭЛЕКТРОФОРЕЗ
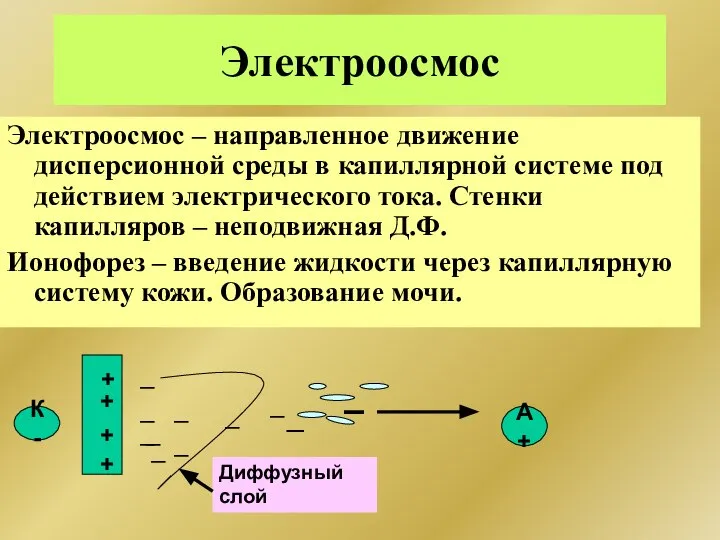
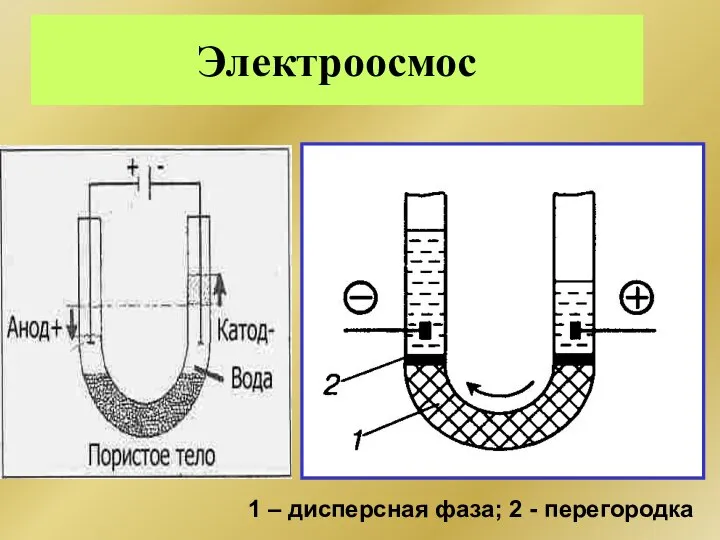
- 280. Электроосмос Электроосмос – направленное движение дисперсионной среды в капиллярной системе под действием электрического тока. Стенки капилляров
- 281. Электроосмос 1 – дисперсная фаза; 2 - перегородка
- 282. Электрокинетические явления Ф. Pейсс (1807) [mSiO2nSiO32- 2(n-x)Na+]2x- 2xNa+ гранула линия скольжения
- 283. Потенциалы седиментации и течения Потенциал оседания (эффект ДОРНА) - возникновение разности потенциалов при движении частиц в
- 284. Растворы ВМС Имплантанты (для коленных, плечевых, тазобедренных суставов) Природные ВМС – белки, полисахариды, нуклеиновые кислоты, каучук
- 285. Белки Белки выполняют в клетке ряд важнейших функций: Структурная 2. Каталитическая 3. Защитная 4. Регуляторная 5.
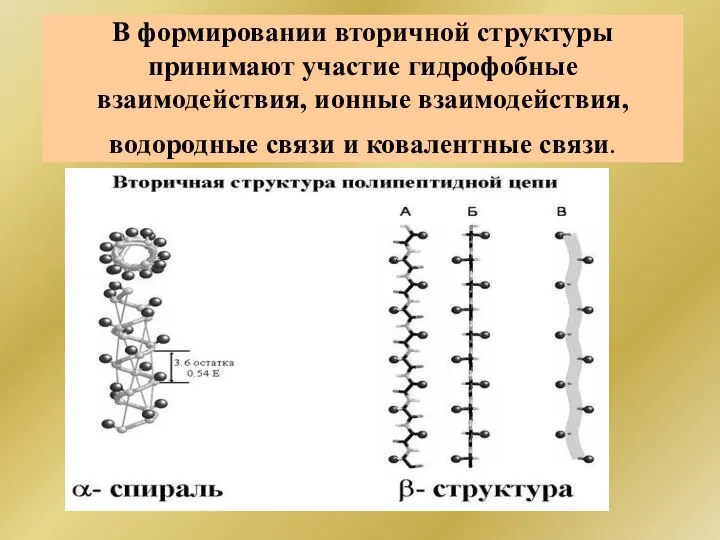
- 286. В формировании вторичной структуры принимают участие гидрофобные взаимодействия, ионные взаимодействия, водородные связи и ковалентные связи.
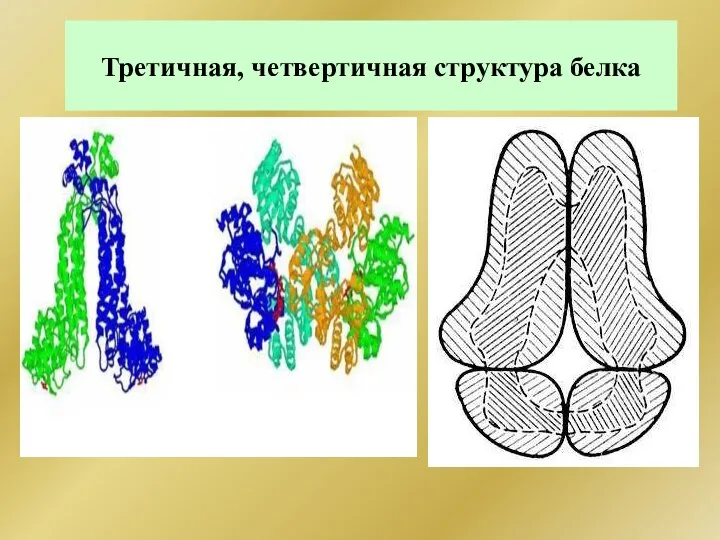
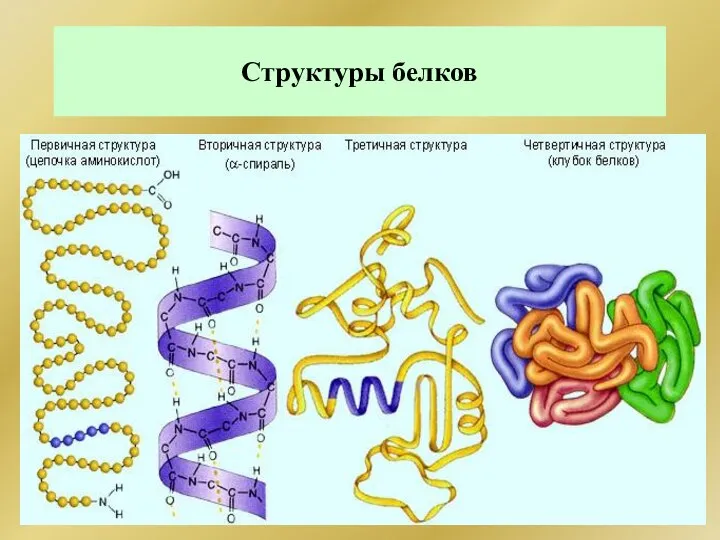
- 287. Третичная, четвертичная структура белка
- 288. Структуры белков
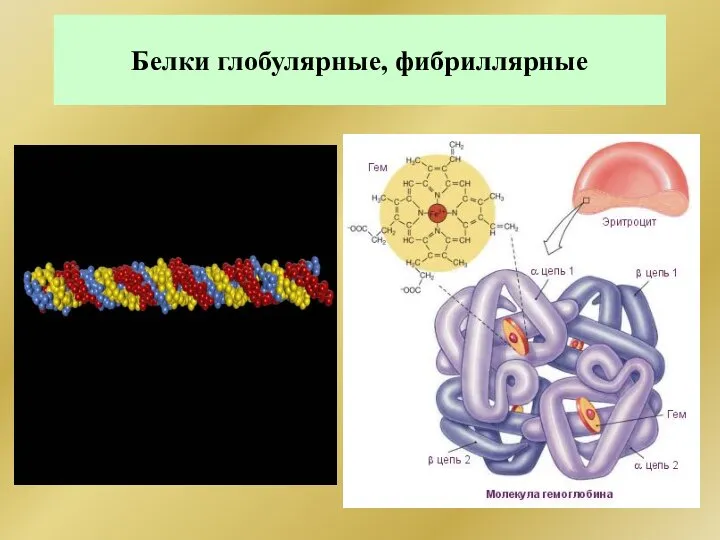
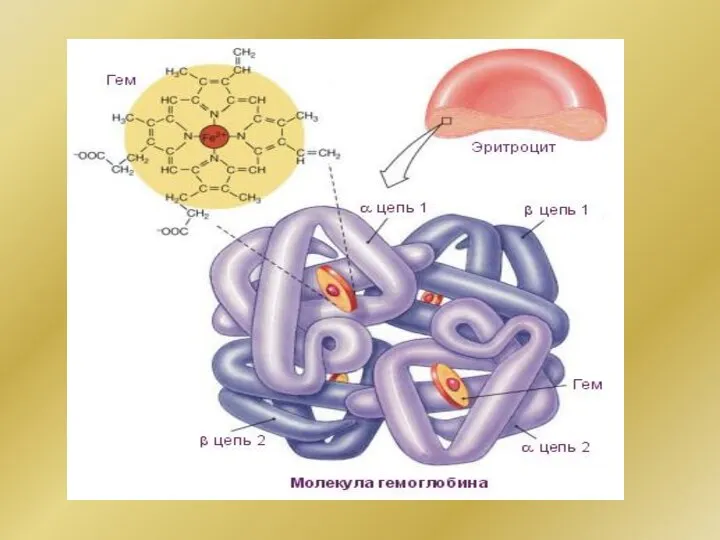
- 289. Белки глобулярные, фибриллярные
- 291. Свойства белков Кислотно-основные Окислительно-восстановительные Комплексообразующие Поверхностно-активные Поверхностноактивные: ПАВ, эмульгаторы жиров, стабилизаторы лиофобных систем, образуют мицеллы с
- 292. Комплексообразующие свойства: Белки – активные лиганды, образуют комплексы с биометаллами и металлами-токсикантами ОВ- свойства: Мягкое окисление
- 293. Кислотно-основные свойства КО-свойства зависят от состава белков: R – СООН R -COOH R - COOH NH2
- 294. R-COOH OH- NH2 0 рН = рI 0 + H2O R-COO- NН3+ 0 +3HN- R- COO-
- 295. +3HN-R-COO▬ OH- NH3+ 0 рН = рI 0 + OH▬ 2HN- R-COO─ NН3+ 0 2HN- R-
- 296. H+ H2O ─ООС-R-COO─ NН3+ OH- ─ООС- R- COO─ NH3+ ─ООС- R- COOН NH3+ 0 ▬ ─ООС-
- 297. Изоэлектрические точки различных белков Белок ИЭТ Казеин 4,6 Желатин 4,7 Альбумин яйца 4,8 Гемоглобин 6,8 Глобулин
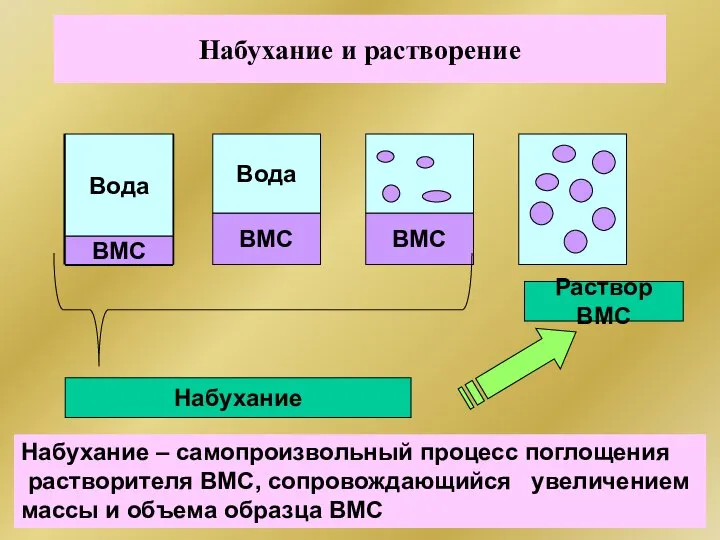
- 298. Набухание и растворение ВМС Вода Вода ВМС ВМС Раствор ВМС Набухание Набухание – самопроизвольный процесс поглощения
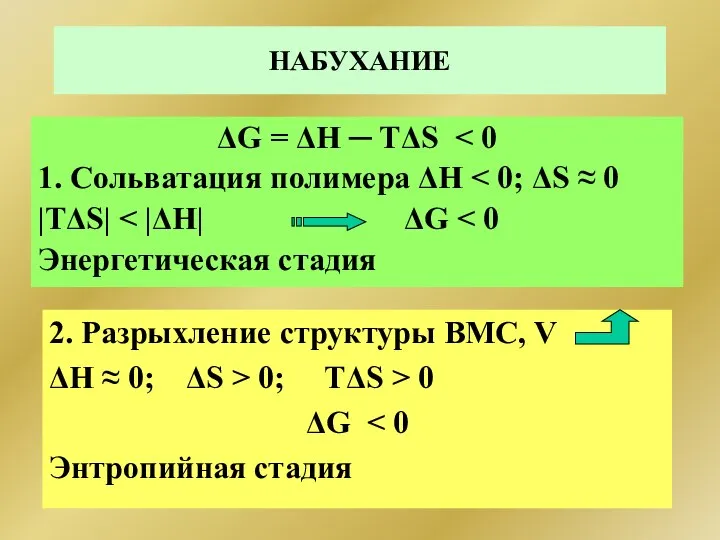
- 299. НАБУХАНИЕ ΔG = ΔH ─ TΔS 1. Сольватация полимера ΔН |TΔS| Энергетическая стадия 2. Разрыхление структуры
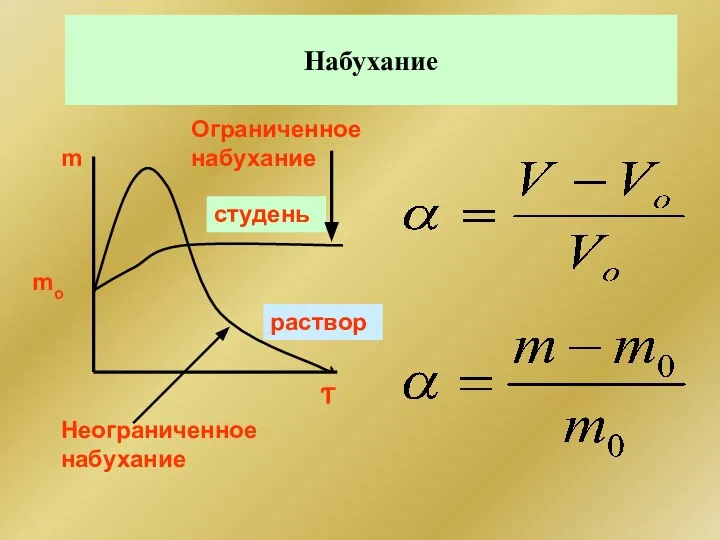
- 300. Набухание студень Ƭ m mo Ограниченное набухание Неограниченное набухание раствор
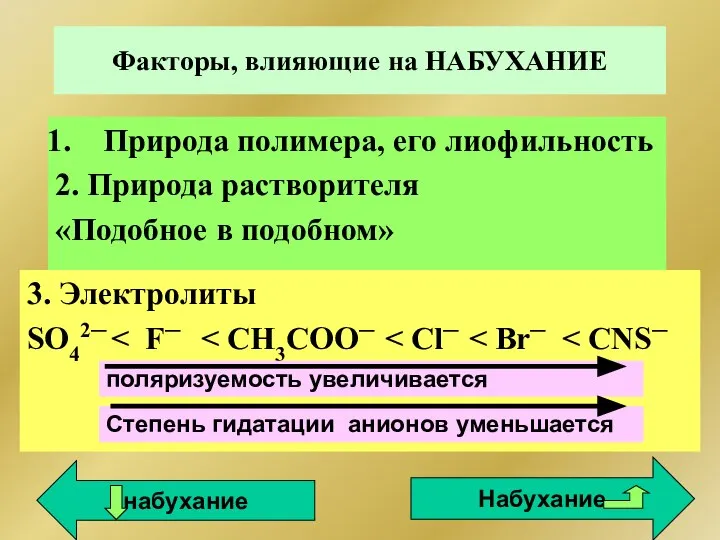
- 301. Факторы, влияющие на НАБУХАНИЕ Природа полимера, его лиофильность 2. Природа растворителя «Подобное в подобном» 3. Электролиты
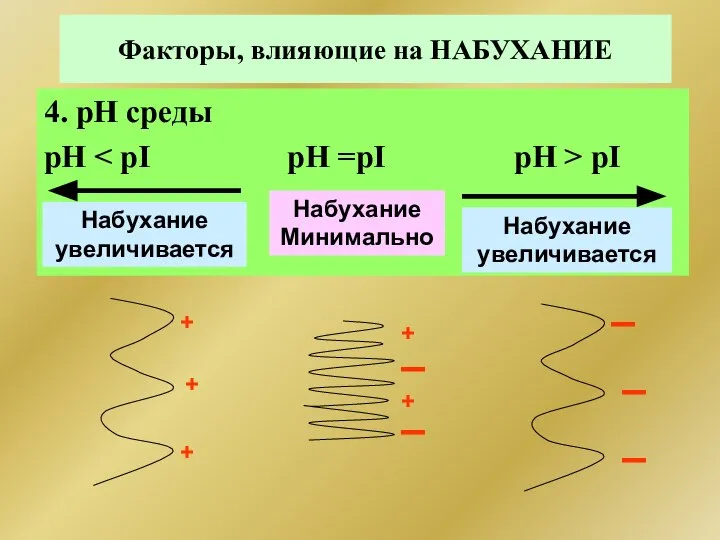
- 302. Факторы, влияющие на НАБУХАНИЕ 4. рН среды рН pI Набухание Минимально Набухание увеличивается Набухание увеличивается ▬
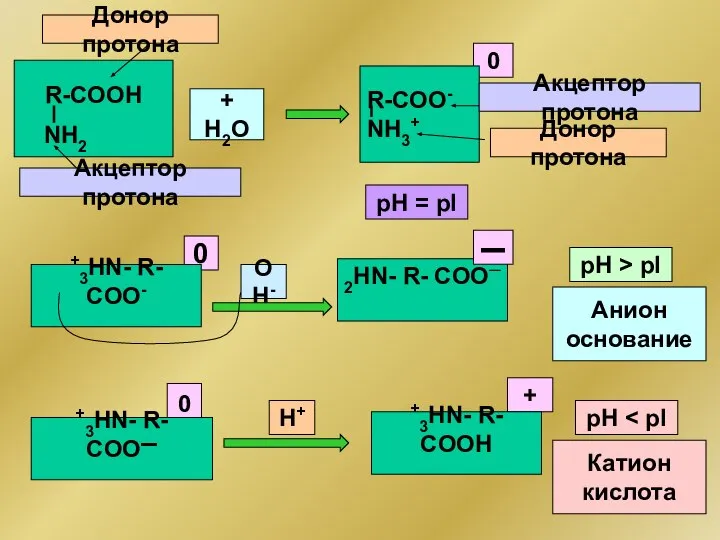
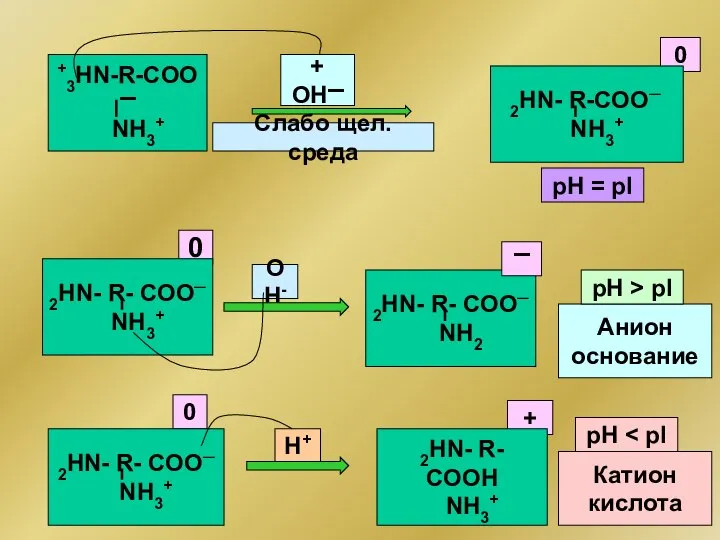
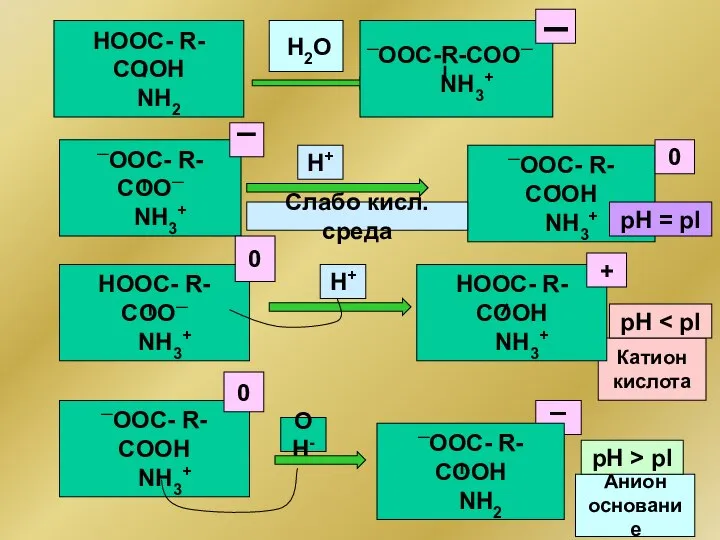
- 303. Факторы, влияющие на НАБУХАНИЕ 5. Возраст биополимера Способность к набуханию уменьшается 6. Температура t° набухание
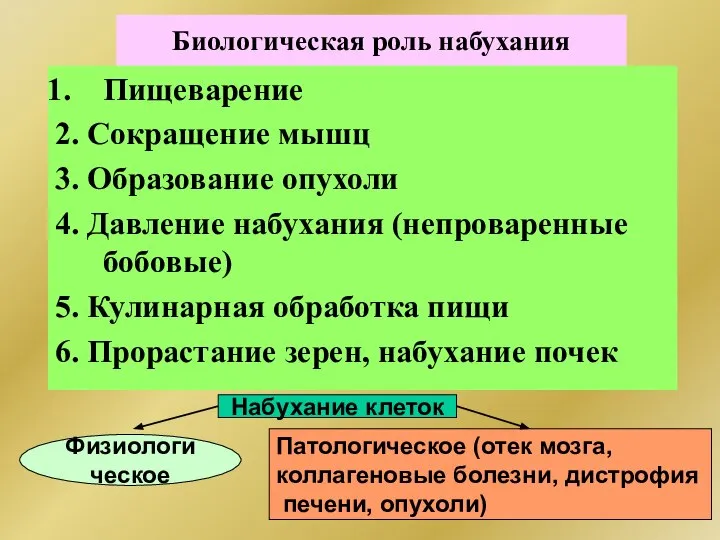
- 304. Биологическая роль набухания Пищеварение 2. Сокращение мышц 3. Образование опухоли 4. Давление набухания (непроваренные бобовые) 5.
- 305. Вязкость За счет сил взаимодействия между молекулами реальной жидкости при ее течении возникают силы трения, которые
- 306. Вязкость где S - площадь соприкосновения движущихся слоев жидкости, dv/dx - градиент скорости. Коэффициент η, зависящий
- 307. КРОВЬ – неньютоновская жидкость Вязкость воды при температуре 20°С составляет 1мПа.c, а вязкость крови в норме
- 308. Вязкость Движение крови в организме, в основном, ламинарно. Турбулентности могут возникать в полостях сердца, в крупных
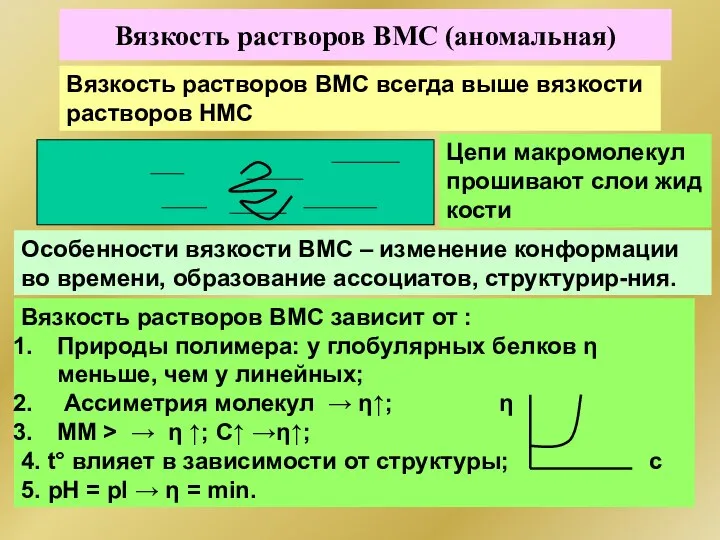
- 309. Вязкость растворов ВМС (аномальная) Вязкость растворов ВМС всегда выше вязкости растворов НМС Особенности вязкости ВМС –
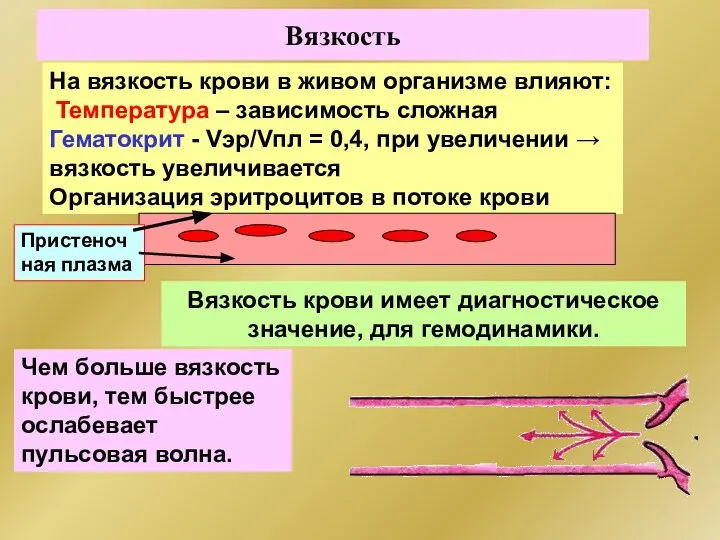
- 310. Вязкость На вязкость крови в живом организме влияют: Температура – зависимость сложная Гематокрит - Vэр/Vпл =
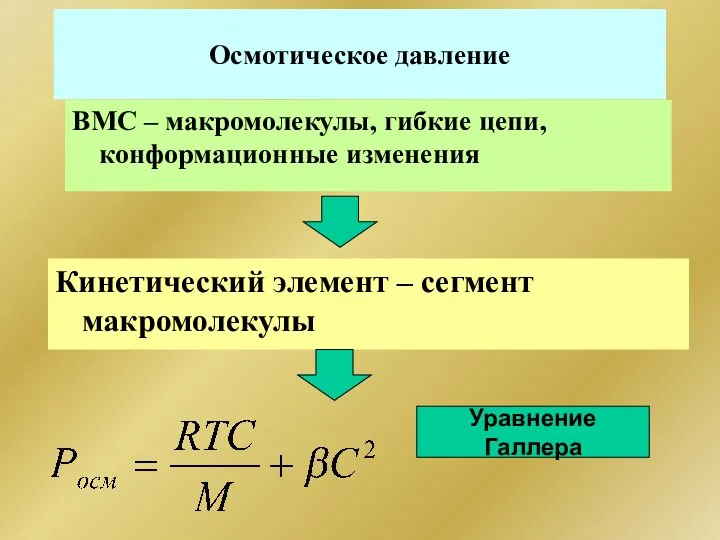
- 311. Осмотическое давление ВМС – макромолекулы, гибкие цепи, конформационные изменения Кинетический элемент – сегмент макромолекулы Уравнение Галлера
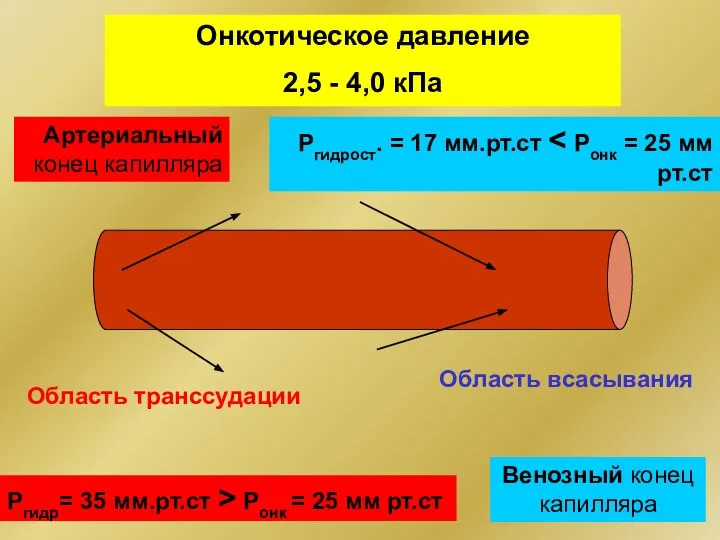
- 312. Онкотическое давление 2,5 - 4,0 кПа Артериальный конец капилляра Венозный конец капилляра Ргидр= 35 мм.рт.ст >
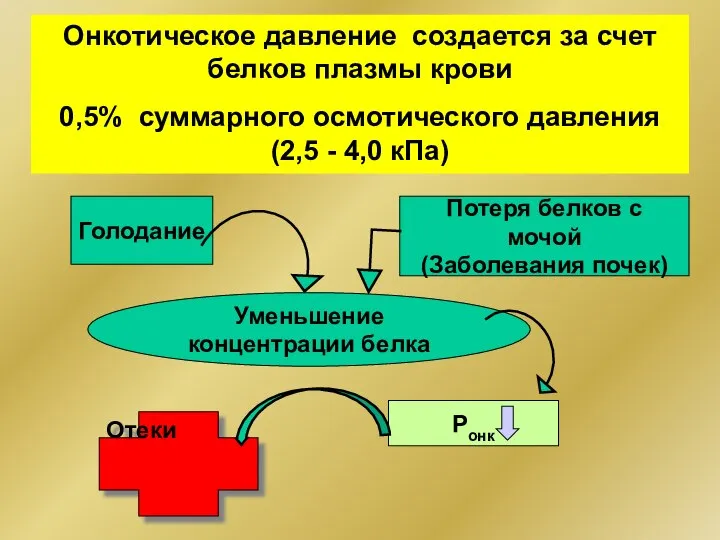
- 313. Онкотическое давление создается за счет белков плазмы крови 0,5% суммарного осмотического давления (2,5 - 4,0 кПа)
- 314. Мембранное равновесие Доннана Равновесие, устанавливающееся в системе растворов, разделенных полупроницаемой мембраной при условии равенства произведения концентраций
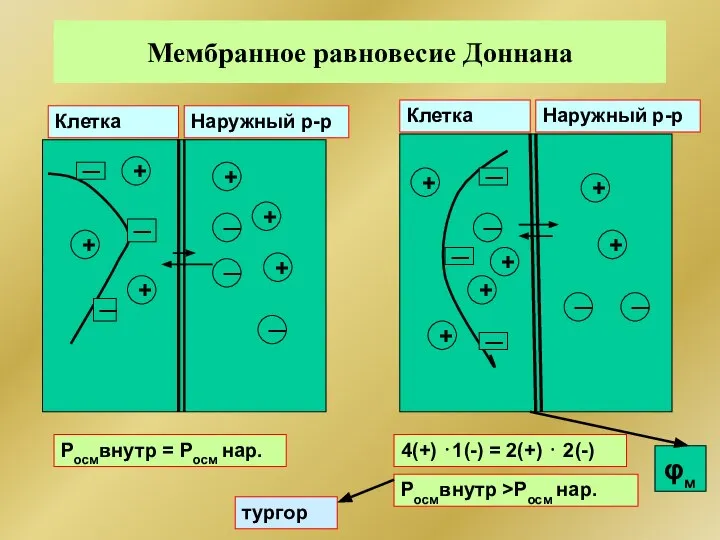
- 315. Мембранное равновесие Доннана Клетка Наружный р-р Наружный р-р Клетка ─ ─ ─ ─ ─ ─ +
- 316. Уравнение Доннана
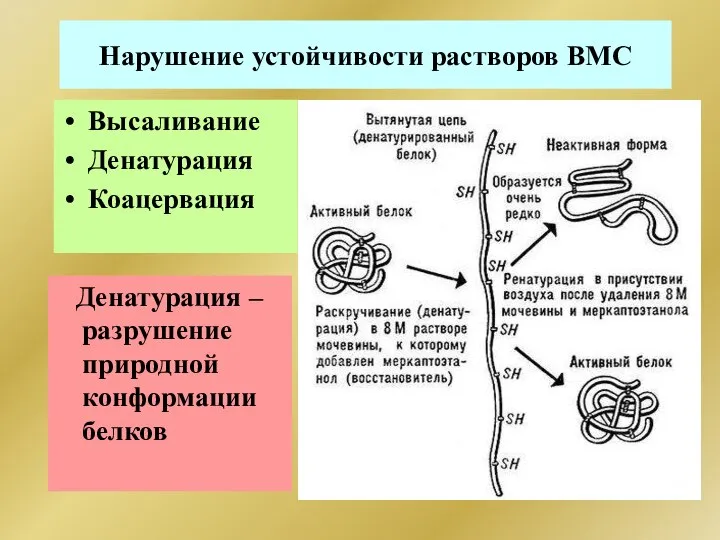
- 317. Нарушение устойчивости растворов ВМС Высаливание Денатурация Коацервация Денатурация –разрушение природной конформации белков
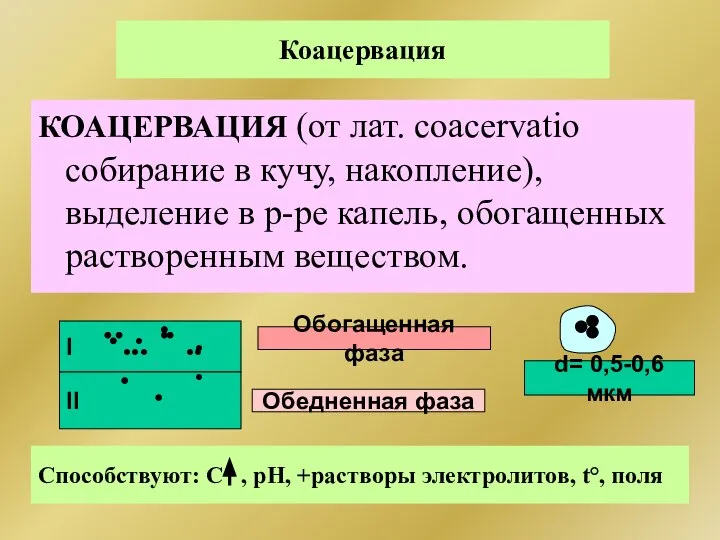
- 318. Коацервация КОАЦЕРВАЦИЯ (от лат. coacervatio собирание в кучу, накопление), выделение в р-ре капель, обогащенных растворенным веществом.
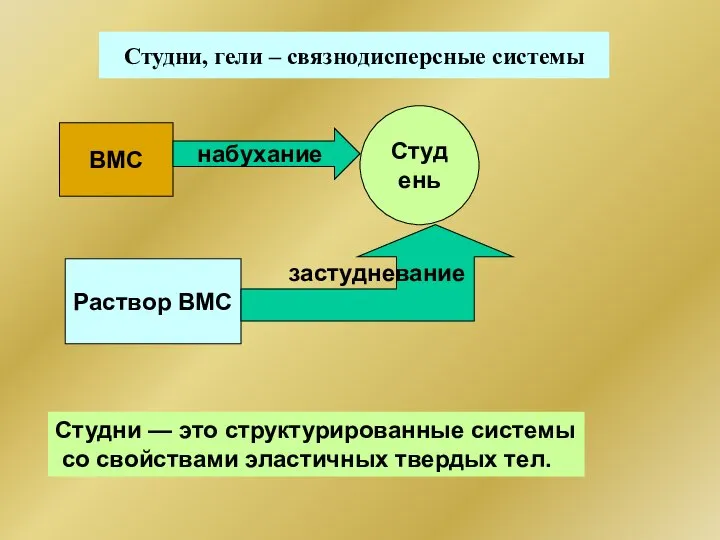
- 319. Студни, гели – связнодисперсные системы ВМС набухание Студень Студни — это структурированные системы со свойствами эластичных
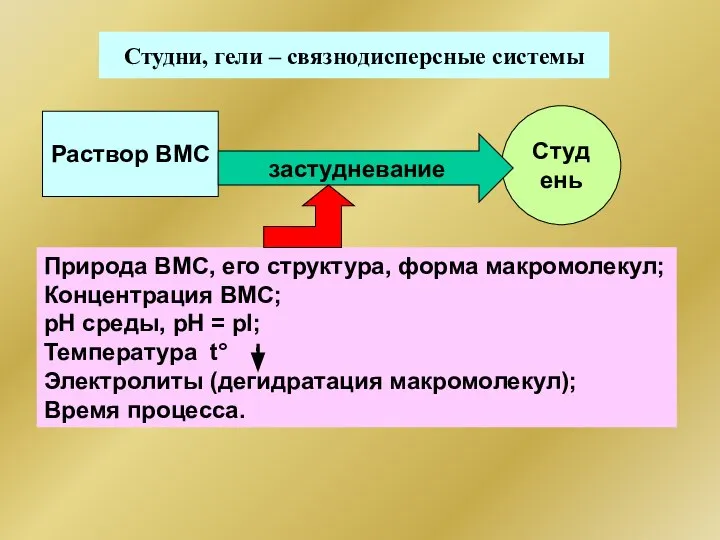
- 320. Студни, гели – связнодисперсные системы Студень Природа ВМС, его структура, форма макромолекул; Концентрация ВМС; рН среды,
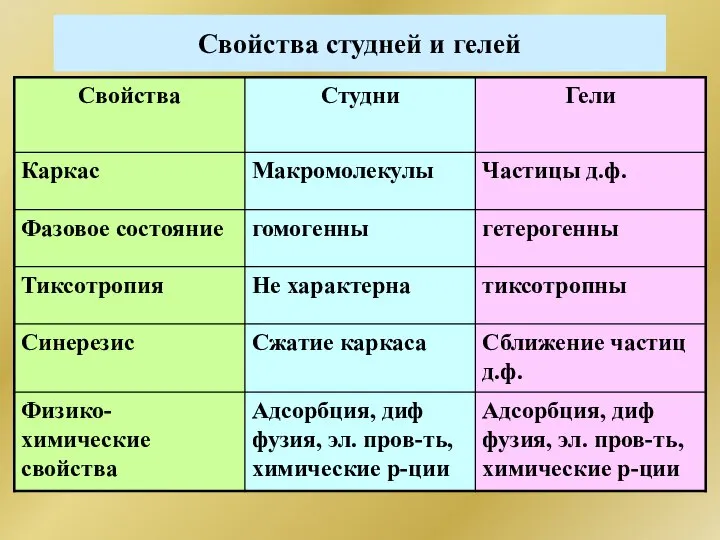
- 321. Свойства студней и гелей
- 323. Скачать презентацию



























![Ферментативный катализ Условия: рН, температурный оптимум Белковая природа Размер 10-5-10-7 м Высокая активность υ Кинетика [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-47.jpg)
![Химическое равновесие υ → = υ ← k →[A]a [B]b =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-51.jpg)
























![Уравнение буферных систем (Гендерсона-Хассельбаха) [H+] = Ka ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-89.jpg)


![Гетерогенные процессы и равновесия BaSO4 Осадок (тв) раствор (ионы) Kравн Kравн·[BaSO4]=Ks(ПР)= [Ba2+]·[SO42-] Раствор Ba2+ + SO42–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-104.jpg)



![Са5(РO4)3ОН(тв) 5Са2+(р-р) + + 3РО43–(р-р) + ОН–(р-р) [Ca2+] = 5s [PO43–]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-108.jpg)
![Гетерогенные равновесия Совмещенные(конкурирующие) AgCl(тв) Ag+(р-р)+ Cl-(р-р) Ag+(р-р)+ 2NH3 [Ag(NH3)2]+ Mg(OH)2 (тв)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-111.jpg)












![Fe (CN) 6 [ ] III K3 комплексообразователь число лигандов лиганд](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-152.jpg)

![К.ч. = числу лигандов, если лиганд монодентатный, например, H2[CuCl4] К.ч. ≠](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-160.jpg)
![Заряд I+ II+ III+ IV+ К. ч. Пример [Ag(NH3)2]Cl K2[HgI4], K4[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-161.jpg)
![Ag+ …4d10 d 4 5 .. .. sp-гибридизация [AgCN2] - Строение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-162.jpg)
![[NiCl4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-164.jpg)
![Ni2+ = …3d84s0 d 3 4 .. .. .. .. sp2d-гибридизация [Ni(CN)4]2- Диамагнитный квадратный комплекс](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-165.jpg)
![[Ni(CN)4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-166.jpg)
![Транс-[Pt(NH3)2Cl2] Цис-[Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-167.jpg)
![[Fe(H2O)6]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-169.jpg)
![Изолированные [Cu(NH3)4]SO4 Равновесия в растворах комплексных соединений [Сu(NH3)4]2+ + SO42- Первичная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-172.jpg)
![Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за лиганд [Сu(NH3)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-173.jpg)
![Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за комплексообразователь [Сu(NH3)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-174.jpg)















































![Электрокинетические явления Ф. Pейсс (1807) [mSiO2nSiO32- 2(n-x)Na+]2x- 2xNa+ гранула линия скольжения](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/697381/slide-281.jpg)














 Синтез этилацетата в условиях сверхвысокочастотного облучения
Синтез этилацетата в условиях сверхвысокочастотного облучения Вода и растворы. Лекция 3
Вода и растворы. Лекция 3 Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания. Муниципальное об
Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания. Муниципальное об «Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т
«Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т Оксиды. Определение, состав, номенклатура, классификация и структурные формулы
Оксиды. Определение, состав, номенклатура, классификация и структурные формулы Презентация по Химии "Белки" - скачать смотреть _
Презентация по Химии "Белки" - скачать смотреть _ Молекулярные базы данных. Принцип действия и характеристики основных компьютерных программ
Молекулярные базы данных. Принцип действия и характеристики основных компьютерных программ Топливо и его характеристики
Топливо и его характеристики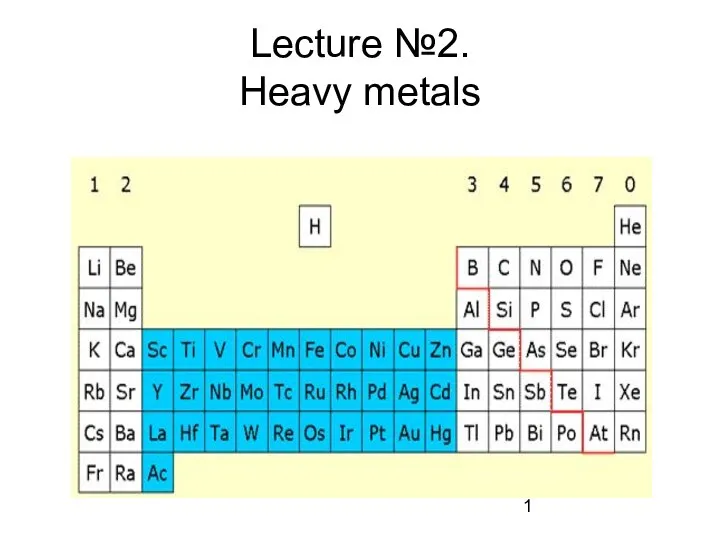 Heavy metals
Heavy metals Федотова Елена Анатольевна – учитель химии
Федотова Елена Анатольевна – учитель химии  Краски. Виды красок
Краски. Виды красок Исследование остаточной концентрации моющих средств на посуде
Исследование остаточной концентрации моющих средств на посуде Биохимия как наука
Биохимия как наука Натрий. Роль натрия в организме
Натрий. Роль натрия в организме Способы получения полимеров (Лекция 3)
Способы получения полимеров (Лекция 3) Электролиз. Удивительный мир гальваники Выполнила: Степанова Анастасия Преподаватель: Степанова О.Э.
Электролиз. Удивительный мир гальваники Выполнила: Степанова Анастасия Преподаватель: Степанова О.Э. Химия, как часть естествознания. Предмет химии
Химия, как часть естествознания. Предмет химии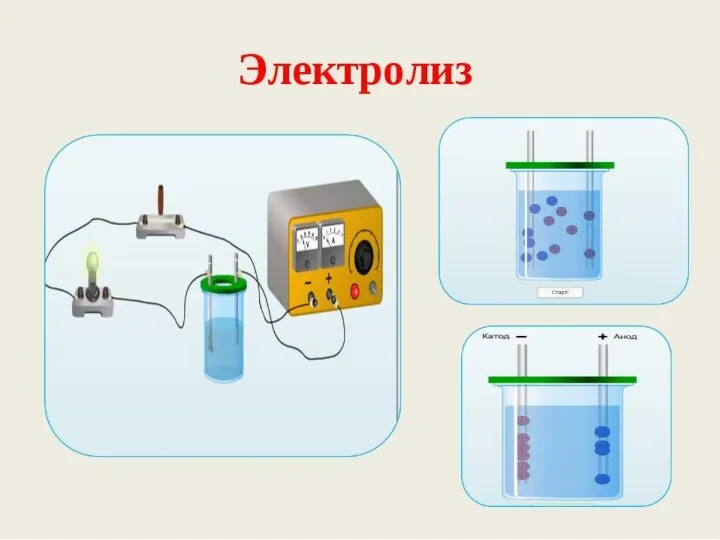 Электролиз
Электролиз Структурная механика композитов. Композитный монослой
Структурная механика композитов. Композитный монослой Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Галогены
Галогены Зелена хімія
Зелена хімія Спирти. Одноатомні насичені спирти (алканоли)
Спирти. Одноатомні насичені спирти (алканоли) Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 Химическая посуда и её назначение (3)
Химическая посуда и её назначение (3) Исследовательская работа «Волшебная соль»
Исследовательская работа «Волшебная соль» Серная кислота
Серная кислота