Содержание
- 2. План лекции: Применение реакций комплексообразования в аналитической химии и медицине Количественное описание реакций комплексообразования. Состав растворов
- 3. Применение реакций комплексообразования в аналитической химии и медицине: В качественном анализе. Маскирование. В титриметрическом анализе. В
- 4. Например, некоторые комплексоны применяют как консерванты при хранении крови и для выведения из организма ионов токсичных
- 5. Комплексом называется устойчивая в растворе частица, которая состоит из комплексообразователя (центрального атома) – катиона металла и
- 6. Лиганды, содержащие два или более донорных атомов, называются полидентатными лигандами. Многие комплексные соединения, содержащие полидентатные лиганды,
- 7. Количественное описание реакций комплексообразования: (1) (2) (n) где Кn - ступенчатые константы устойчивости.
- 8. Суммарные (общие) константы устойчивости - β:
- 9. В справочной литературе приводятся значения Тогда ступенчатые константы рассчитывают: или Часто используются константы нестойкости (Кнест): или
- 10. Задача. Вычислить концентрацию ионов комплексообразователя и лиганда в 1 моль/л растворе [Ag(NH3)2]Cl, если Кнест = 6,8∙10-8.
- 11. Ответ:
- 12. Задача. Произойдет ли разрушение комплекса и выпадает ли осадок AgI, если к к 0,01 М раствору
- 13. Вычислим концентрацию ионов серебра, которая образуется при диссоциации [Ag(CN)2]-: [Ag(CN)2]- = Ag+ + 2CN- х 2х
- 14. Осадок образуется, если ионное произведение больше ПР(осадка). Тогда ионное произведение (ИП) вычисляется по формуле: ИП =
- 15. Состав растворов при ступенчатом комплексообразовании сложен, т.к. в растворе присутствуют сразу несколько комплексов. Основной фактор, который
- 16. Количественный состав раствора в реакциях комплексообразования описывается: 1. молярными долями всех компонентов в растворе
- 17. 2. функцией закомплексованности, которая меняется от 1 (в отсутствие комплексообразователя) до (при полном связывании металлов в
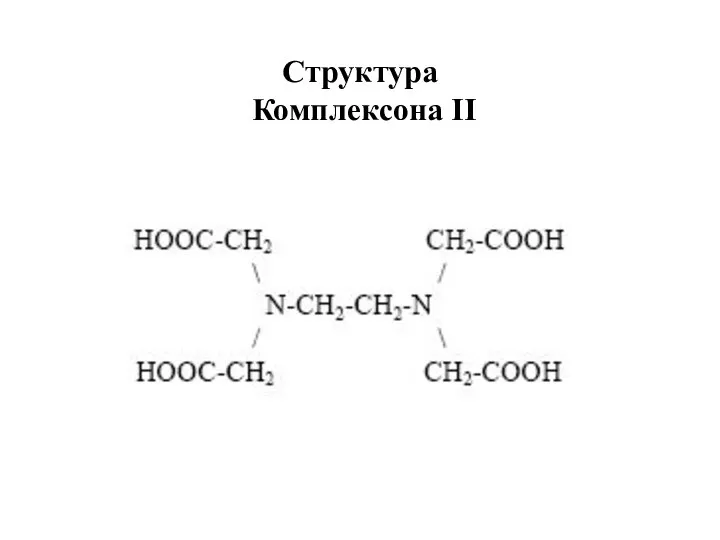
- 18. Структура Комплексона II
- 19. ЭДТА (Комплексон III, Трилон Б) Na2H2Y ∙ 2H2O ЭДТА - слабая четырехосновная кислота: pK1 = 2.0
- 20. Протолитические свойства ЭДТА Для представления формулы ЭДТА и ее ионов часто используют сокращения H4Y, H3Y-, H2Y2−,
- 21. Химизм взаимодействия ЭДТА с катионами металлов: Уравнение взаимодействия ЭДТА с магния хлоридом: MgCl2 + Na2H2Y =
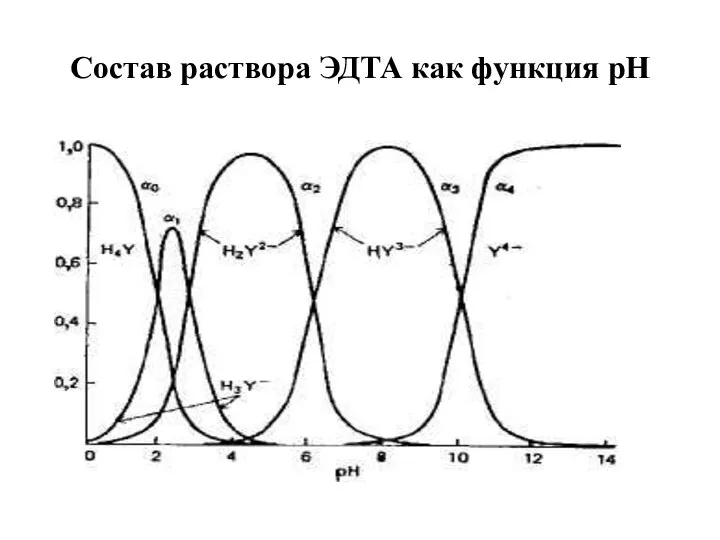
- 22. Состав раствора ЭДТА как функция рН
- 23. Очевидно, что H2Y2− является доминирующей формой в умеренно кислой среде (рН = 3-6). В интервале рН
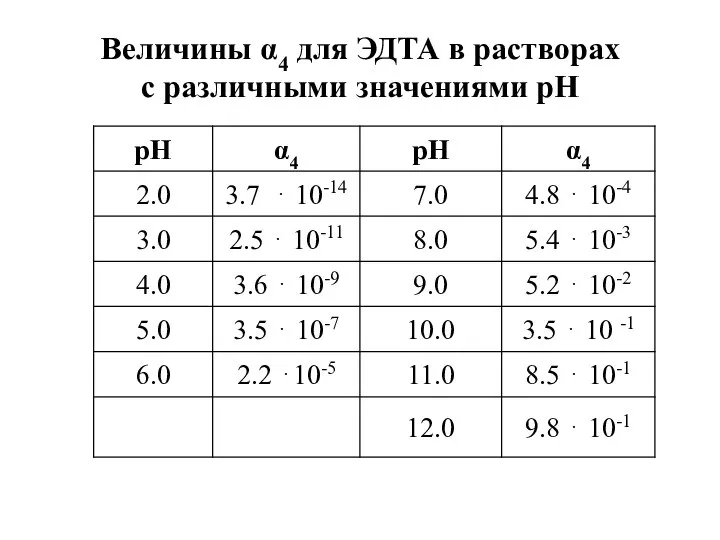
- 24. Величины α4 для ЭДТА в растворах с различными значениями рН
- 25. Чтобы учесть влияние рН на образование комплексоната металла, используют условную константу устойчивости. Например, Mn+ + Y4-
- 26. Тогда, β′ - условная константа будет равна: β′ = β ∙ α(Y4-) = Условная константа описывает
- 28. Скачать презентацию









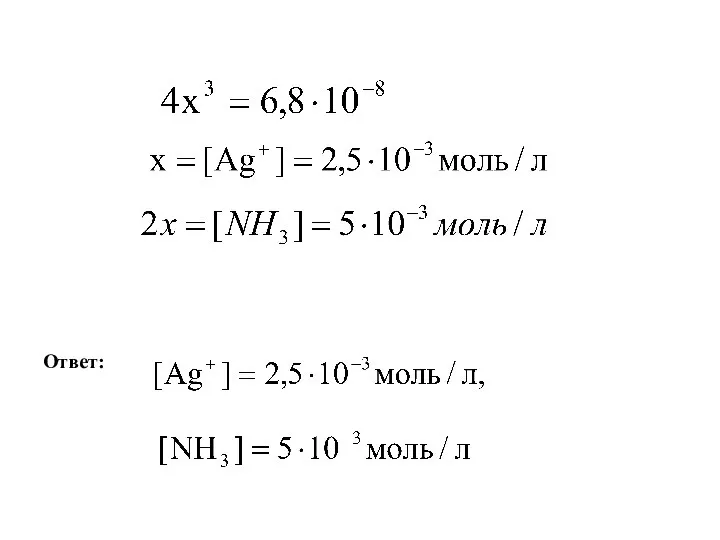

![Вычислим концентрацию ионов серебра, которая образуется при диссоциации [Ag(CN)2]-: [Ag(CN)2]- =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1196385/slide-12.jpg)










 Обобщение сведений об основных классах неорганических веществ
Обобщение сведений об основных классах неорганических веществ Биогенные p-элементы
Биогенные p-элементы Лавсан (полиэтилентерефталат)
Лавсан (полиэтилентерефталат) Массообменные процессы
Массообменные процессы Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА
Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА ООО «Ангарский Азотно-туковый завод». Основы производства аммиака
ООО «Ангарский Азотно-туковый завод». Основы производства аммиака Аттестаионная работа. Сахар. Изучаем и исследуем
Аттестаионная работа. Сахар. Изучаем и исследуем Периодический закон и строение атома
Периодический закон и строение атома Общая характеристика элементов 1 группы главной подгруппы
Общая характеристика элементов 1 группы главной подгруппы Классификация смесевой химической продукции
Классификация смесевой химической продукции Каучуки. Природний каучук, гума, синтетичний каучук
Каучуки. Природний каучук, гума, синтетичний каучук Презентация по Химии "ХЛОР - ФИЗИОЛОГИЧЕСКАЯ И ПАТОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ ЧЕЛОВЕКА" - скачать смотреть бесплатно
Презентация по Химии "ХЛОР - ФИЗИОЛОГИЧЕСКАЯ И ПАТОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ ЧЕЛОВЕКА" - скачать смотреть бесплатно Наука о веществе - химия
Наука о веществе - химия Презентация по Химии "Теория химического строения органических веществ" - скачать смотреть
Презентация по Химии "Теория химического строения органических веществ" - скачать смотреть  Химия элементов VIIIA группы
Химия элементов VIIIA группы Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3)
Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3) Органические вещества
Органические вещества Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Карбонильные соединения. (Лекция 10)
Карбонильные соединения. (Лекция 10) Группа веществ, изолируемых экстракцией органическими растворителями (пестициды или ядохимикаты) (продолжение)
Группа веществ, изолируемых экстракцией органическими растворителями (пестициды или ядохимикаты) (продолжение) Процессы и аппараты химической технологии
Процессы и аппараты химической технологии Геохимия урана и тория в гидротермально-метасоматических процессах
Геохимия урана и тория в гидротермально-метасоматических процессах Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8)
Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8) Виды полимеризации
Виды полимеризации Металлы
Металлы  Водород-элемент и простое вещество.Свойства водорода. Цель. Систематизировать и расширить знания учащихся о водороде как хими
Водород-элемент и простое вещество.Свойства водорода. Цель. Систематизировать и расширить знания учащихся о водороде как хими Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы