Содержание
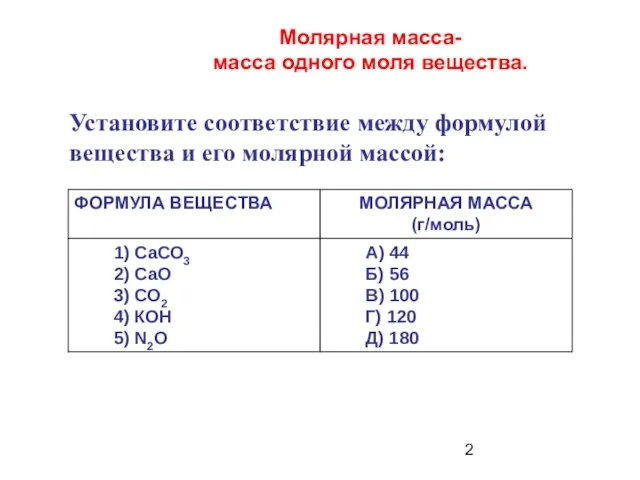
- 2. Установите соответствие между формулой вещества и его молярной массой: Молярная масса- масса одного моля вещества.
- 3. Моль. Молярная масса. Масса вещества. Взаимосвязь.
- 4. Задача 1 Масса 2.5 моль вещества составляет 45 г. Назвать вещество.
- 5. Задача 2 Сколько моль поваренной соли содержится в 1пачке массой 1кг ?
- 6. Задача 3 - Мама! Принеси мне пожалуйста 8 моль воды! - Детка! А можно в граммах?
- 7. Задача 4 Пословица: «Чтобы узнать друга, нужно съесть с ним пуд соли». Сколько лет понадобится, чтобы
- 8. Амедео Авогадро (1776-1856) Итальянский физик и химик. Установил, что вода имеет химическую формулу Н2О, ввел термин
- 9. Следствия: 3. Число молекул в одном моле любого газа равно 6,02·1023. 4. Один моль любого газа
- 10. Моль. Молярная масса. (для газов)
- 11. Сколько моль воздуха человек вдыхает за сутки (~ 2.5 л- вдыхаем, в минуту ~ 8 дыханий)
- 12. 1. Масса 1 л оксида серы (IV) при н. у: 1) 0,35 г 2) 1,43 г
- 13. Задача 7 Взяты равные массы кислорода О2, водорода Н2 и метана СН4 при одинаковых условиях. Отношение
- 14. Какие объемы оксидов серы (IV) и (VI) при н. у. будут иметь одинаковую массу? 46 и
- 15. Растворы
- 16. Объем и плотность раствора Задача 1. Рассчитать (в мл) объем 2465 г раствора серной кислоты (
- 17. «% - сотая часть чего угодно !» Способы выражения концентраций растворов 1. Процентная
- 18. Процентная – масса вещества в 100 г раствора Процентная концентрация выражается числом, граммов растворенного вещества, содержащимся
- 19. Задача 9 К 140г воды добавили 13г соли. Рассчитать w% полученного раствора.
- 20. Производные формулы (4) Или:
- 21. Задача 10 Сколько г вещества содержится в: а) 150г 3% раствора (пл.=1) б) 315г 7% раствора
- 22. Для растворов с другой плотностью, с учетом формулы 3а: получим:
- 23. Задача 11 Сколько г вещества содержится в: а) 120мл 4% раствора (пл.=1.04) б) 300мл 7% раствора
- 24. Соединим формулу (1) с формулами (4б,4в)
- 25. Получим: Иными словами, можно сразу рассчитать число моль вещества в растворе, что весьма удобно при решении
- 26. Задача 12 Сколько моль вещества содержится в: а) 400мл 0.9% раствора NaCl (пл.=1) б) 200мл 5%
- 27. Тест 1-0 (20) Способы выражения концентраций растворов (один вариант ответа)
- 28. 1. Массовая доля вещества в растворе показывает сколько: 1) г вещества содержится в 100 г р-ра
- 29. 2. Молярная концентрация показывает сколько моль вещества содержится в : 1) 100 мл раствора 2) 1
- 30. 3. Запись: «3М раствор глюкозы» означает, что глюкозы содержится: 1) в 100 мл раствора 3 моль
- 31. 4. Запись: «0,89%-ный раствор NaCl» означает, что: NaCl содержится: 1) в 1 л раствора 0,89 г
- 32. 5. Смешали 300 г 15% и 200 г 25% растворов глюкозы. Массовая доля вещества в полученном
- 33. 6.При некоторых заболеваниях в кровь вводят 0,89 % NaCl. Определите массу соли, введенную в организм при
- 34. 7. Терапевтическая доза адреналина составляет 0,5 мл 0,1% раствора в сутки. Рассчитайте массу (г) адреналина за
- 35. 8. Какой объем (мл) 30% раствора Н2О2 и воды необходимо взять для приготовления 500 мл 3%-ного
- 36. 9. Для приготовления 503.65 мл 0.5 М раствора HCIO2 нужно взять 15%-ный раствор этого же вещества
- 37. 10. Смешали 140 мл раствора фосфорной кислоты с массовой долей 30% и 160 мл 20% -го
- 38. Ответы .Тест 1-0 (20) Способы выражения концентраций растворов
- 39. 1. К 200 г 10%-го раствора КСl добавили 50 г воды. Чему равна массовая доля КСI
- 40. 6. В 120 мл воды растворили 30 г вещества. Массовая доля вещества в полученном растворе равна
- 41. Ответы. Тест 1-1(22). (Задачи на массовую долю)
- 43. Скачать презентацию






































 Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Строение атома и периодический закон. (Тема 2)
Строение атома и периодический закон. (Тема 2) Хімія у житті суспільства
Хімія у житті суспільства  Неорганические вещества. Минеральные соли и кислоты
Неорганические вещества. Минеральные соли и кислоты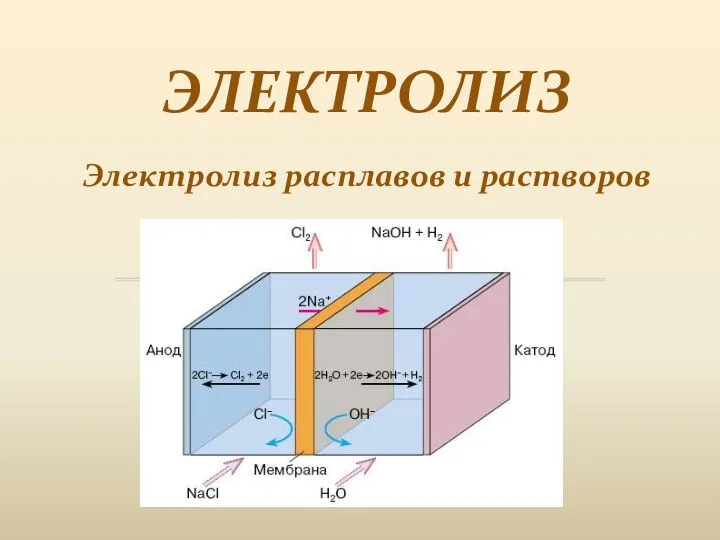 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе Амины. Номенклатура аминов
Амины. Номенклатура аминов Презентация Воздух, его состав и значение.
Презентация Воздух, его состав и значение.  Применение этанола
Применение этанола Галогены и их соединения
Галогены и их соединения Вопрос о природе химической связи – сердце всей химии
Вопрос о природе химической связи – сердце всей химии Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і Розчини високомолекулярних сполук
Розчини високомолекулярних сполук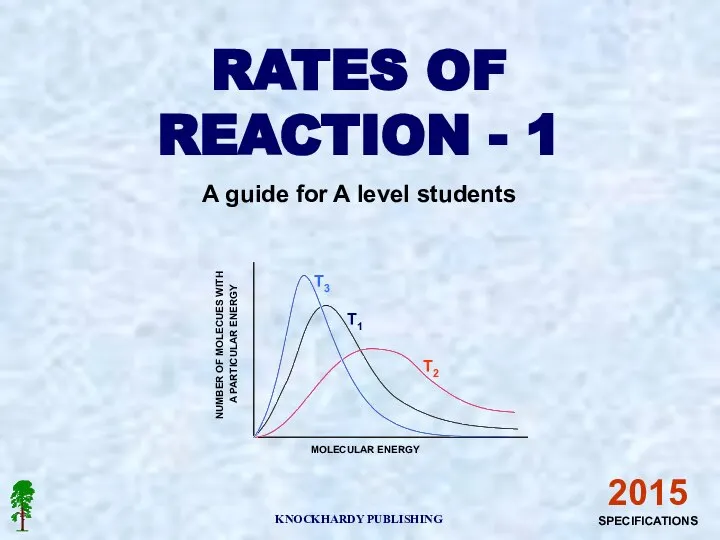 Number of molecues with a particular energy
Number of molecues with a particular energy Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление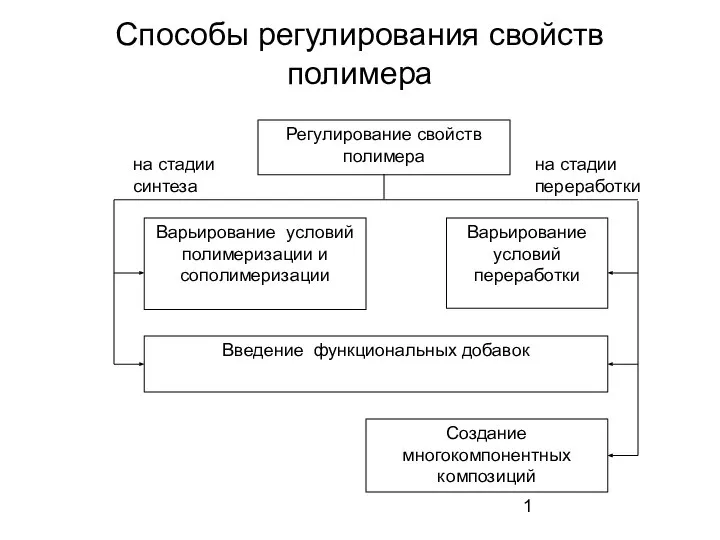 Способы регулирования свойств полимера
Способы регулирования свойств полимера Методика расчета горения топлива
Методика расчета горения топлива Строение гетероциклических соединений
Строение гетероциклических соединений Пайдалы қазба
Пайдалы қазба Федотова Елена Анатольевна – учитель химии
Федотова Елена Анатольевна – учитель химии  Періодична система
Періодична система  Презентация по Химии "Грегор Иоганн Мендель" - скачать смотреть
Презентация по Химии "Грегор Иоганн Мендель" - скачать смотреть  Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах Урок по химии в 10 классе: «Азот и фосфор – p-элементы VA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Костюке
Урок по химии в 10 классе: «Азот и фосфор – p-элементы VA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Костюке Алкадиены
Алкадиены