Содержание
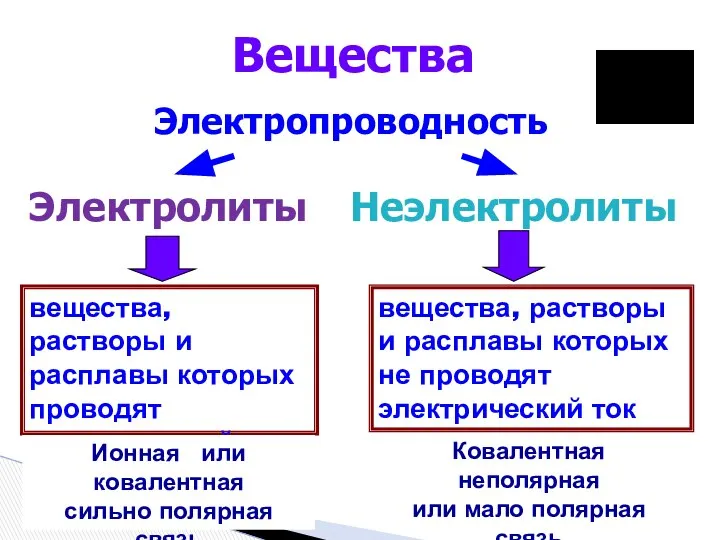
- 2. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
- 3. 1) При растворении в воде эл-ты диссоциируют (распадаются) на ⊕ и ⊖ ионы. Процесс распада эл-та
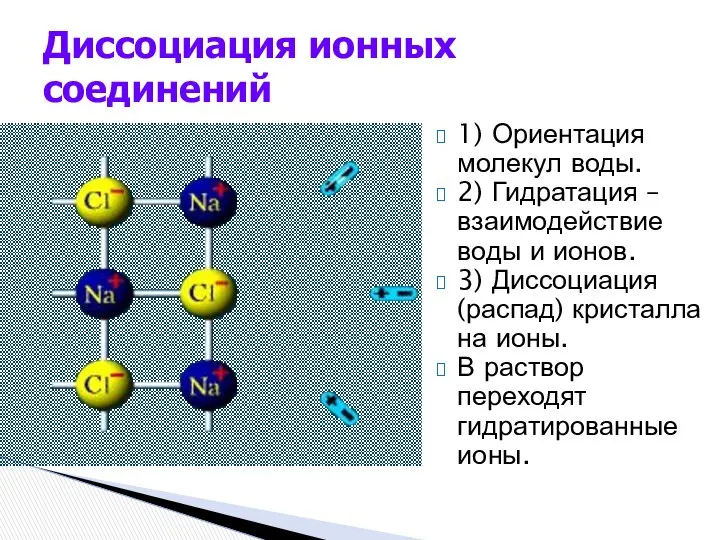
- 4. 1) Ориентация молекул воды. 2) Гидратация – взаимодействие воды и ионов. 3) Диссоциация (распад) кристалла на
- 5. 1) Ориентация молекул воды вокруг полюсов эл-та. 2) Гидратация – взаимодействие воды молекулы эл-та. 3) Ионизация
- 6. 2. Причиной дис-ции эл-та в водном р-ре является его гидратация, т. е. взаимодействие эл-та с молекулами
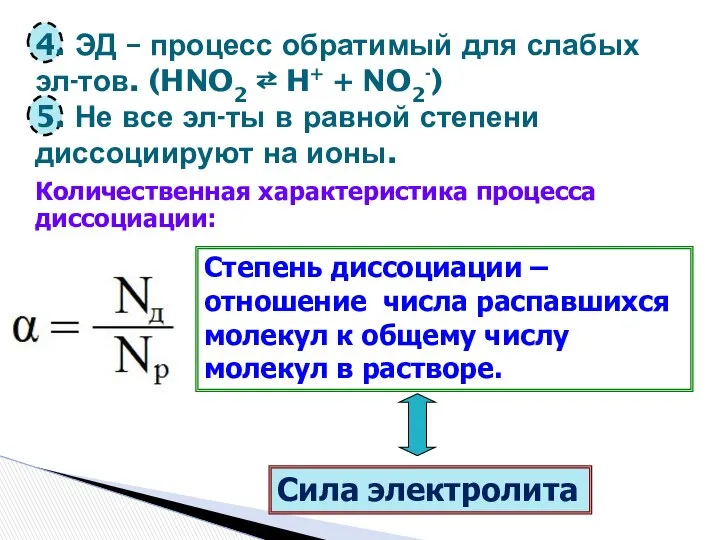
- 8. 4. ЭД – процесс обратимый для слабых эл-тов. (HNO2 ⇄ H+ + NO2-) 5. Не все
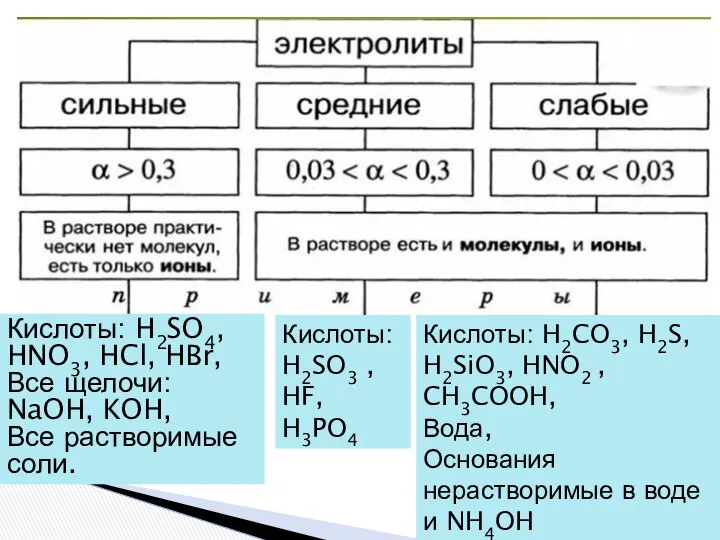
- 9. Кислоты: H2SO4, HNO3, HCl, HBr, Все щелочи: NaOH, KOH, Все растворимые соли. Кислоты: H2SO3 , HF,
- 10. ∗ Кислотами называют эл-ты, которые при дис-ции образуют катионы водорода и анионы кислотного остатка: HCl →
- 11. NaOH → Na+ + OH- Ca(OH)2 → Ca+ + 2OH- ∗ Солями называют эл-ты, которые при
- 13. Скачать презентацию





 Презентация по Химии "Биохимия клетки" - скачать смотреть
Презентация по Химии "Биохимия клетки" - скачать смотреть  Углеводы. Глюкоза
Углеводы. Глюкоза Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Растворы и их классификация
Растворы и их классификация Химия и производство
Химия и производство Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Пластические массы
Пластические массы Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки
Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Вода. Твердість води
Вода. Твердість води  Презентация по Химии "Мило. Синтетичні миючі засоби." - скачать смотреть бесплатно
Презентация по Химии "Мило. Синтетичні миючі засоби." - скачать смотреть бесплатно Уреидтер және оның маңызы
Уреидтер және оның маңызы Строение вещества. Диффузия. Броуновское движение
Строение вещества. Диффузия. Броуновское движение Нефть и способы ее переработки. (10 класс)
Нефть и способы ее переработки. (10 класс) Нефть как дисперсная система
Нефть как дисперсная система Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) Эстетическая, биологическая и культурная роль коллоидных систем в жизни человека
Эстетическая, биологическая и культурная роль коллоидных систем в жизни человека Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Каучук. Получение натурального каучука
Каучук. Получение натурального каучука Натрия и калия иодиды. Йод, раствор иода спиртовый 5%
Натрия и калия иодиды. Йод, раствор иода спиртовый 5% Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна
Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна  Ацетилен и его гомологи
Ацетилен и его гомологи Химическая технология органических веществ
Химическая технология органических веществ Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Синтез этилацетата в условиях сверхвысокочастотного облучения
Синтез этилацетата в условиях сверхвысокочастотного облучения Переводной экзамен по химии «Качественные реакции в органической химии» Толмачевой Кати 11а
Переводной экзамен по химии «Качественные реакции в органической химии» Толмачевой Кати 11а