Содержание
- 2. КАЛИЙ
- 3. Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева,
- 4. Нахождение в природе В свободном состоянии не встречается. Породообразующий элемент входит в состав слюд, полевых шпатов,
- 5. Физические свойства Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок.
- 6. Химические свойства Калий проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе
- 8. Применение Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах,
- 9. Месторождения Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г.Березники, ОАО «Сильвинит»,
- 10. Калий- натриевый насос Обмен осуществляется при помощи специальных белков, образующих в мембране так называемые каналы. На
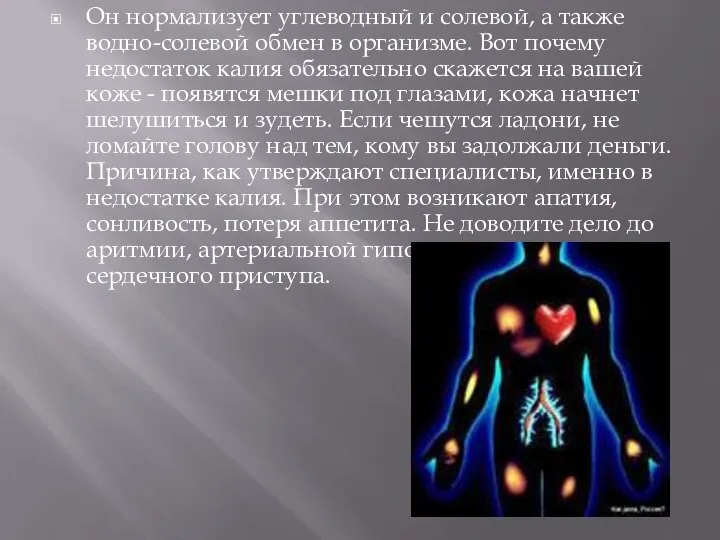
- 11. Он нормализует углеводный и солевой, а также водно-солевой обмен в организме. Вот почему недостаток калия обязательно
- 12. Источник калия: шпинат, огурцы, морковь, лук, петрушка, спаржа, хрен, одуванчик, чеснок, черная смородина, бананы, капуста, редис,
- 13. МАРГАНЕЦ
- 14. Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементовД. И. Менделеева с
- 15. Химический символ Mn Атомный номер 25 Относительная атомная масса 54,9380 ± 0,0001 Стабильный изотоп 55Mn Электронное
- 16. ЭЛЕКТРОННОЕ СТРОЕНИЕ
- 17. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
- 19. Реагирует с соляной и серной кислотой: Mn+2HCl -> MnCl2+H2 Mn+H2SO4 -> MnSO4+H2 С концентрированной серной кислотой
- 20. С хлором, бромом и иодом марганец реагирует с образованием дигалогенидов: Mn + Cl2 = MnCl2 При
- 21. Химические свойства При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде: Mn + O2 →
- 22. Твёрдый Хрупкий Серебристо-белого цвета Проводит электрический ток Температура плавления 1245°С температура кипения 2200°С плотность 7,44 г/см3
- 23. пиролюзит MnO2 манганит MnO2·Mn(OH)2 браунит Mn2O3 родохрозит MnCo3 псиломелан mMnO·MnO2·nH2O и ряд других. МИНЕРАЛЫ МАРГАНЦА
- 24. 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной
- 25. ПОЛУЧЕНИЕ Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: Восстановлением железосодержащих оксидных руд марганца коксом.
- 26. Чёрная металлургия Производство ферритных материалов Изготовление реостатов Термоэлектрический материал Покрытия, обеспечивающие антикоррозионную защиту ПРИМЕНЕНИЕ
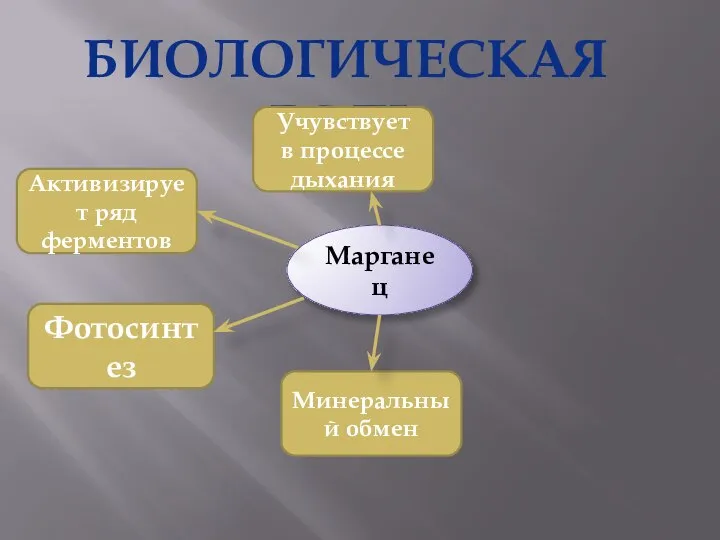
- 27. БИОЛОГИЧЕСКАЯ РОЛЬ Марганец Активизирует ряд ферментов Фотосинтез Минеральный обмен Учувствует в процессе дыхания
- 29. Скачать презентацию
























 Молекулы и атомы
Молекулы и атомы КИСЛОТЫ Путешествие в мир кислот Учитель: Переходцева Л.А. Учащиеся 8 а класса: Абросимов Евгений, Шемелина Яна, Шевченко Евгения
КИСЛОТЫ Путешествие в мир кислот Учитель: Переходцева Л.А. Учащиеся 8 а класса: Абросимов Евгений, Шемелина Яна, Шевченко Евгения Любовь как цепь биохимических реакций
Любовь как цепь биохимических реакций Метаморфизм. Факторы метаморфизма
Метаморфизм. Факторы метаморфизма Методы исследования структуры кристаллов
Методы исследования структуры кристаллов Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Презентация по Химии "Решение задач по химическим уравнениям" - скачать смотреть
Презентация по Химии "Решение задач по химическим уравнениям" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Урок розв’язування задач
Урок розв’язування задач Арены. Бензол С6Н6
Арены. Бензол С6Н6 Ауыр металдар
Ауыр металдар Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Биологические мембраны. Структурная организация
Биологические мембраны. Структурная организация Металлический водород
Металлический водород Основы органической химии
Основы органической химии Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Углеводородные и неуглеводородные соединения нефти. Физические свойства нефти. Химические классификации нефти
Углеводородные и неуглеводородные соединения нефти. Физические свойства нефти. Химические классификации нефти Презентация по химии Электрофильное замещение в ароматических соединениях.
Презентация по химии Электрофильное замещение в ароматических соединениях.  Алюминий и его соединения
Алюминий и его соединения Научные фокусы. Лавовая лампа
Научные фокусы. Лавовая лампа Альдегиды и кетоны
Альдегиды и кетоны Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены
Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены Увлекательная химия
Увлекательная химия ПИЩЕВЫЕ ДОБАВКИ-Е Выполнила ученица 10 класса Цатурова Аида Арташевна
ПИЩЕВЫЕ ДОБАВКИ-Е Выполнила ученица 10 класса Цатурова Аида Арташевна Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Растворы
Растворы