Содержание
- 2. Растворами называются гомогенные системы переменного состава, состоящие из двух или более компонентов. Раствор состоит из растворенного
- 3. Растворы Жидкие Твердые Газообразные
- 4. По растворимости в воде вещества делятся на 3 группы: Хорошо растворимые («р») более 10г вещества в
- 5. Растворы бывают: Разбавленные Концентрированные Насыщенные Пересыщенные
- 6. Концентрация Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
- 7. Способы выражения концентрации растворов Массовая концентрация, массовая доля ω – отношение массы растворенного вещества m(р.в.) к
- 8. Молярная концентрация, молярность СМ (М) – число молей растворенного вещества nр.в-ва, содержащегося в 1 л раствора
- 9. 0,1М – децимолярный; 0,01М – сантимолярный; 0,02М – двусантимолярный; 0,001М – милимолярный. Пример. 1,5М раствор H2SO4
- 10. В общем виде: в 1 л раствора содержится См ∙ М в заданном V раствора содержится
- 11. Эквивалентная концентрация, нормальность CН − число эквивалентов растворенного вещества nэ, содержащихся в 1 л раствора Vр-ра
- 12. 0,1н – децинормальный; 0,01н – сантинормальный; 0,001н – милинормальный. Если в растворе содержится 1 эквивалент вещества,
- 13. Пример. 0,75н раствор H2SO4 или CН = 0,75 моль/л H2SO4 В 1л раствора - 0,75 моль
- 14. Моляльная концентрация, моляльность Cm – число молей растворенного вещества nр.в., приходящихся на 1 кг растворителя mр-ля.
- 15. Титр Т – показывает количество граммов растворенного вещества mр.в., содержащихся в 1 мл раствора Vр-ра. [г/мл]
- 16. Если растворы имеют разную нормальность, то применяют: Закон эквивалентов для растворов: Объемы реагирующих веществ обратно пропорциональны
- 17. НЕФТЬ КАК ДИСПЕРСНАЯ СИСТЕМА
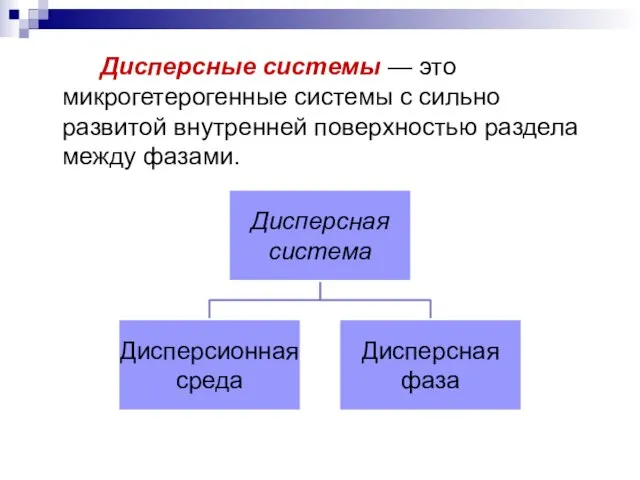
- 18. Дисперсные системы — это микрогетерогенные системы с сильно развитой внутренней поверхностью раздела между фазами.
- 19. Дисперсионная среда - непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких
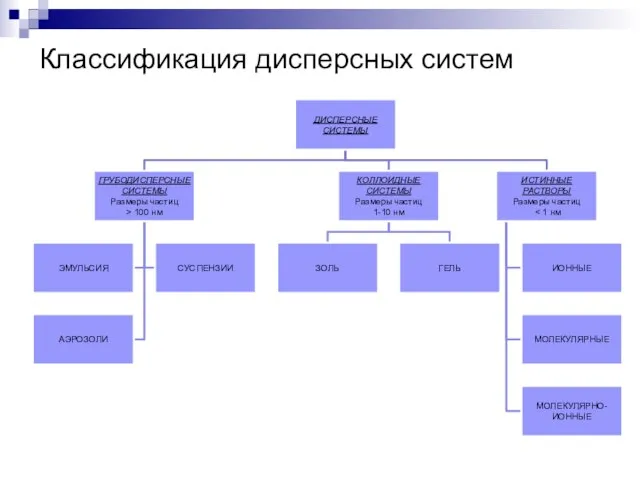
- 21. Классификация дисперсных систем
- 22. Грубодисперсные системы (взвеси) Эмульсии — это дисперсные системы, в которых и дисперсная фаза и дисперсионная среда
- 23. Коллоидные растворы Золи получают дисперсионными и конденсационными методами. Диспергирование чаще всего производят при помощи особых “коллоидных
- 24. Истинные растворы Молекулярные – это водные растворы неэлектролитов – органических веществ (спирта, глюкозы, сахарозы и т.д.);
- 25. Классификация по агрегатному состоянию дисперсионной среды и дисперсной фазы: Твердое вещество Газ Жидкость
- 26. Дисперсная среда: твердое вещество Дисперсная фаза – газ: Почва, текстильные ткани, кирпич и керамика, пористый шоколад,
- 27. Дисперсная среда: газ Дисперсная фаза – газ: Всегда гомогенная смесь (воздух, природный газ) Дисперсная фаза –
- 28. Дисперсная среда: жидкость Дисперсная фаза – газ: Шипучие напитки, пены. Дисперсная фаза – жидкость: Эмульсии: нефть,
- 29. Значение дисперсных систем Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и
- 30. Нефть - это сложная многокомпонентная смесь, которая в зависимости от внешних условий проявляет свойства молекулярного раствора
- 31. Особую группу коллоидных частиц образуют молекулы поверхностно-активных веществ (ПАВ). Они отличаются способностью переходить из растворов на
- 33. Увеличение добычи нефти идет как путем освоения новых месторождений, так и путем интенсификации добычи в эксплуатируемых
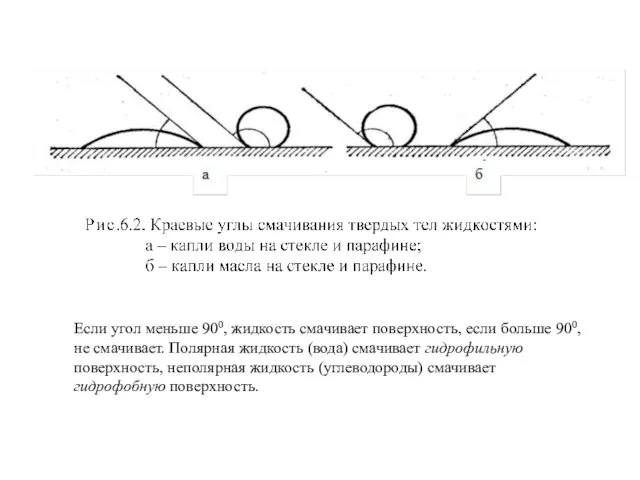
- 34. Если угол меньше 900, жидкость смачивает поверхность, если больше 900, не смачивает. Полярная жидкость (вода) смачивает
- 36. Скачать презентацию






























 Азотсодержащие соединения
Азотсодержащие соединения Химический состав молока
Химический состав молока Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Аморфные тела
Аморфные тела Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Личностно – ориентированный подход в обучении химии Талавир С.Е. Учитель химии МОУ СОШ№5
Личностно – ориентированный подход в обучении химии Талавир С.Е. Учитель химии МОУ СОШ№5 Addition reactions
Addition reactions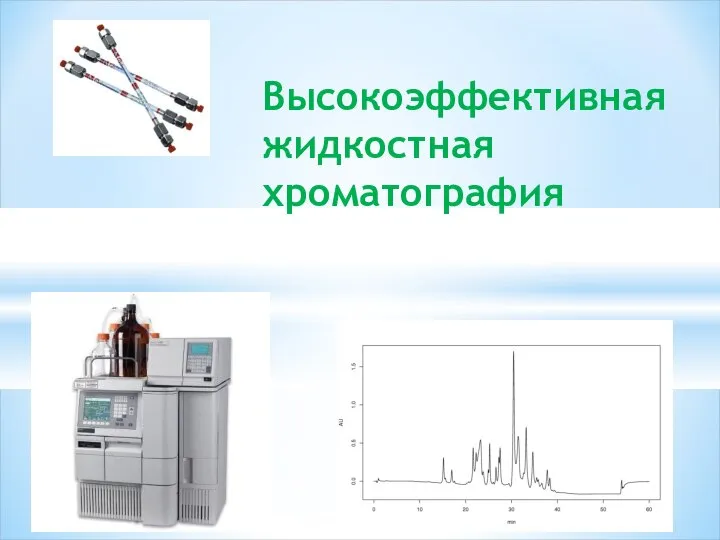 Высокоэффективная жидкостная хроматография (ВЭЖХ)
Высокоэффективная жидкостная хроматография (ВЭЖХ) Осадительное титрование
Осадительное титрование Белковые вещества
Белковые вещества Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Застосування вуглеводів. Їх біологічна роль
Застосування вуглеводів. Їх біологічна роль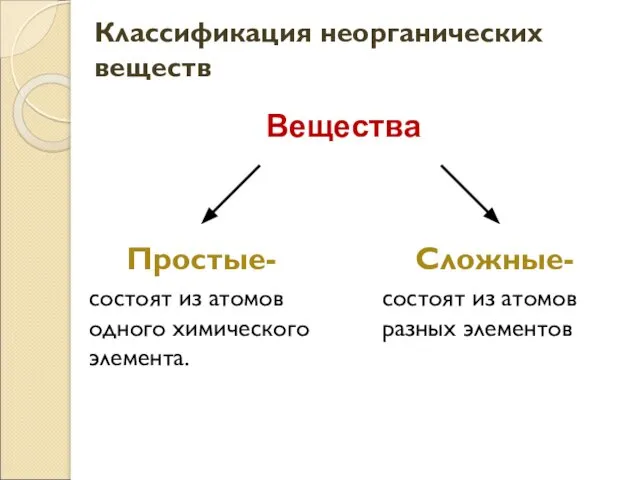 Классификация неорганических веществ
Классификация неорганических веществ Щелочные металлы
Щелочные металлы Роль органической химии в жизни человека
Роль органической химии в жизни человека Занимательная игра по химии
Занимательная игра по химии Учение о растворах
Учение о растворах Человек и отходы «Человечество не погибнет в атомном кошмаре, оно захлебнется в собственных отходах» Нильс Бор. Автор: Георги
Человек и отходы «Человечество не погибнет в атомном кошмаре, оно захлебнется в собственных отходах» Нильс Бор. Автор: Георги Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины Кислоты
Кислоты Классификация металлов в соответствии с ионным потенциалом и параметром мягкости
Классификация металлов в соответствии с ионным потенциалом и параметром мягкости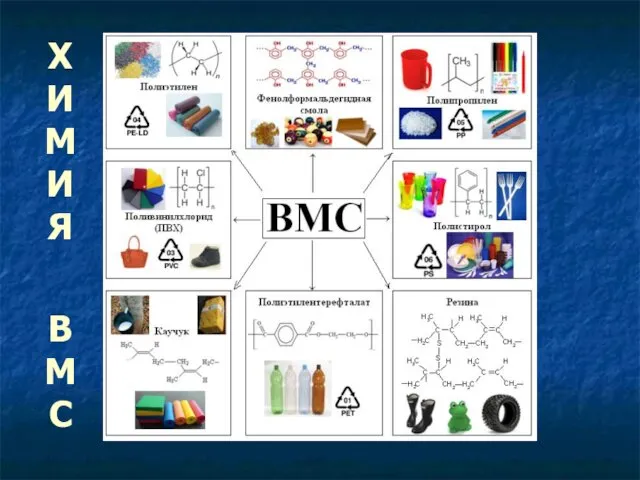 Химия высокомолекулярных соединений (ВМС)
Химия высокомолекулярных соединений (ВМС) Предельные углеводороды. Алканы
Предельные углеводороды. Алканы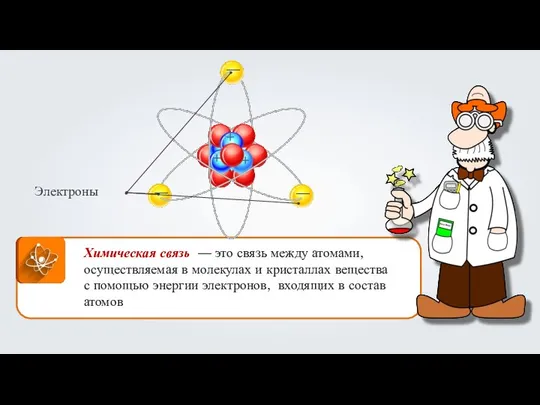 Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Классификация кислых пород
Классификация кислых пород Тренировочный тест. Уравнение состояния идеального газа
Тренировочный тест. Уравнение состояния идеального газа Химия - наука о веществах, их свойствах и превращениях. Понятие о химическом элементе и формах его существования
Химия - наука о веществах, их свойствах и превращениях. Понятие о химическом элементе и формах его существования