Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза
для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приемом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжелых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Токсичность марганца











 Презентация по Химии "Аммиак" - скачать смотреть
Презентация по Химии "Аммиак" - скачать смотреть  Особенности строения, реакционной способности и методы синтеза алкенов
Особенности строения, реакционной способности и методы синтеза алкенов Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Процессы трансформации дихлоруксусной кислоты в атмосфере
Процессы трансформации дихлоруксусной кислоты в атмосфере Презентация Производство стекла
Презентация Производство стекла Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов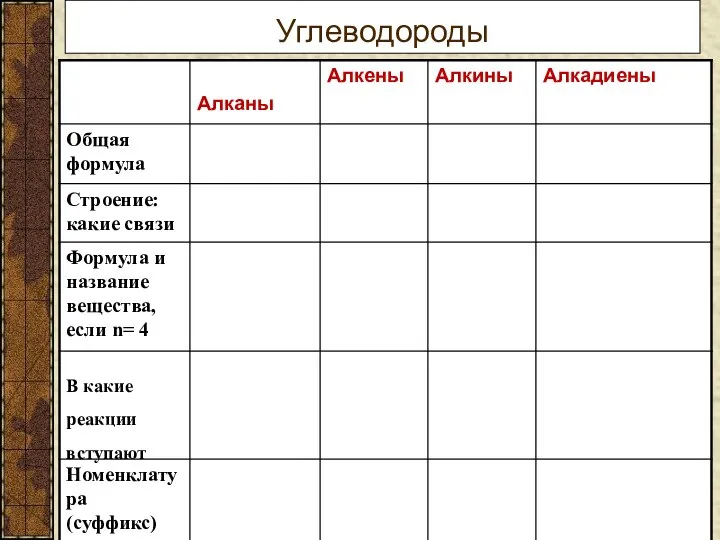 Бензол. Тема 11
Бензол. Тема 11 Александр Михайлович Бутлеров
Александр Михайлович Бутлеров Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі Газы, применяемые для резки и сварки металла
Газы, применяемые для резки и сварки металла Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Базовое нефтехимическое сырье. Углеводородные газы
Базовое нефтехимическое сырье. Углеводородные газы Полиморфизм. Аллотропия
Полиморфизм. Аллотропия Галогены. Их роль в нашей жизни
Галогены. Их роль в нашей жизни Дисперсные системы
Дисперсные системы Превращения веществ в окружающей среде и живых организмах
Превращения веществ в окружающей среде и живых организмах Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Презентация по Химии "Презентация Химия вокруг нас" - скачать смотреть
Презентация по Химии "Презентация Химия вокруг нас" - скачать смотреть  The alkali metals
The alkali metals Аттестационная работа. Рабочая программа курса внеурочной деятельности «Химия. Мои первые опыты»
Аттестационная работа. Рабочая программа курса внеурочной деятельности «Химия. Мои первые опыты» Колообіг води Виконав Проданчук Олег Учень 10-А класу
Колообіг води Виконав Проданчук Олег Учень 10-А класу  Нуклеиновые кислоты
Нуклеиновые кислоты Камни и Рак
Камни и Рак Коррозионные диаграммы
Коррозионные диаграммы Механические свойства металлов
Механические свойства металлов Введение в химическую технологию топлив и углеродных материалов
Введение в химическую технологию топлив и углеродных материалов ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна
Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна