Содержание
- 2. Физико-химические свойства ДХК
- 3. Получение ДХК Наиболее распространенный метод производства для дихлоруксусной кислоты является гидролиз хлорангидрида, который получают окислением трихлорэтилена:
- 4. Применение ДХК
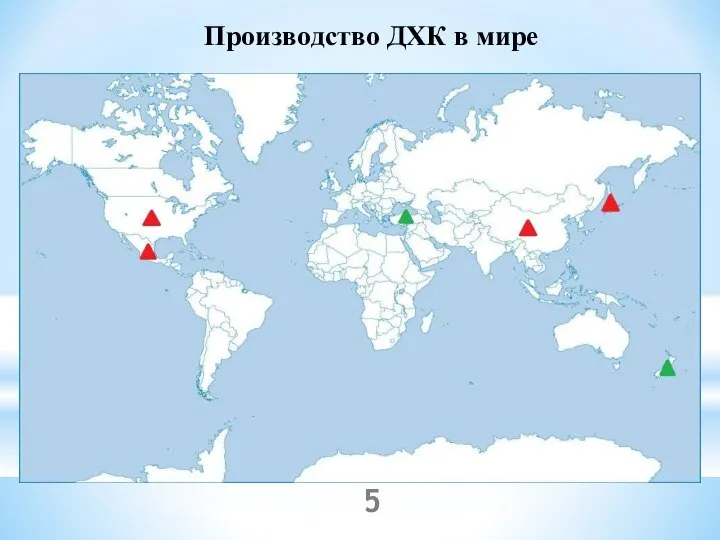
- 5. Производство ДХК в мире
- 6. Токсикологическое действие ДХК Гигиенические нормативы ДХК В 2002 г. Международное агентство по изучению рака (МАИР) отнесло
- 7. Проблема хлорирования воды Концентрация ДХК в хлорированной воде бассейнов Концентрация ДХК в питьевой воде
- 8. Концентрация радикалов OH в атмосфере приблизительно составляет 106 молекул в см3. OH● + CHCl2COOH → C●Cl2COOH
- 9. Метод конкурирующих реакций F + CHCl2COOH → продукты (C*Cl2COOH; CHCl2COO*; HF) F + c-C6H12 → продукты
- 10. Экспериментальная установка 1 – Линия напуска ДХК/c-C6H12 в смеси с гелием, 2 – ВЧ разряд на
- 11. Экспериментальная установка
- 12. Экспериментальная установка Разряд Система вакуумной откачки (паромасляный насос)
- 13. Экспериментальная установка Реактор
- 14. Результаты эксперимента Сравнительный масс-спектр ДХК
- 15. Результаты эксперимента Совместный масс-спектр ДХК и циклогексана m/z 84 m/z 49
- 16. Результаты эксперимента kF+CHCl2COOH = (7,9 ± 0,8)·10-11 Соотношение между расходованием молекул дихлоруксусной кислоты и циклогексана в
- 17. Результаты эксперимента Совместный масс-спектр ДХК и метилхлороформа m/z 97 m/z 51
- 18. Результаты эксперимента Соотношение между расходованием молекул дихлоруксусной кислоты и метилхлороформа в реакции с атомарным фтором kF+CHCl2COOH
- 19. Выводы Среднее значение константы скорости реакции составляет: kF+CHCl2COOH = (8,0 ± 0,9)·10-11 cm3 molecule-1 s-1
- 21. Скачать презентацию

















 Структура основных тканей зуба. (Лекция 2)
Структура основных тканей зуба. (Лекция 2) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Липидтердің метаболизмі
Липидтердің метаболизмі Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Corrosion
Corrosion Виды химической связи. Кристаллические решетки
Виды химической связи. Кристаллические решетки Альдегидтер және кетондар
Альдегидтер және кетондар Аттестационная работа. Программа внеурочной деятельности по химии “Занимательная химия”. (8 класс)
Аттестационная работа. Программа внеурочной деятельности по химии “Занимательная химия”. (8 класс) Виды присадок к моторным топливам
Виды присадок к моторным топливам Физические и химические явления. Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций
Физические и химические явления. Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций Углеводы. Строение и функции
Углеводы. Строение и функции Структуры в сталях
Структуры в сталях Презентация по Химии "«Простые вещества - неметаллы»" - скачать смотреть
Презентация по Химии "«Простые вещества - неметаллы»" - скачать смотреть  Радиоактивные элементы
Радиоактивные элементы Алюминий және оның қосылыстары
Алюминий және оның қосылыстары каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3)
Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3) Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Устойчивость и коагуляция коллоидных систем
Устойчивость и коагуляция коллоидных систем Явище ізомерії. Структурна ізомерія Близнюки органічного світу
Явище ізомерії. Структурна ізомерія Близнюки органічного світу  Катализдің түрлері жене маңызы
Катализдің түрлері жене маңызы Химические формулы. Атомная и молекулярная массы
Химические формулы. Атомная и молекулярная массы Количества вещества
Количества вещества Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу
Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу ПРЕЗЕНТАЦИЯ ПО ХИМИИ ТЕМА: «ЛАУРЕАТ НОБЕЛЕВСКОЙ ПРЕМИИ У.РАМЗАЙ» ПОДГОТОВИЛИ: ШРАЙНЕР МАТИШОВ 8 «А» КЛАСС
ПРЕЗЕНТАЦИЯ ПО ХИМИИ ТЕМА: «ЛАУРЕАТ НОБЕЛЕВСКОЙ ПРЕМИИ У.РАМЗАЙ» ПОДГОТОВИЛИ: ШРАЙНЕР МАТИШОВ 8 «А» КЛАСС  Теория Опарина
Теория Опарина Неметаллы. Сера. 9 класс
Неметаллы. Сера. 9 класс Каучук и резина
Каучук и резина