Содержание
- 2. Вспомните! Что называется химической реакцией? Многие химические реакции являются окислительно -востановительными (ОВР).
- 3. Что будет с яблоком, если его надрезать и оставить на некоторое время? Яблоко темнеет из-за окисления
- 4. После изучения этой темы вы будете способны: объяснять и применять понятия, относящиеся к химическим реакциям, окислительно-восстановительным
- 5. Значение ОВР Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в
- 6. Значение ОВР С ними связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез.
- 7. Значение ОВР Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в
- 8. В чем же заключается суть ОВР? Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления
- 9. «Окислитель как отъявленный грабитель Как пират, бандит, агрессор, Бармалей Отнимает электроны - и ОК! Потерпев урон,
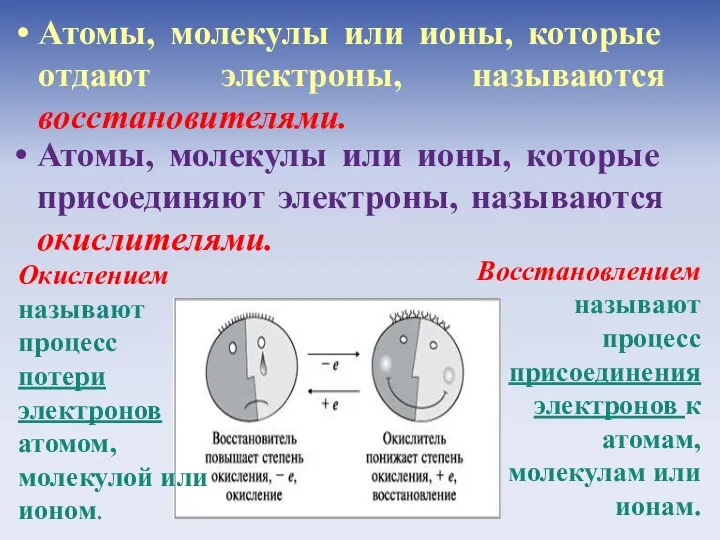
- 10. Окислением называют процесс потери электронов атомом, молекулой или ионом. Восстановлением называют процесс присоединения электронов к атомам,
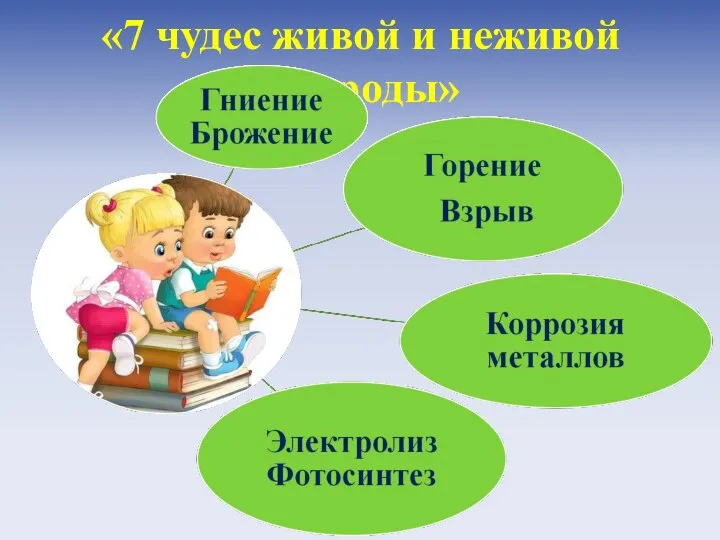
- 11. «7 чудес живой и неживой природы»
- 12. Корро́зия металлов (от лат. corrosio - разъедание) - это самопроизвольное разрушение металлов в результате химического или
- 13. Гние́ние (аммонификация) - процесс разложения азотсодержащих органических соединений (белков, аминокислот), в результате их ферментативного гидролиза под
- 14. Горе́ние - сложный физико-химический процесс превращения компонентов горючей смеси в продукты сгорания с выделением теплового излучения,
- 15. Горе́ние спички. Природу горения спички упрощенно можно описать как ОВР: 2КСlO3 + 3S = 2КСl +
- 16. Состав намазки для спичечной головки
- 17. Состав намазки спичечной коробки
- 18. Взрыв - физический и/или химический быстропротекающий процесс с выделением значительной энергии в небольшом объёме (по сравнению
- 19. Взрыв нитроглицерина (входит в состав динамита, пороха): При химическом взрыве, кроме газов, могут образовываться и твёрдые
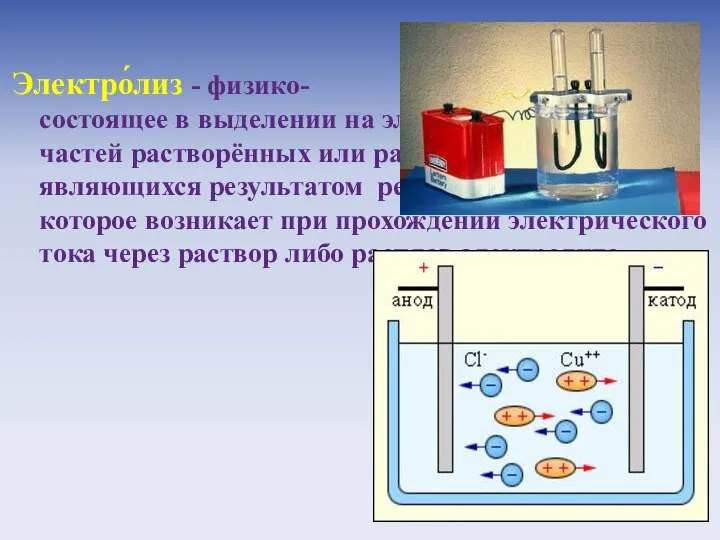
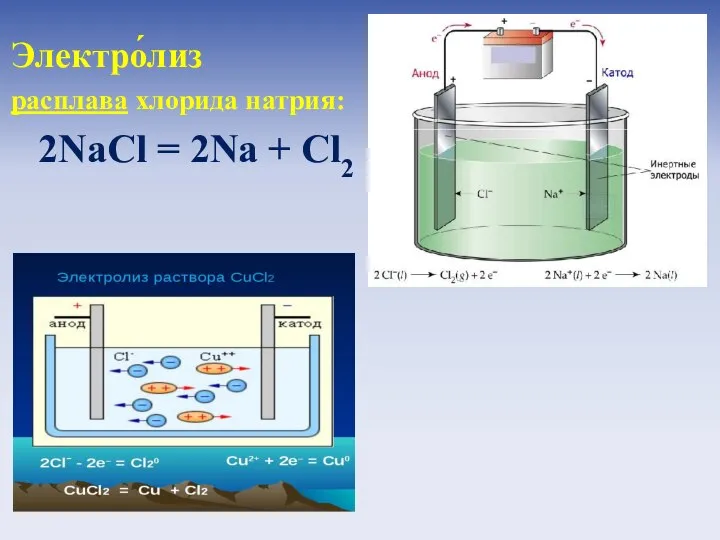
- 20. Электро́лиз - физико- химическое явление, состоящее в выделении на электродах составных частей растворённых или расплавленных веществ,
- 21. Электро́лиз расплава хлорида натрия: 2NaCl = 2Na + Cl2 Электро́лиз раствора хлорида меди (II): CuCl2 =
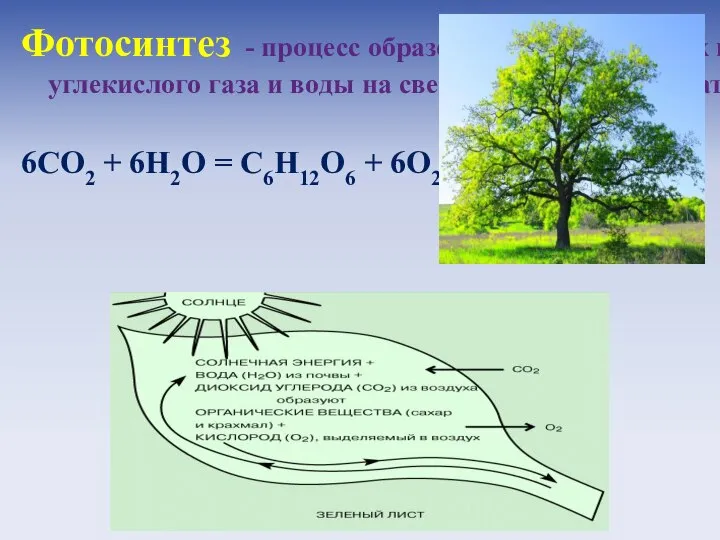
- 22. Фотосинтез (от греч. φωτο- свет и σύνθεσις - синтез, совмещение) - процесс образования органических веществ из
- 23. Фотосинтез - процесс образования органических веществ из углекислого газа и воды на свету при участии биокатализаторов:
- 24. Броже́ние (сбра́живание, фермента́ция) - «это такой метаболический процесс, при котором регенерируется АТФ, а продукты расщепления органического
- 25. Броже́ние - это анаэробный (без участия кислорода) метаболический распад молекул питательных веществ, например глюкозы: С6H12O6 =
- 26. По горизонтали: 1. Какой процесс отражает схема: 3. Реакция N2 (г.) + 3Н2 (г.)=2NН3 (г.) +
- 27. По горизонтали: восстановление экзотермическая. оксид окисление баланса три восстановитель замещения ноль цинк ОКИСЛИТЕЛИ
- 28. Выводы:
- 29. Чтобы еще лучше разобраться в изучаемой теме, выполните самостоятельно задание : сделайте описание трёх природных явлений
- 31. Желаю успехов в изучении химии! Спасибо за внимание!
- 34. Скачать презентацию

























 Исследование состава и свойств минеральной воды Авторы:
Исследование состава и свойств минеральной воды Авторы:  Нефть и способы её переработки
Нефть и способы её переработки Презентация по химии Стероиды
Презентация по химии Стероиды  Цветные качественные реакции, как способ химического кодирования документов Выполнил: Шарафутдинов Райнур 10 класс, МБОУ СОШ №1
Цветные качественные реакции, как способ химического кодирования документов Выполнил: Шарафутдинов Райнур 10 класс, МБОУ СОШ №1 Метасоматический процесс
Метасоматический процесс Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Этилен
Этилен Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Дисперсные системы
Дисперсные системы Автор: учитель МОУ «вечерняя школа №1» Автозаводского района г.Н.Новгорода Л.Л.Удовыдченкова
Автор: учитель МОУ «вечерняя школа №1» Автозаводского района г.Н.Новгорода Л.Л.Удовыдченкова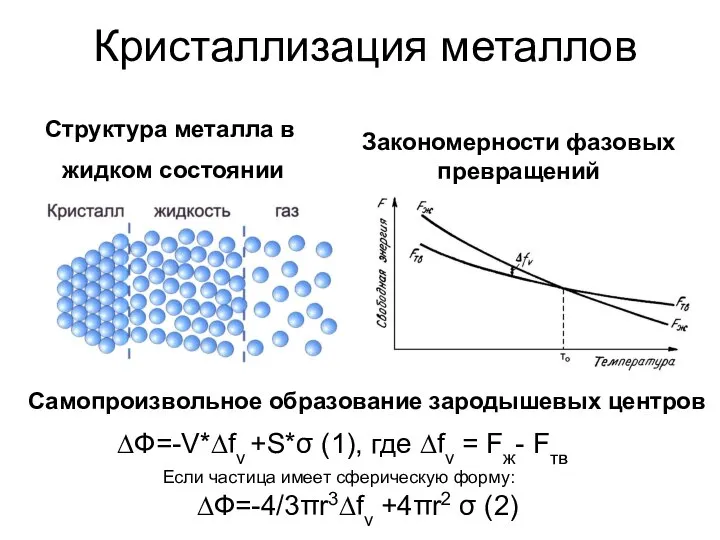 Закономерности фазовых превращений
Закономерности фазовых превращений Общая химия, понятия
Общая химия, понятия Гетероциклические соединения
Гетероциклические соединения Свойства белков как биологических полимеров. 10 класс
Свойства белков как биологических полимеров. 10 класс Ультрадисперсные, наноструктурные и ультрамелкозернистые материалы
Ультрадисперсные, наноструктурные и ультрамелкозернистые материалы Аттестационная работа. Программа регионального компонента образовательной области Химия
Аттестационная работа. Программа регионального компонента образовательной области Химия Научные фокусы. Лавовая лампа
Научные фокусы. Лавовая лампа Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения
Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения Презентация по Химии "Кислотные дожди"
Презентация по Химии "Кислотные дожди" Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов Агрегатное состояние вещества. Газообразные вещества
Агрегатное состояние вещества. Газообразные вещества Углерод и его соединения
Углерод и его соединения Материаловедение. Строение и основные свойства металлов
Материаловедение. Строение и основные свойства металлов Соли
Соли Введение в наноинженерию. Тема 1
Введение в наноинженерию. Тема 1 Жизненный Путь Дмитрия Ивановича Менделеева Выполнила ученица 10-А класса Рипка Елизавета
Жизненный Путь Дмитрия Ивановича Менделеева Выполнила ученица 10-А класса Рипка Елизавета  Тема урока: Силикатная промышленность
Тема урока: Силикатная промышленность