Содержание
- 2. Ряд аминокислот, поступающих в клетки и образующихся в процессе внутриклеточного протеолиза вовлекаются в биосинтез белка. Остальные
- 3. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ Продуктами декарбоксилирования аминокислот являются биогенные амины: гистамин (продукт декарбоксилирования гистидина), кадаверин (из лизина), γ-аминомасляная
- 4. Декарбоксилирование аминокислот необратимый ферментативный процесс, катализируемый декарбоксилазами аминокислот. Кофактор декарбоксилаз аминокислот – пиридоксальфосфат – производное витамина
- 5. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ Дезаминирование аминокислот – отщепление α-аминогруппы – может происходить различными путями: восстановительное, гидролитическое, внутримолекулярное, окислительное.
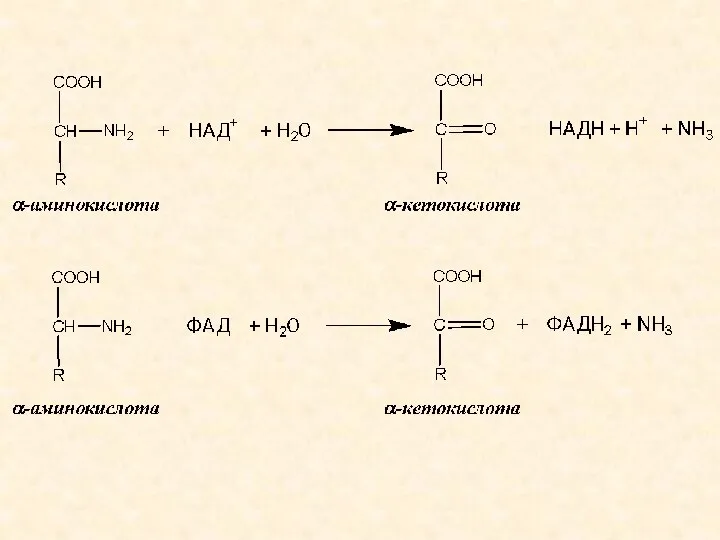
- 6. Окислительное дезаминирование катализируется: - НАД-зависимыми дегидрогеназами аминокислот; - ФАД (ФМН)-зависимыми оксидазами аминокислот. Продукты окислительного дезаминирования –
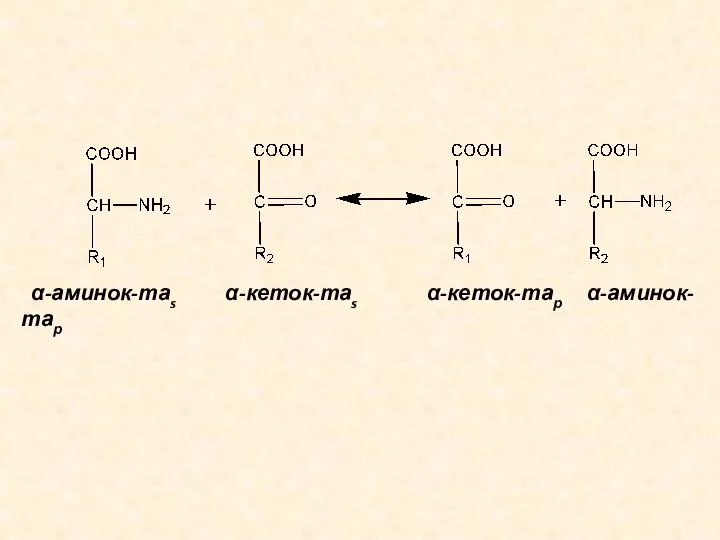
- 8. ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ Трансаминирование (переаминирование) аминокислот – реакция межмолекулярного переноса аминогруппы от α-аминокислоты на α-кетокислоту без промежуточного
- 9. α-аминок-таs α-кеток-таs α-кеток-тар α-аминок-тар
- 10. Аммиак, образующийся при дезаминировании, используется: для синтеза заменимых аминокислот – восстановительное аминирование; для синтеза азотсодержащих соединений.
- 11. ТИПЫ АЗОТИСТОГО ОБМЕНА в зависимости от формы выведения аммиака Аммониотелический тип у водных животных. Конечный продукт
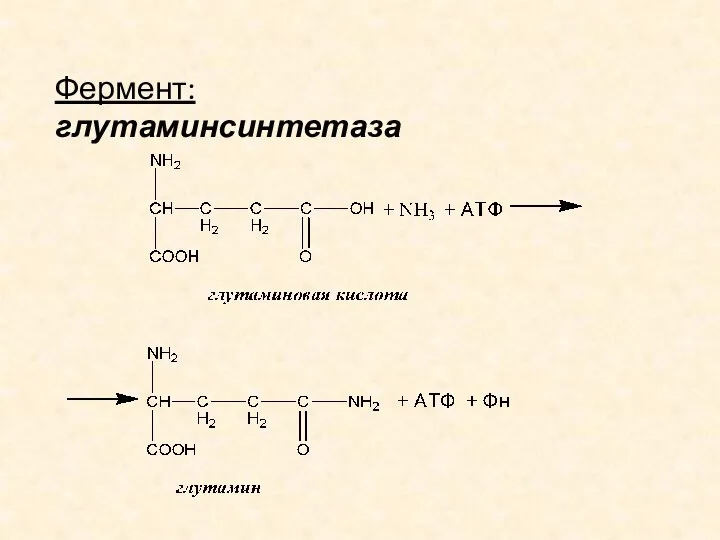
- 12. БИОСИНТЕЗ ГЛУТАМИНА Биосинтез глутамина (и аспарагина) – наиболее распространенный путь первичного связывания и обезвреживания аммиака в
- 13. Фермент: глутаминсинтетаза
- 14. ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВНИЯ Синтез мочевины происходит в печени. Донор азота только аммиак (а не амины и
- 15. БИОСИНТЕЗ АМИНОКИСЛОТ Аминокислоты, образующиеся при гидролизе белков: 2/3 расходуются на синтез белка; 1/3 катаболизируются. Т.е. 1/3
- 16. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ Заменимые аминокислоты: ала, асн, асп,гли, глн, глу, про, сер, тир, цис Незаменимые аминокислоты:
- 19. Скачать презентацию













 Биохимия нервной ткани
Биохимия нервной ткани Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Минералы. Галенит
Минералы. Галенит Химические свойства хрома
Химические свойства хрома Функции белков
Функции белков Кремний и его соединения
Кремний и его соединения Химические свойства полимеров
Химические свойства полимеров Классификация органических реакций в органической химии
Классификация органических реакций в органической химии Водород. Получение водорода
Водород. Получение водорода Атмосфера. Химические и физико-химические процессы в атмосфере
Атмосфера. Химические и физико-химические процессы в атмосфере Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Одноатомные спирты
Одноатомные спирты Фенол қосылыстары
Фенол қосылыстары Белки, или протеины
Белки, или протеины Именные реакции в органической химии
Именные реакции в органической химии Кристаллы вокруг нас
Кристаллы вокруг нас Установление структуры биополимеров
Установление структуры биополимеров Рибофлавин - витамин красоты
Рибофлавин - витамин красоты Загальна характеристика рослинних кормiв. (Тема 1)
Загальна характеристика рослинних кормiв. (Тема 1) Ферменты гидролиза и биосинтеза нуклеиновых кислот
Ферменты гидролиза и биосинтеза нуклеиновых кислот ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите
ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см
Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см Використання натуральних та штучних добавок при виготовленні харчових продукцій
Використання натуральних та штучних добавок при виготовленні харчових продукцій Крахмал. Физические свойства
Крахмал. Физические свойства Оксиды
Оксиды  Синтетикалық полимерлер (пластиктер)
Синтетикалық полимерлер (пластиктер)