Положение железа в периодической системе Менделеева.
Характеристика химического элемента железа в периодической
системе Менделеева включает в себя положение его в периоде и группе, порядковый номер, число электронных слоев и заряд ядра, степень окисления в химических соединениях.
Железо находится в IV периоде, VIII группе, побочной подгруппе. Порядковый номер элемента- 26. Ar ( Fe)= 55, 847, является d-элементом, имеет степени окисления: +2, +3 иногда +6.
Fe+ 26 1s 2s 2p 3s 3p 3d 4s
2 8 14 2
26
2
2
2
2
6
6
6
4s
2s
3s
2p
3p
3d
1s





 Презентация по Химии "Стекло. Производство стекла" - скачать смотреть
Презентация по Химии "Стекло. Производство стекла" - скачать смотреть  Месторождения турмалина
Месторождения турмалина Водород.Кислоты.Соли
Водород.Кислоты.Соли Хинолин, изохинолин, акридин. (Леция 6)
Хинолин, изохинолин, акридин. (Леция 6) Алкалоиды ряда изохинолина и пурина. (Лекция 10)
Алкалоиды ряда изохинолина и пурина. (Лекция 10) Железо Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Б
Железо Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Б Задача №5. Аккумулятор на основе железа
Задача №5. Аккумулятор на основе железа Total Synthesis of (−) - Lepenine
Total Synthesis of (−) - Lepenine Липидтердің метаболизмі
Липидтердің метаболизмі Растворение как физико-химический процесс. Растворимость. Типы растворов
Растворение как физико-химический процесс. Растворимость. Типы растворов Молекулярные базы данных. Принцип действия и характеристики основных компьютерных программ
Молекулярные базы данных. Принцип действия и характеристики основных компьютерных программ Тема урока Химические вещества и опасные объекты
Тема урока Химические вещества и опасные объекты Производство аммиака.
Производство аммиака.  Непредельные углероды. Алкены
Непредельные углероды. Алкены Коллоквиум №1. Аминокислоты. Пептиды. Белки. Липиды
Коллоквиум №1. Аминокислоты. Пептиды. Белки. Липиды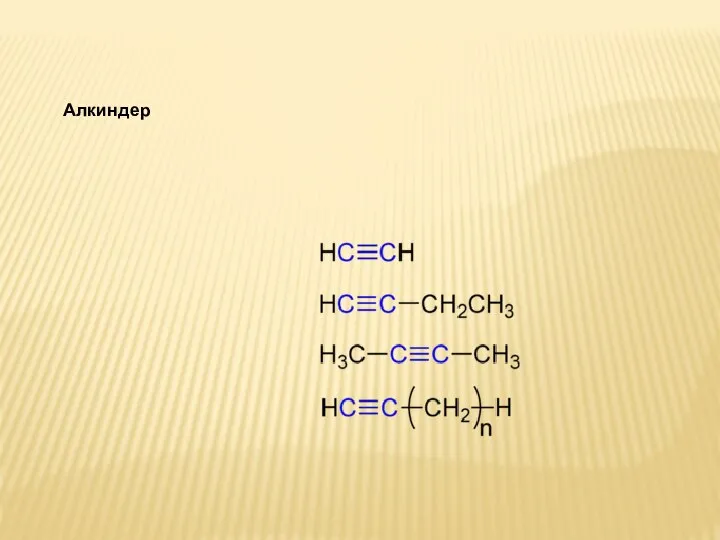 Алкиндер
Алкиндер Методы ОВ титрования
Методы ОВ титрования Галогены. Галогеноводородные кислоты и их соли
Галогены. Галогеноводородные кислоты и их соли Дезактивація радіаційних речовин у зоні ядерного ураження
Дезактивація радіаційних речовин у зоні ядерного ураження Использование Диофантовых уравнений при решении задач в математике и химии
Использование Диофантовых уравнений при решении задач в математике и химии Классификация методов аналитической химии
Классификация методов аналитической химии Продукти її виробництва
Продукти її виробництва Испытания на подлинность препаратов органической природы
Испытания на подлинность препаратов органической природы Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Solutions. Equilibrium in solutions of strong and weak electrolytes
Solutions. Equilibrium in solutions of strong and weak electrolytes Презентация Химический алфавит
Презентация Химический алфавит  Классификация аминокислот
Классификация аминокислот Химия радиоактивных элементов
Химия радиоактивных элементов