Содержание
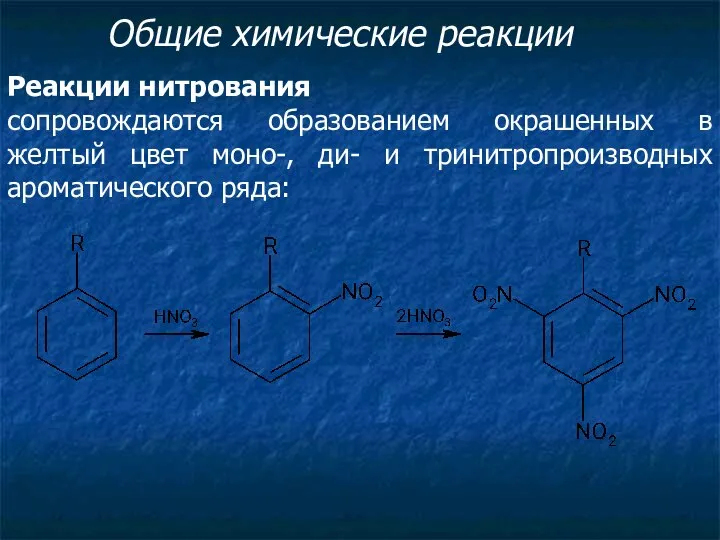
- 2. Общие химические реакции Реакции нитрования сопровождаются образованием окрашенных в желтый цвет моно-, ди- и тринитропроизводных ароматического
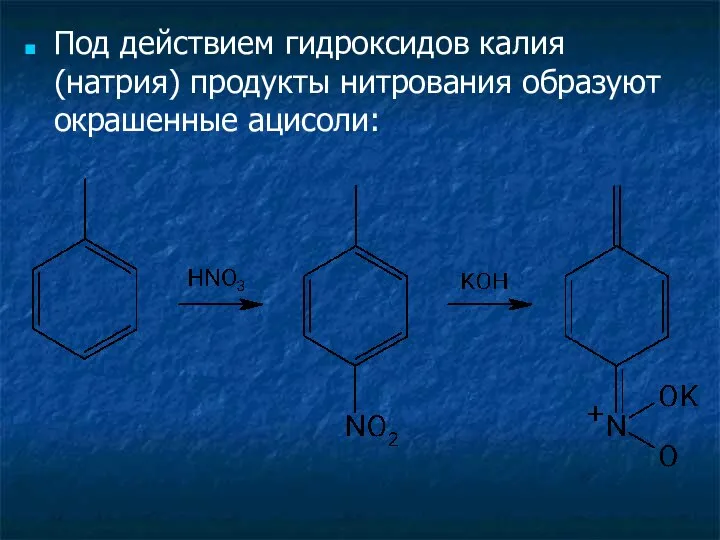
- 3. Под действием гидроксидов калия (натрия) продукты нитрования образуют окрашенные ацисоли:
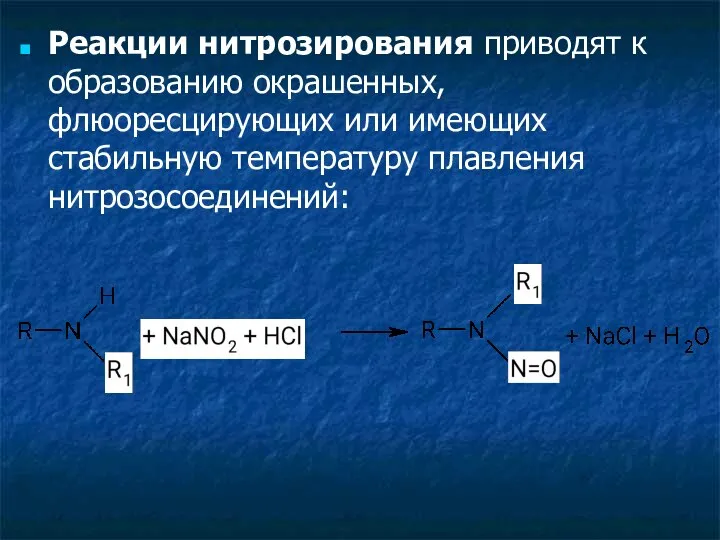
- 4. Реакции нитрозирования приводят к образованию окрашенных, флюоресцирующих или имеющих стабильную температуру плавления нитрозосоединений:
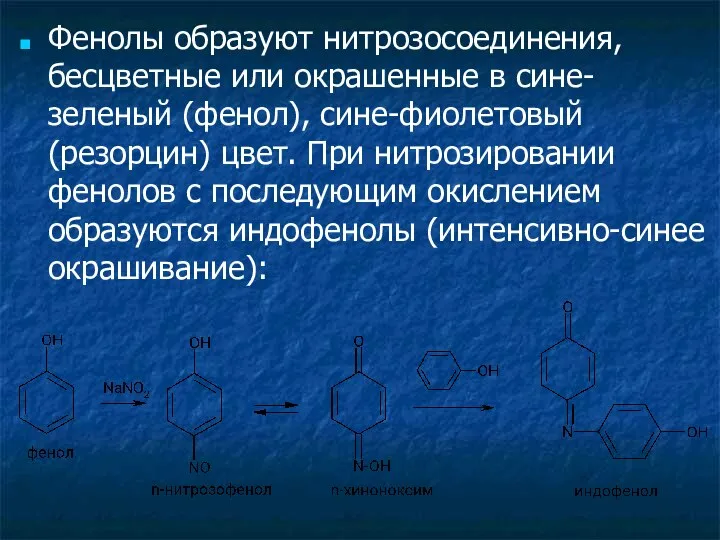
- 5. Фенолы образуют нитрозосоединения, бесцветные или окрашенные в сине-зеленый (фенол), сине-фиолетовый (резорцин) цвет. При нитрозировании фенолов с
- 6. Реакции диазотирования и азосочетания используют для идентификации производных первичных ароматических аминов и фенолов. Азосоединения — окрашенные
- 7. Азосочетание с фенолами (нафтолами) происходит в слабощелочной (pH 9,0-10,0), а с аминами — в слабокислой среде.
- 8. Реакцию азосочетания используют также для идентификации сложных эфиров фенолов, ацилированных первичных ароматических аминов (после гидролиза) и
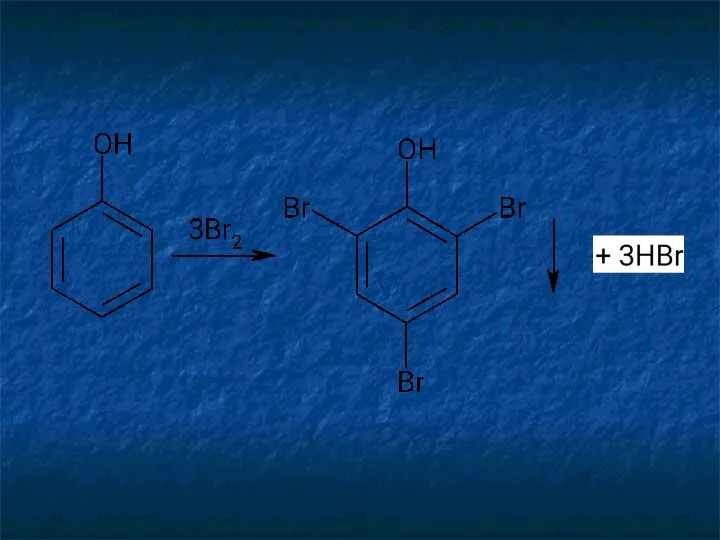
- 9. Реакции галогенирования (бромирования и иодирования) по типу реакции электрофильного замещения используют для обнаружения производных фенолов и
- 11. Аналогично происходит процесс образования трииодпроизводных. При наличии в молекулах фенола и анилина радикалов в пара- или
- 12. Реакции дегалогенирования можно выполнять без предварительной минерализации (если галогены связаны с углеродом ковалентной связью). Отщепление галогена
- 13. Реакции конденсации альдегидов и кетонов с первичными аминами, гидроксиламином, гидразинами используются для идентификации всех указанных групп
- 14. Кетопроизводные образуют гидразоны: >C=O + H2N–NH–R → >C=N–NH–R↓ + H2O и кетоксимы: >C=O + H2N–OH →
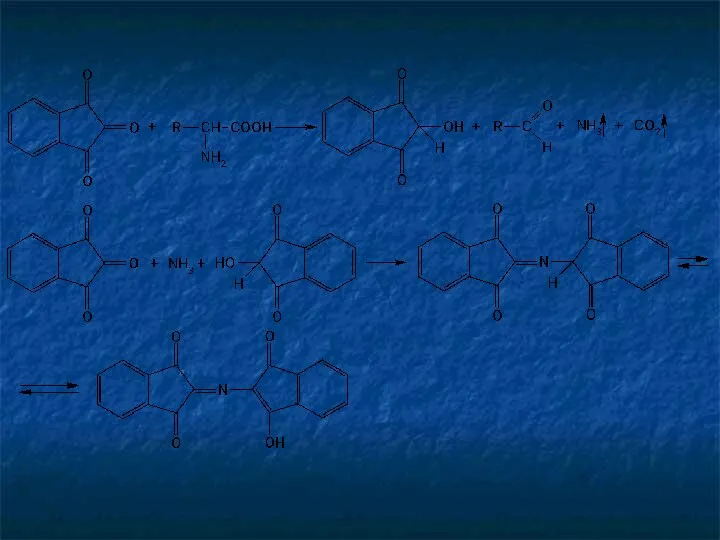
- 15. Реакции окислительной конденсации с участием альдегидов лежат в основе таких широко применяемых в фармацевтическом анализе реакций,
- 17. Реакции этерификации, ацилирования и гидролиза. Для подтверждения подлинности спиртов и карбоновых кислот широко используют реакцию этерификации,
- 18. Образовавшиеся в результате этерификации, ацилирования, гидролиза продукты идентифицируют по аналитическому эффекту (цвету, запаху, образованию газа или
- 19. Общим способом испытаний ЛВ, содержащих в молекуле сложноэфирную, лактонную, лактамную, амидную, имидную группы, является реакция, основанная
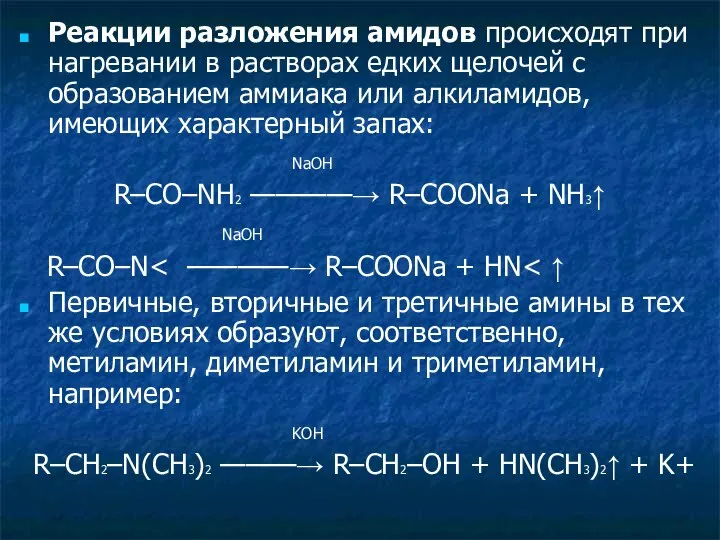
- 21. Реакции разложения амидов происходят при нагревании в растворах едких щелочей с образованием аммиака или алкиламидов, имеющих
- 22. Указанные химические реакции используют для испытания подлинности солей первичных аммониевых оснований, амидов ароматических и гетероциклических кислот,
- 23. Реакции окисления-восстановления Процесс гидрирования осуществляют, как правило, водородом в момент выделения (при взаимодействии металлического цинка с
- 24. Широко используются в фармацевтическом анализе реакции окисления. Первичные спирты идентифицируют последовательно окисляя до альдегидов и кислот,
- 25. Реакция окисления альдегидов лежит в основе использования реактива Фелинга, представляющего собой смесь отдельно приготавливаемых растворов сульфата
- 26. Реакции образования солей и комплексных соединений Соли органических кислот идентифицируют по наличию катионов натрия, калия, кальция
- 27. Нерастворимые в воде или окрашенные соли, и комплексные соединения образуют с ионами тяжелых металлов органические ЛВ,
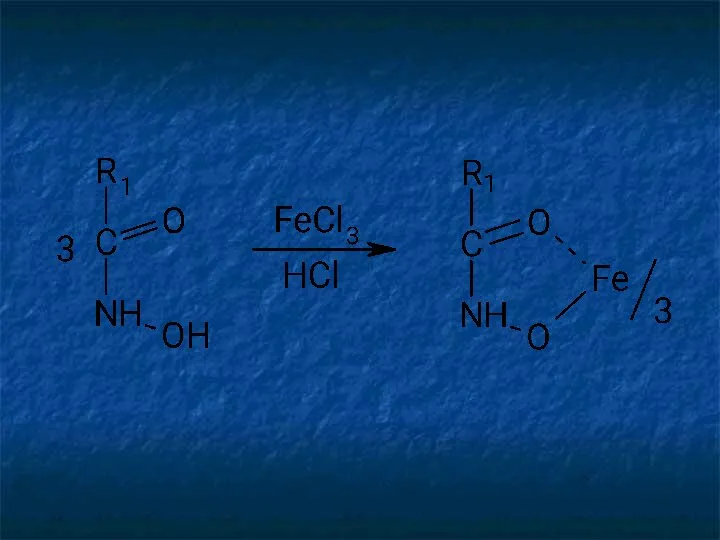
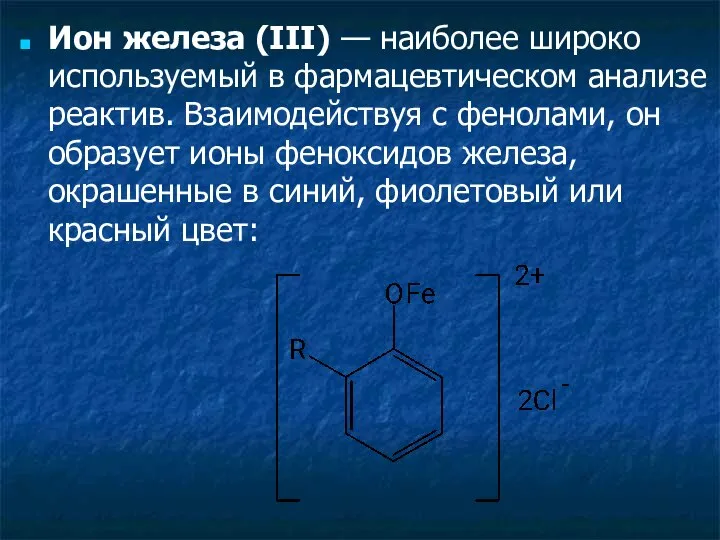
- 28. Ион железа (III) — наиболее широко используемый в фармацевтическом анализе реактив. Взаимодействуя с фенолами, он образует
- 29. Окрашенные комплексы с ионами железа (III) образуют практически все органические соединения, содержащие в молекуле фенольный гидроксил.
- 30. (рН 1) (рН 2.5) (рН 7.4) фиолетовая красная желтая Структура этих комплексов обусловлена наличием у салицилат-иона
- 31. Ионы железа (III) образуют окрашенные в красный цвет соли с ацетат-ионом: 3FeCl3 + 9CH3COO– + 2H2O
- 32. Окрашенные комплексные соли образуют с ионами железа (III) также глюконат-, аминосалицилат-ионы, кислота аскорбиновая, производные пиразолона, 8-оксихинолина,
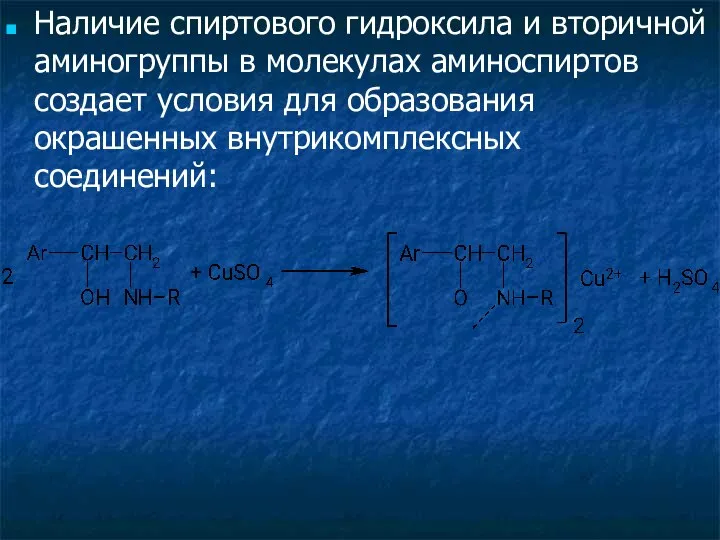
- 33. Ион меди (II) образует окрашенные комплексные ионы с многоатомными спиртами (глицерол, аминоспирты):
- 34. Наличие спиртового гидроксила и вторичной аминогруппы в молекулах аминоспиртов создает условия для образования окрашенных внутрикомплексных соединений:
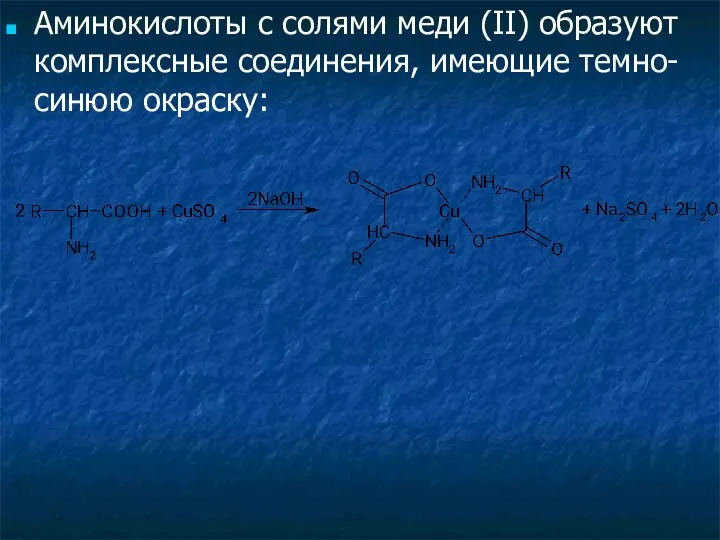
- 35. Аминокислоты с солями меди (II) образуют комплексные соединения, имеющие темно-синюю окраску:
- 36. Идентификация органических оснований и их солей Общим испытанием на соли органических оснований [R≡N]HA с неорганическими и
- 37. Органические азотсодержащие основания и их соли, в т.ч. алкалоиды, витамины, антибиотики, можно идентифицировать с помощью осадительных
- 38. Для идентификации органических оснований и их солей используют реактивы, которые не совсем точно называют специальными (специфичными)
- 40. Скачать презентацию


























 Производные пиримидино-тиазола
Производные пиримидино-тиазола Презентация по Химии "Жири" - скачать смотреть бесплатно
Презентация по Химии "Жири" - скачать смотреть бесплатно Полимеры
Полимеры Строение и физические свойства металлов
Строение и физические свойства металлов Влияние пищевых добавок на здоровье человека
Влияние пищевых добавок на здоровье человека Оксиды. Определение
Оксиды. Определение Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють
Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють Искусственные материалы. Пластмассы
Искусственные материалы. Пластмассы Окислительно-восстановителые реакции в органической химии
Окислительно-восстановителые реакции в органической химии PROTEIN PLEX. Состав
PROTEIN PLEX. Состав Азот и фосфор
Азот и фосфор Презентация по Химии "Презентация по химии Галогены" - скачать смотреть
Презентация по Химии "Презентация по химии Галогены" - скачать смотреть  Green chemistry application to intermolecular forces
Green chemistry application to intermolecular forces Каменск Уральский техникум торговли и сервиса
Каменск Уральский техникум торговли и сервиса Проведення електрофоретичного розділення ДНК в агарозному гелі
Проведення електрофоретичного розділення ДНК в агарозному гелі Химия ғажайыптар әлемі
Химия ғажайыптар әлемі Омега 3
Омега 3 Углеводороды
Углеводороды Кристаллы
Кристаллы Муниципальное образовательное учреждение «Лицей №3» Научно-исследовательская работа по химии «Получение ароматических масел»
Муниципальное образовательное учреждение «Лицей №3» Научно-исследовательская работа по химии «Получение ароматических масел» Химия в пище (нитраты и пищевые добавки)
Химия в пище (нитраты и пищевые добавки) Окислительно-восстановительные процессы. Рн, нейтрализация
Окислительно-восстановительные процессы. Рн, нейтрализация Идеальный и реальный газ
Идеальный и реальный газ Химическая связь
Химическая связь Интересные свойства редких металлов
Интересные свойства редких металлов Презентация по Химии "Органические вещества" - скачать смотреть
Презентация по Химии "Органические вещества" - скачать смотреть  Дефекты упорядочивающихся сплавов
Дефекты упорядочивающихся сплавов Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов