Содержание
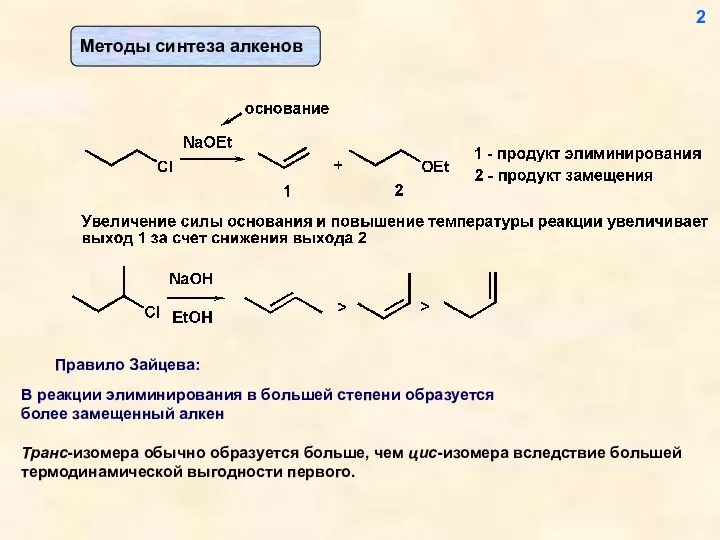
- 2. Транс-изомера обычно образуется больше, чем цис-изомера вследствие большей термодинамической выгодности первого. 2
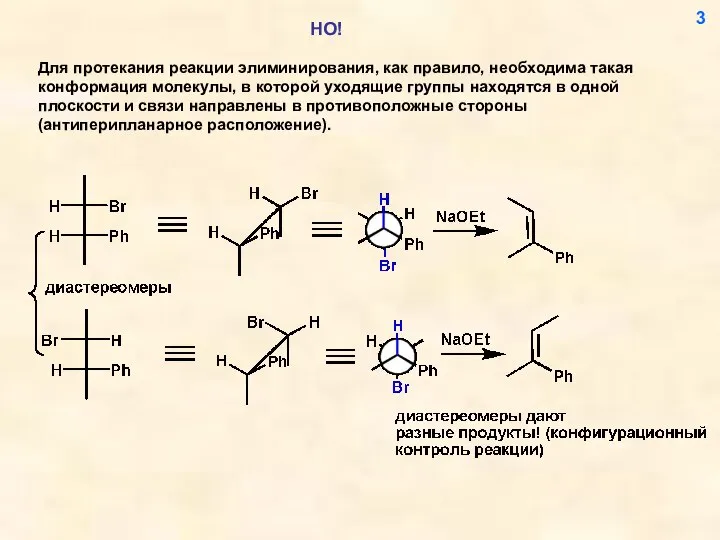
- 3. 3
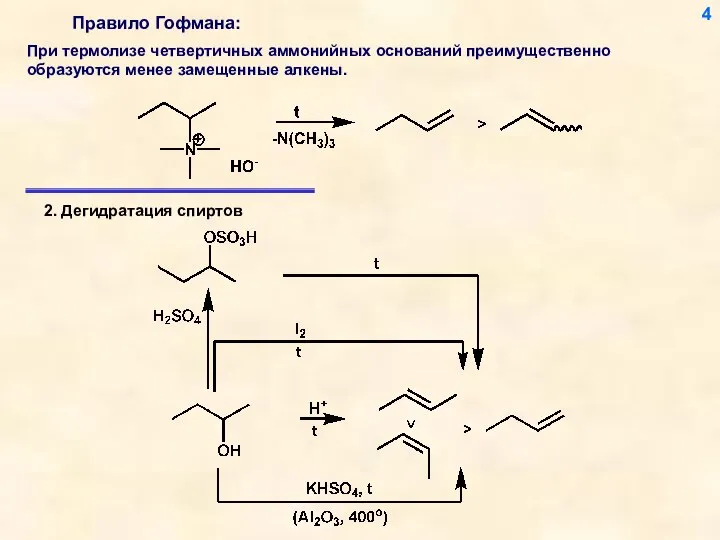
- 4. 4
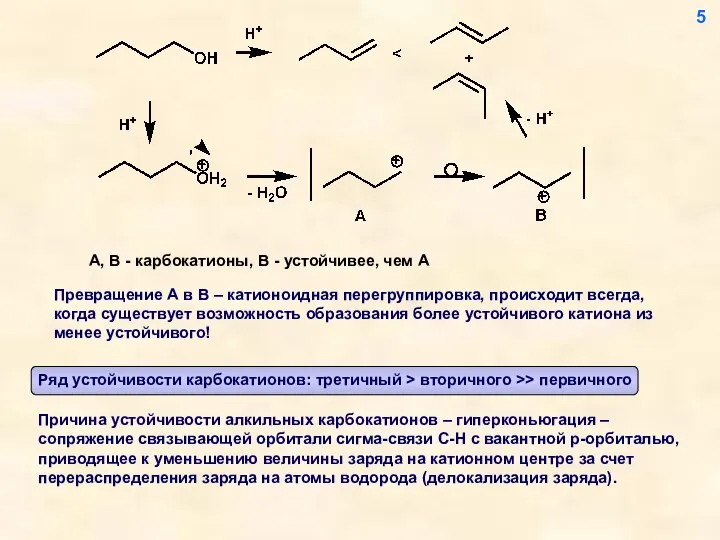
- 5. A, B - карбокатионы, В - устойчивее, чем А Превращение А в В – катионоидная перегруппировка,
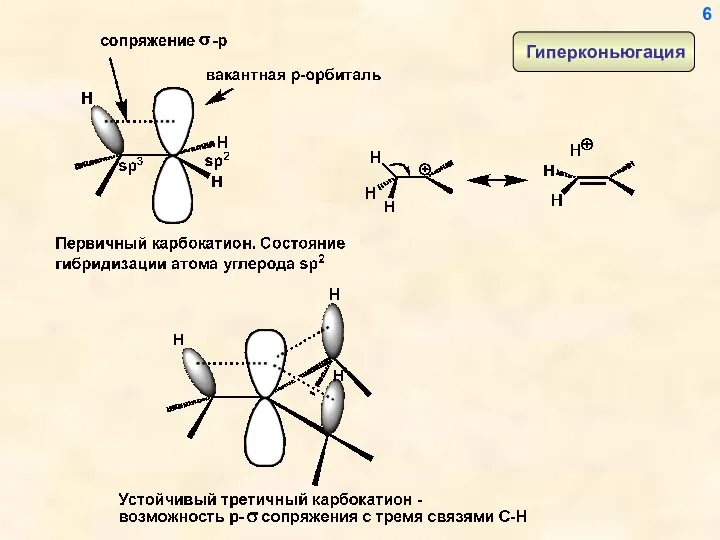
- 6. 6
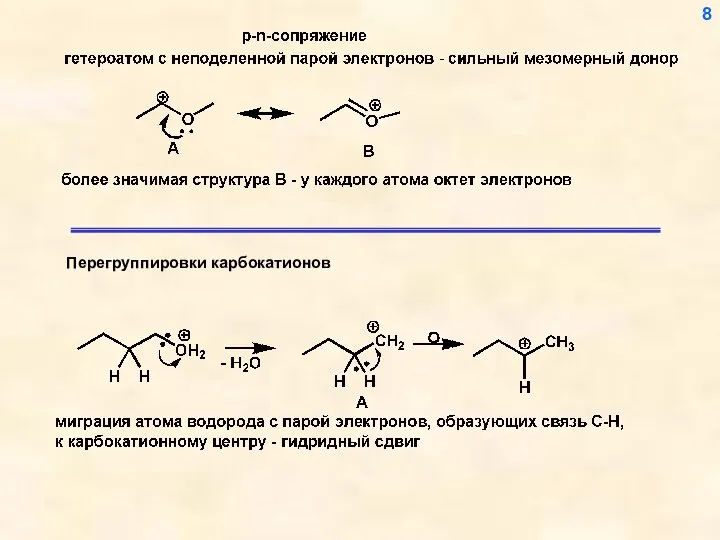
- 7. Другой, еще более эффективный способ стабилизации карбокатионного центра – р- -сопряжение и р-n-сопряжение (донорный мезомерный эффект
- 8. 8
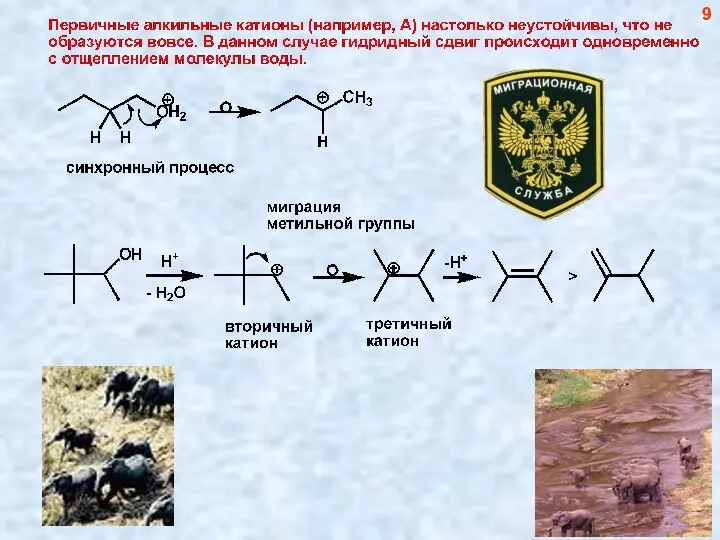
- 9. 9
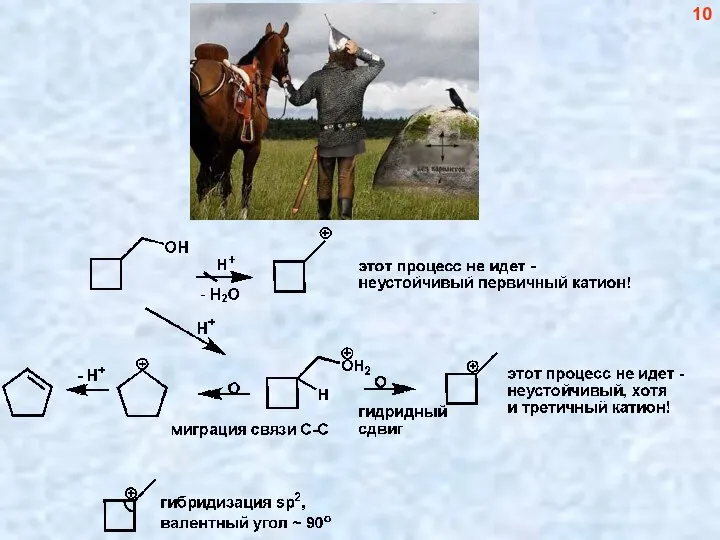
- 10. 10
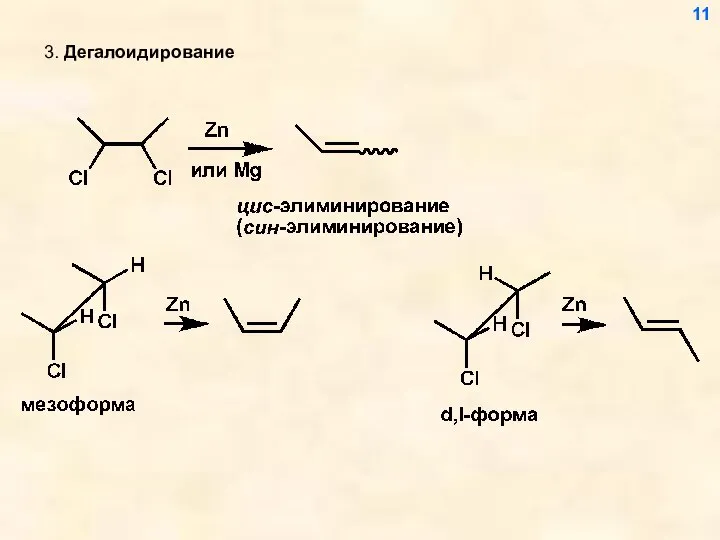
- 11. 3. Дегалоидирование 11
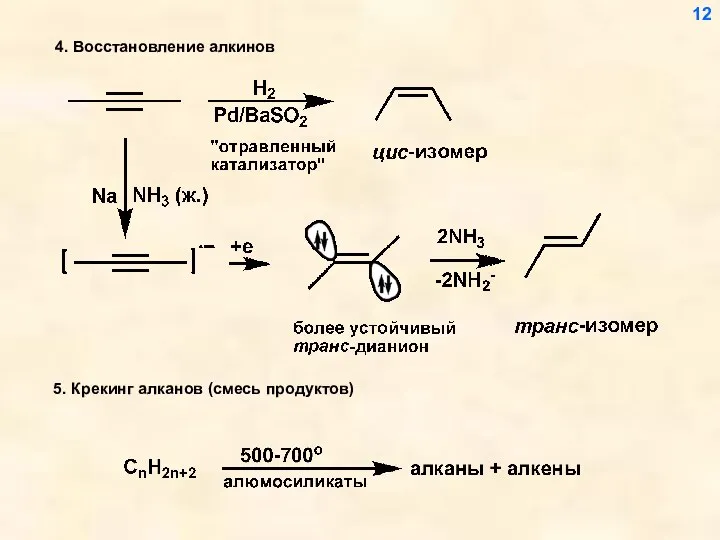
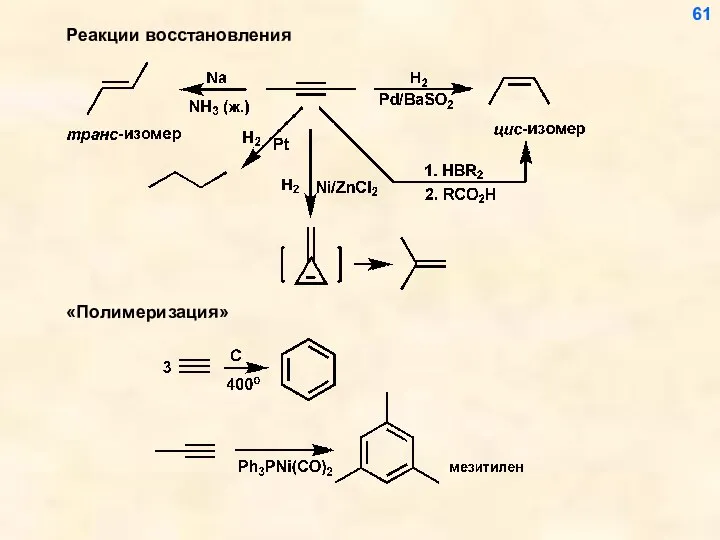
- 12. 4. Восстановление алкинов 12
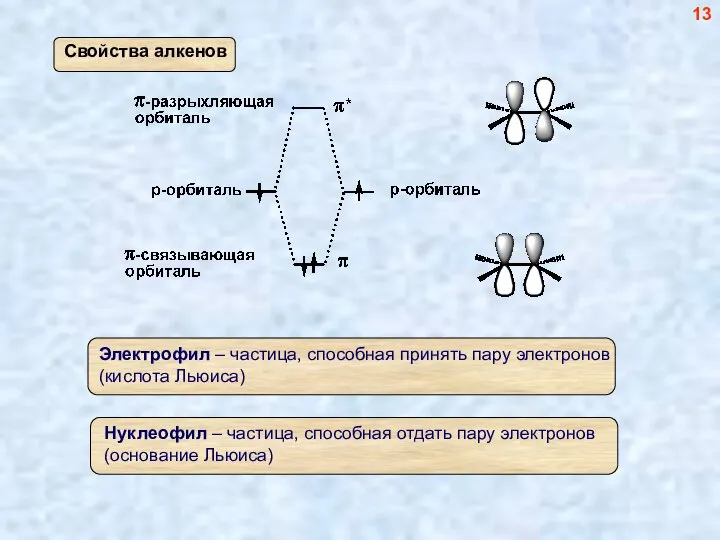
- 13. 13
- 14. 14
- 15. Невозможность взаимодействия алкена с электрофилом (запрет по симметрии) 15
- 16. 16
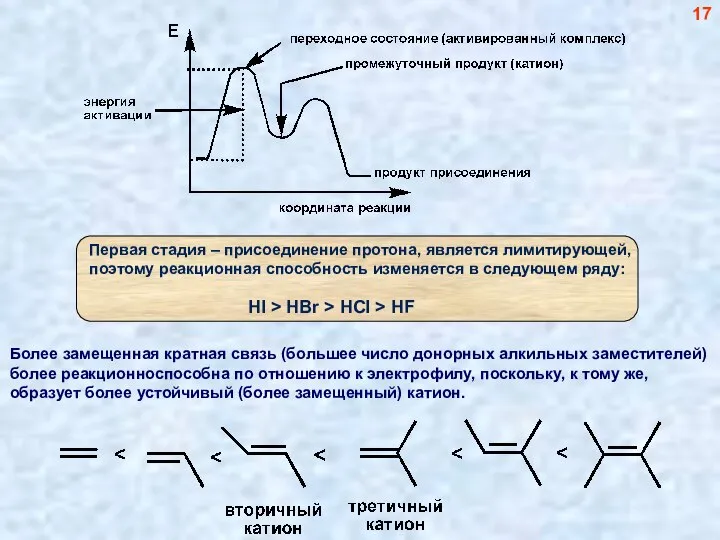
- 17. Более замещенная кратная связь (большее число донорных алкильных заместителей) более реакционноспособна по отношению к электрофилу, поскольку,
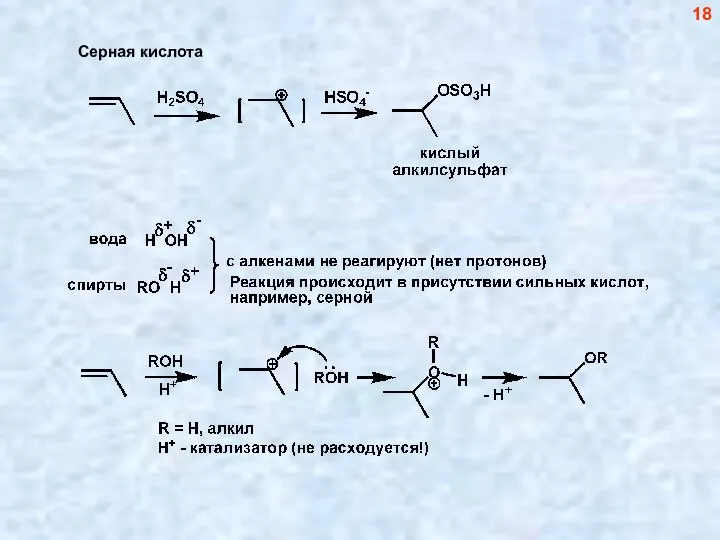
- 18. 18
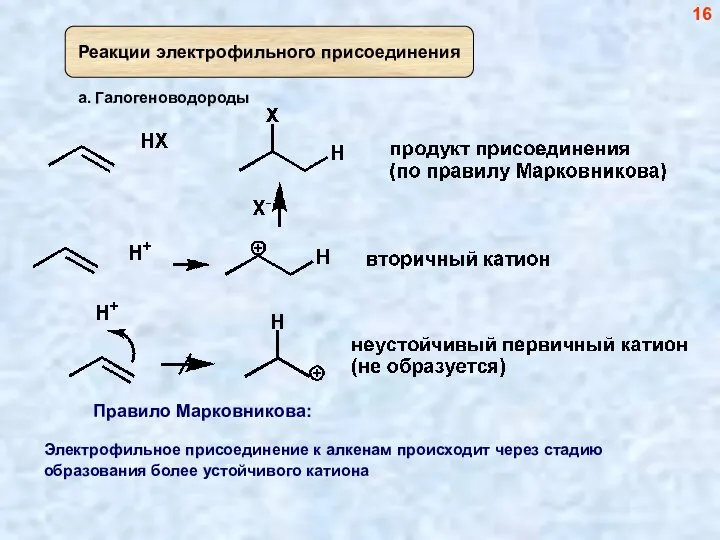
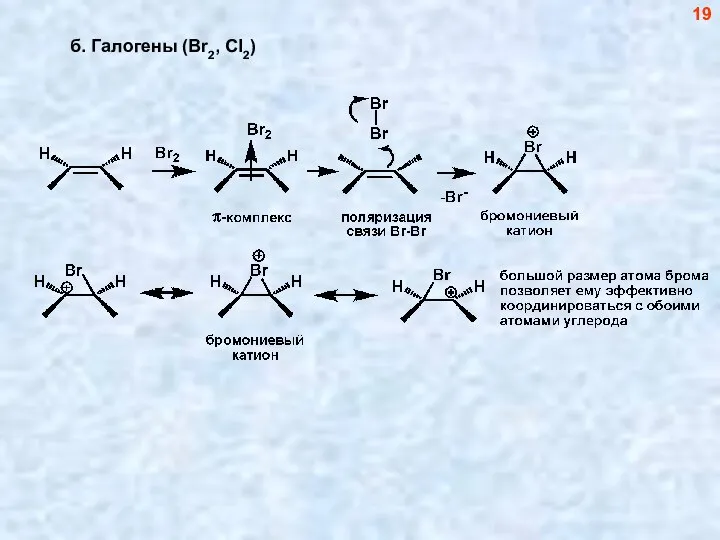
- 19. б. Галогены (Br2, Cl2) 19
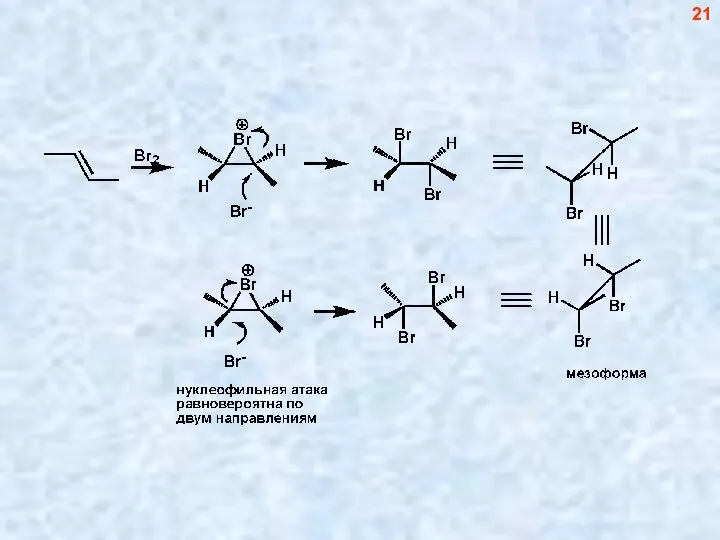
- 20. Стереоспецифическое электрофильное транс-присоединение брома к алкену (цис-бутену-2) 20
- 21. 21
- 22. Аналогично происходит реакция с хлором. С иодом алкены не реагируют, реакция с фтором происходит со взрывом,
- 23. 23
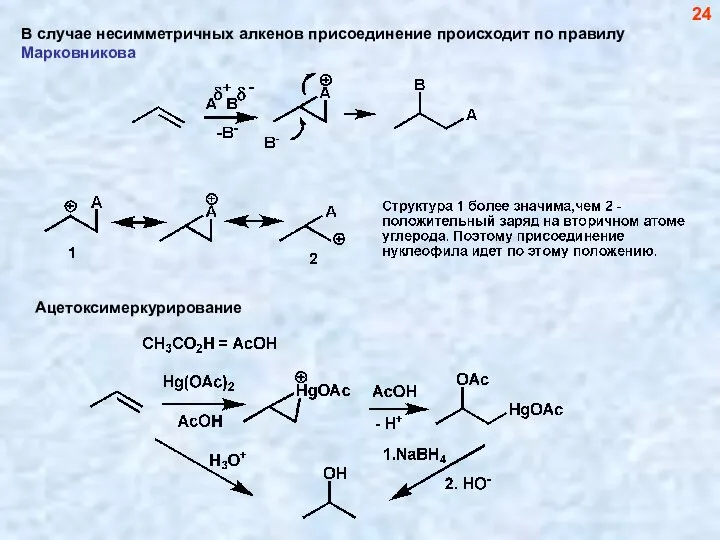
- 24. В случае несимметричных алкенов присоединение происходит по правилу Марковникова 24
- 25. 25
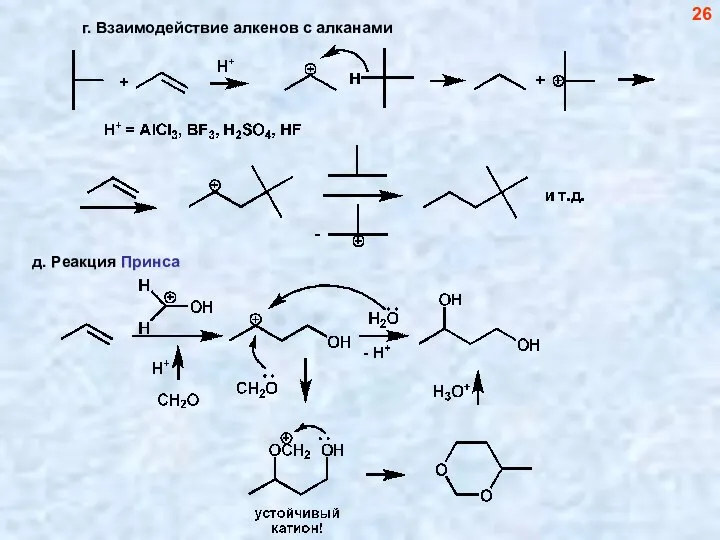
- 26. г. Взаимодействие алкенов с алканами 26
- 27. 27
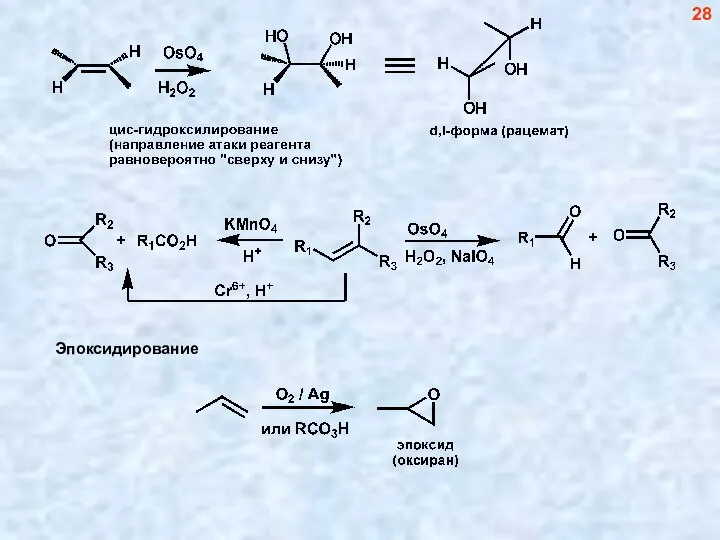
- 28. 28
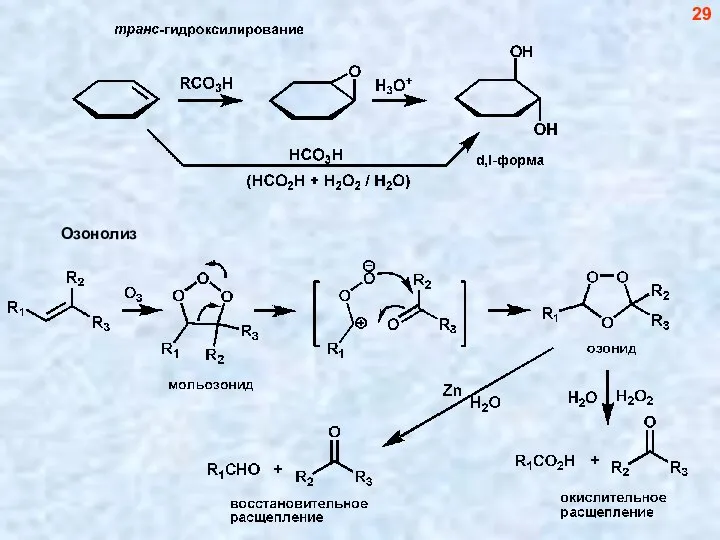
- 29. 29
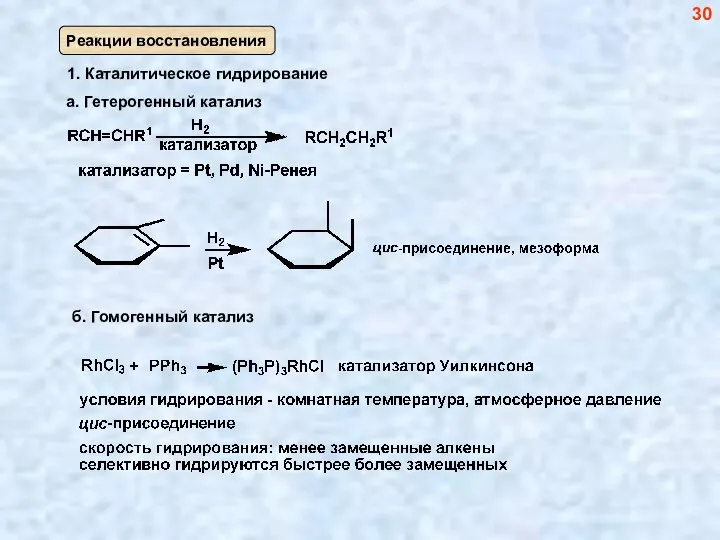
- 30. б. Гомогенный катализ 30
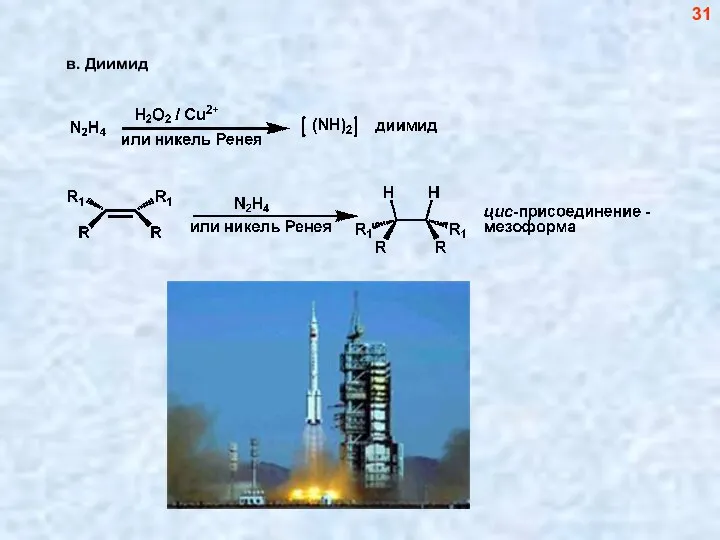
- 31. в. Диимид 31
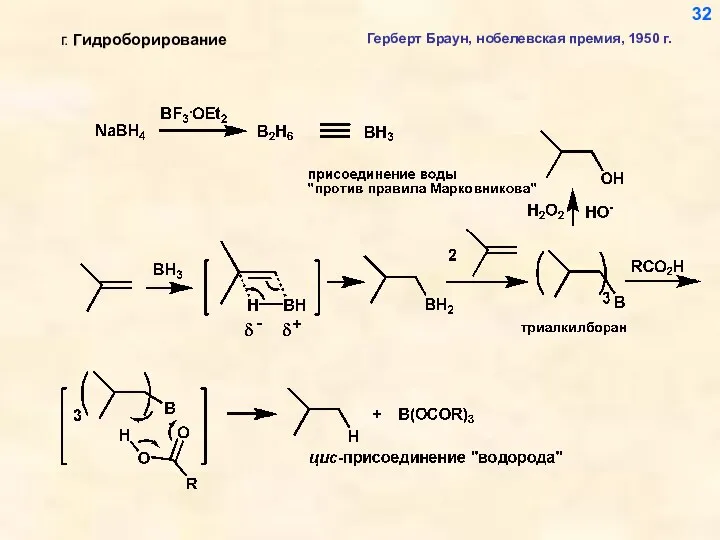
- 32. 32
- 33. 33
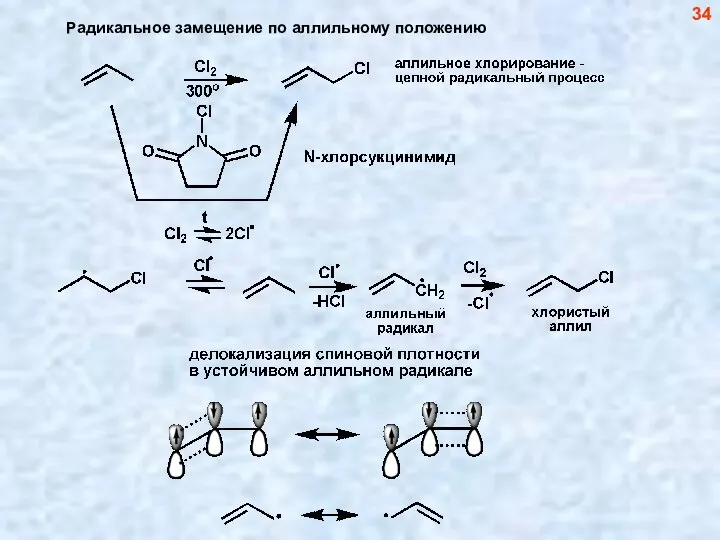
- 34. 34 Радикальное замещение по аллильному положению
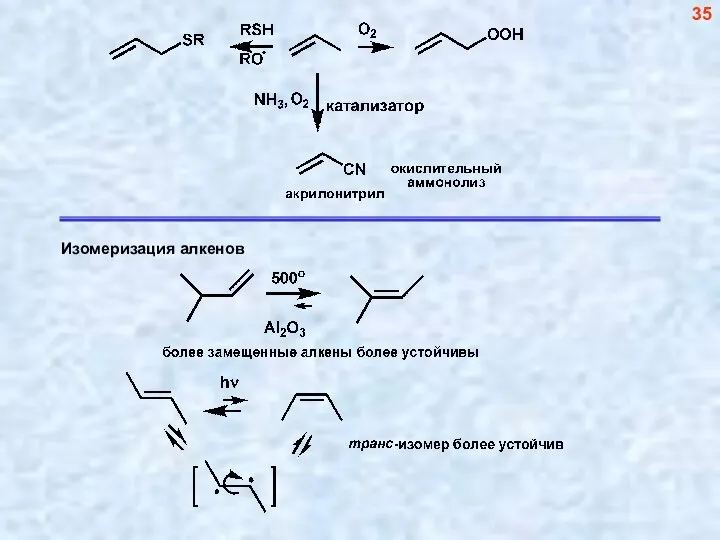
- 35. 35
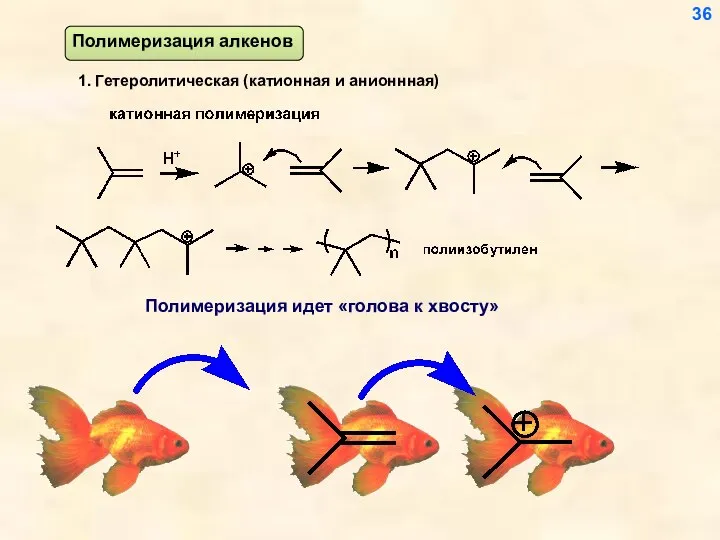
- 36. 1. Гетеролитическая (катионная и анионнная) Полимеризация идет «голова к хвосту» 36
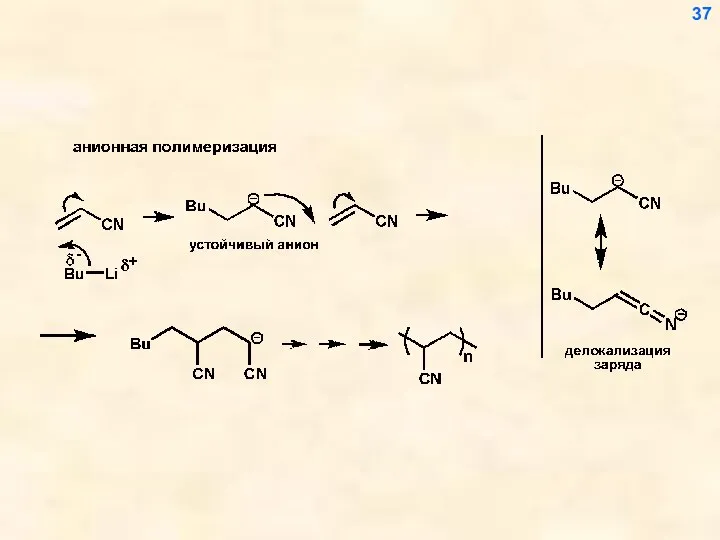
- 37. 37
- 38. 38
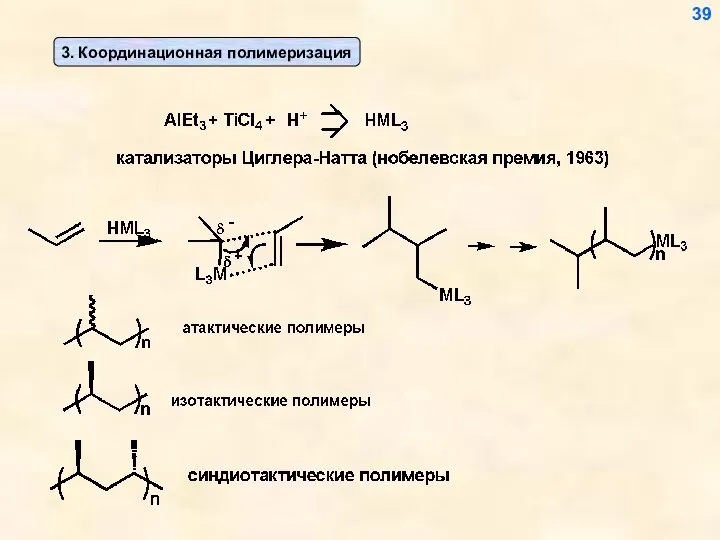
- 39. 39
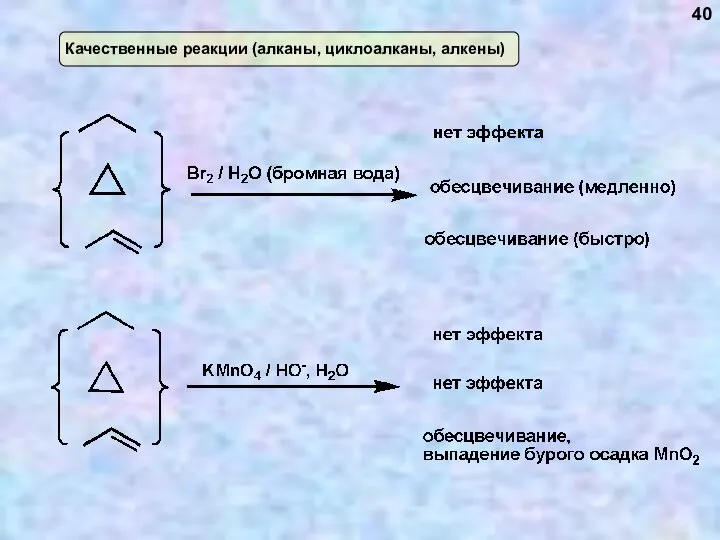
- 40. Качественные реакции (алканы, циклоалканы, алкены) 40
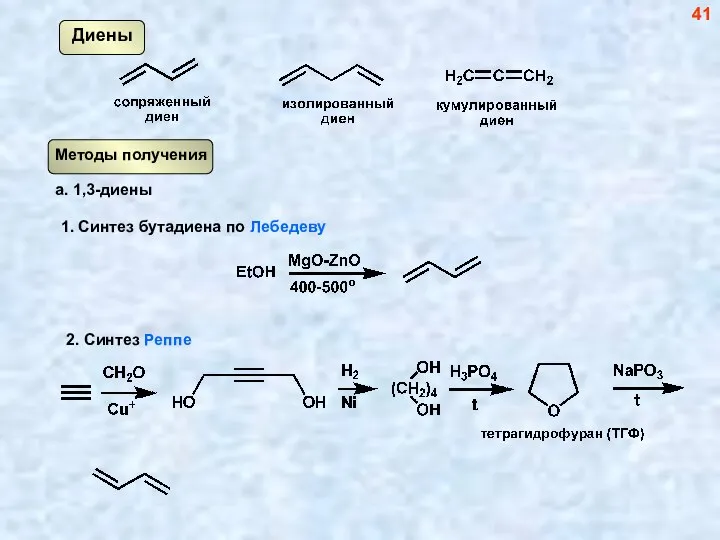
- 41. Диены 41
- 42. 42
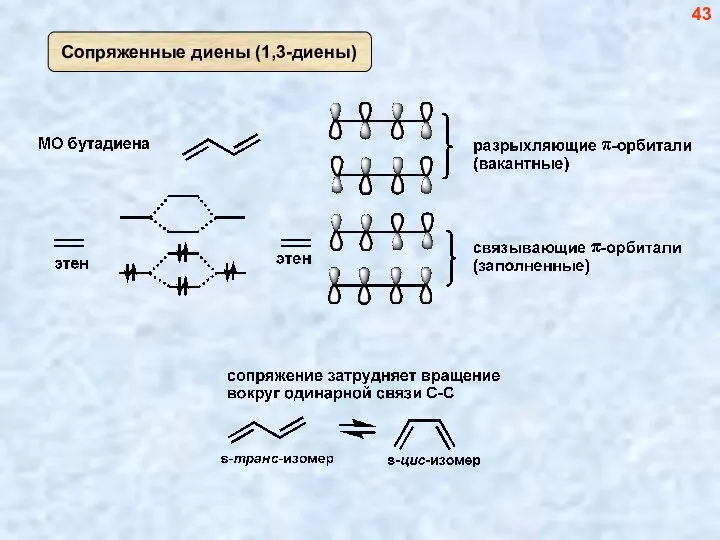
- 43. 43
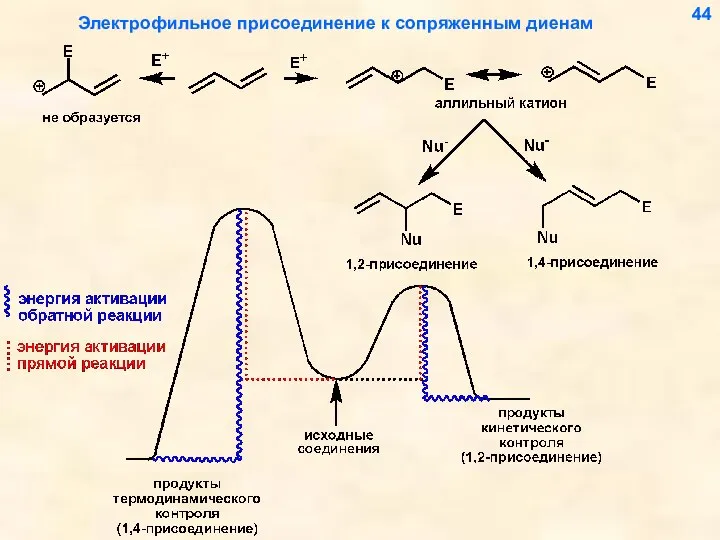
- 44. Электрофильное присоединение к сопряженным диенам 44
- 45. 45
- 46. Радикальное присоединение происходит преимущественно по типу 1,4-присоединения (термодинамический контроль) 46
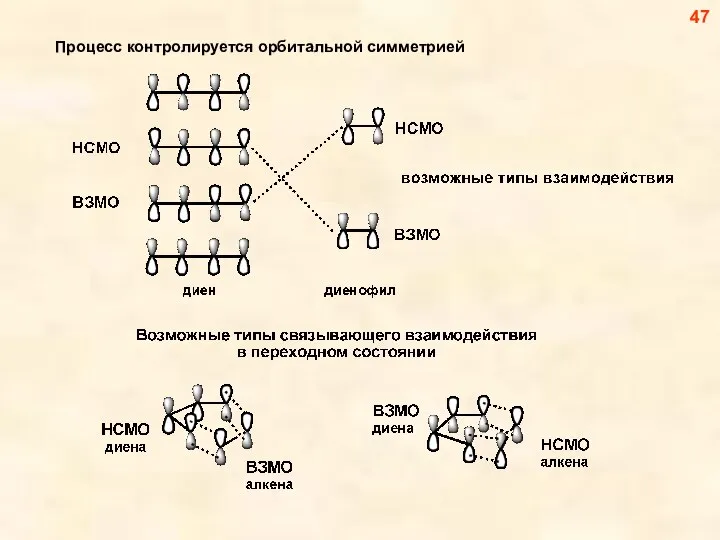
- 47. Процесс контролируется орбитальной симметрией 47
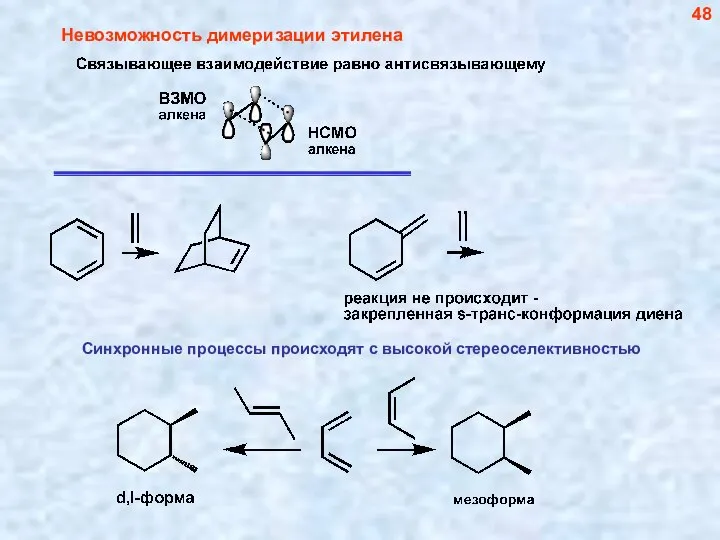
- 48. Невозможность димеризации этилена 48
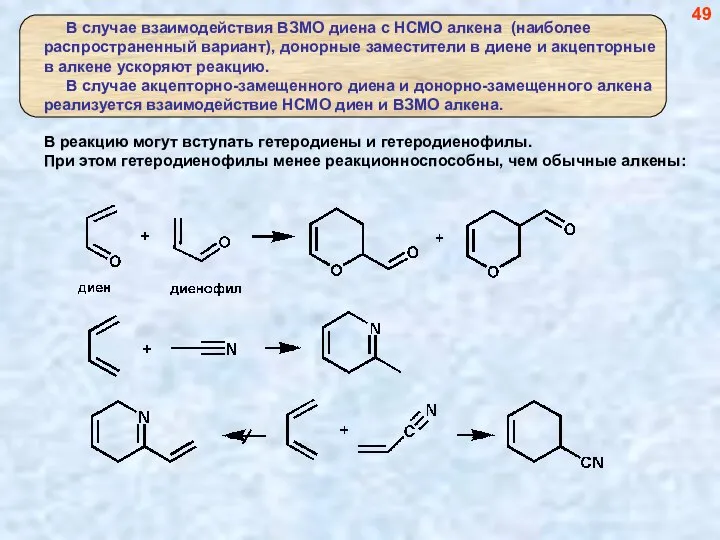
- 49. 49 В реакцию могут вступать гетеродиены и гетеродиенофилы. При этом гетеродиенофилы менее реакционноспособны, чем обычные алкены:
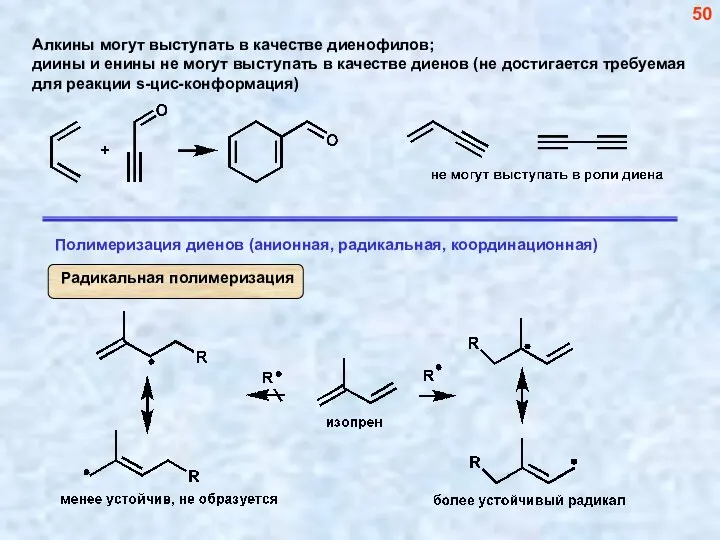
- 50. 50
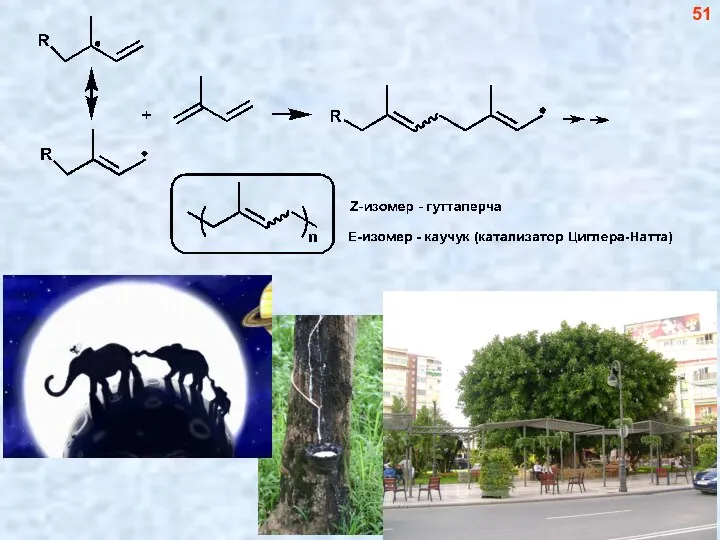
- 51. 51
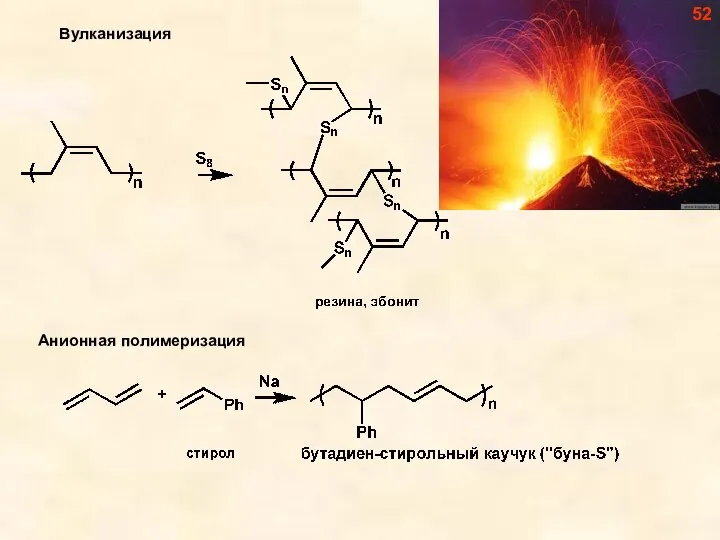
- 52. 52
- 53. 53
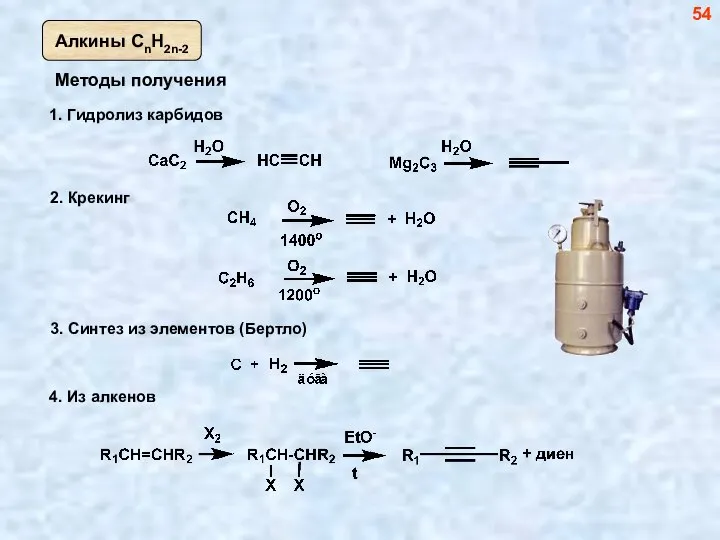
- 54. Методы получения 2. Крекинг 54
- 55. 55
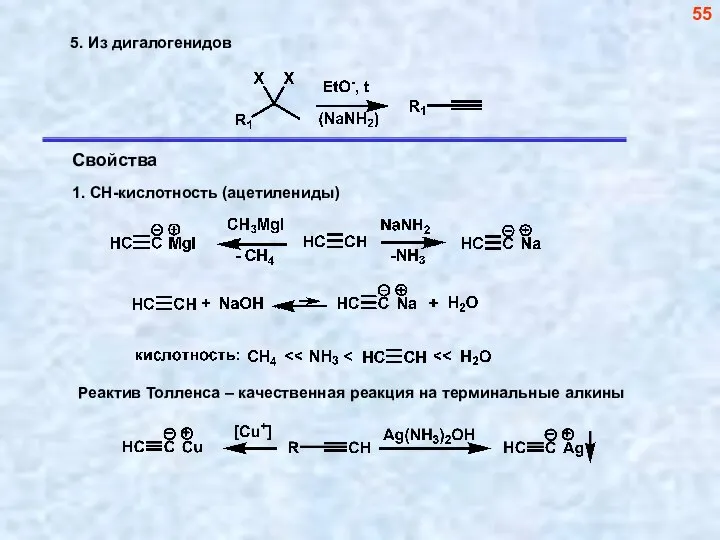
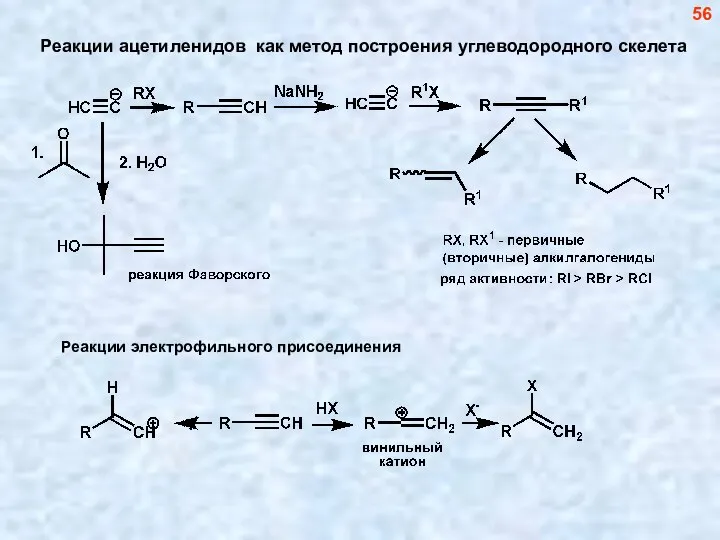
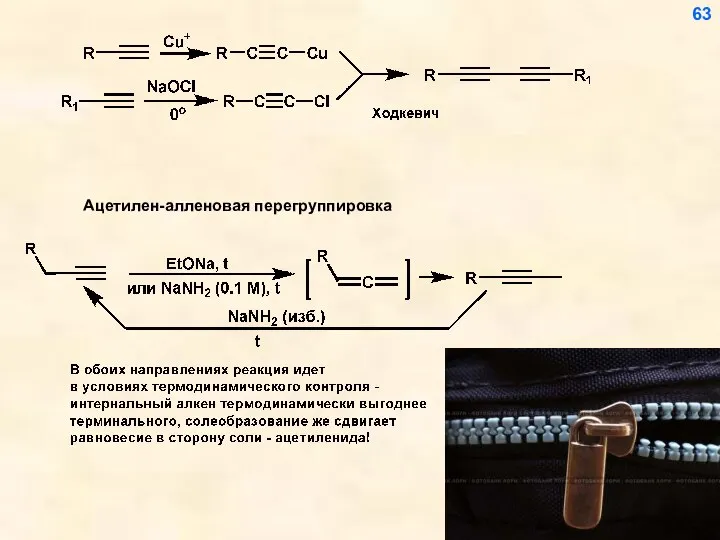
- 56. Реакции ацетиленидов как метод построения углеводородного скелета 56
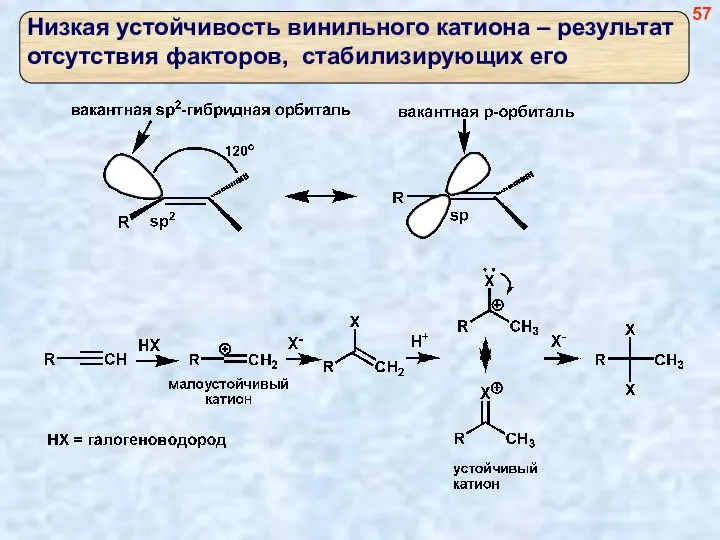
- 57. 57
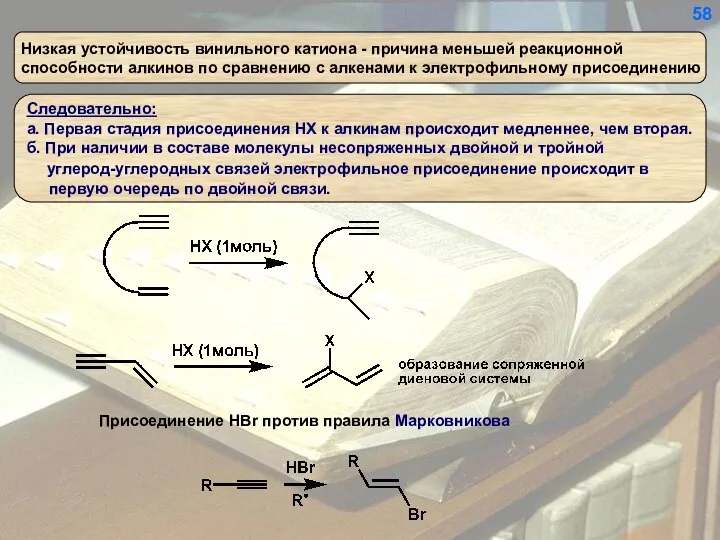
- 58. 58
- 59. 59
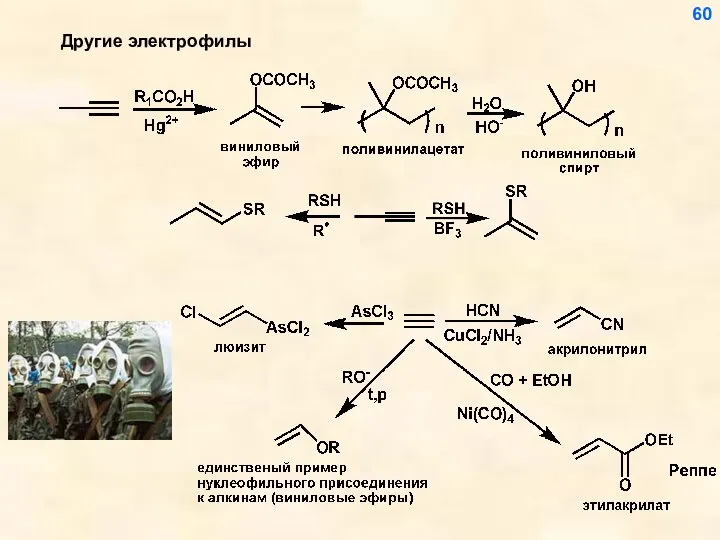
- 60. Другие электрофилы 60
- 61. Реакции восстановления 61
- 62. 62
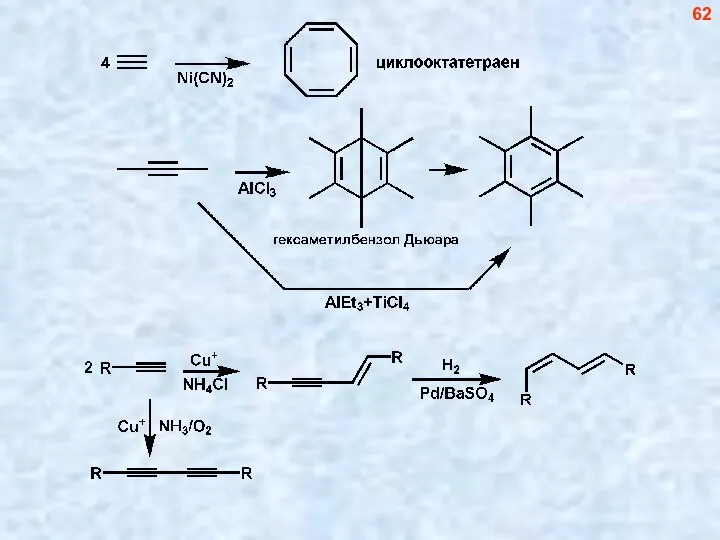
- 63. 63
- 64. 64
- 65. 65
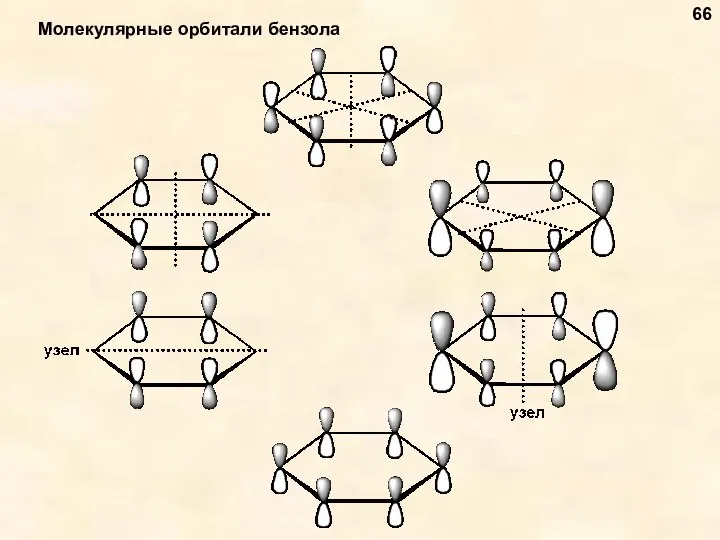
- 66. Молекулярные орбитали бензола 66
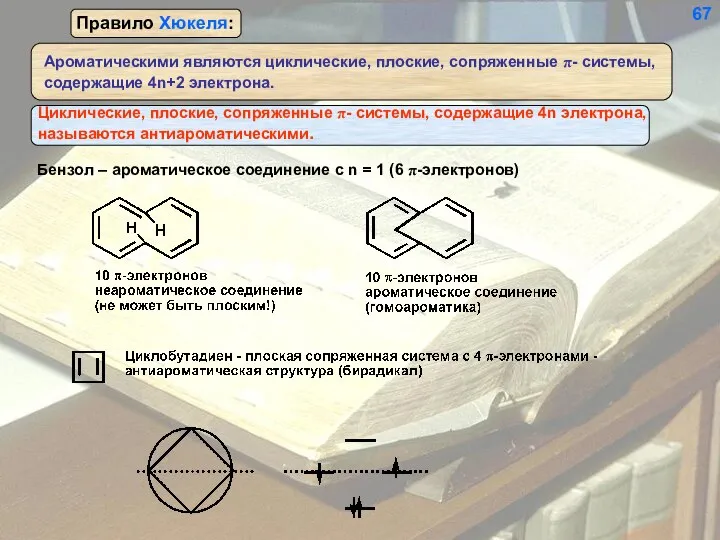
- 67. Бензол – ароматическое соединение с n = 1 (6 π-электронов) 67
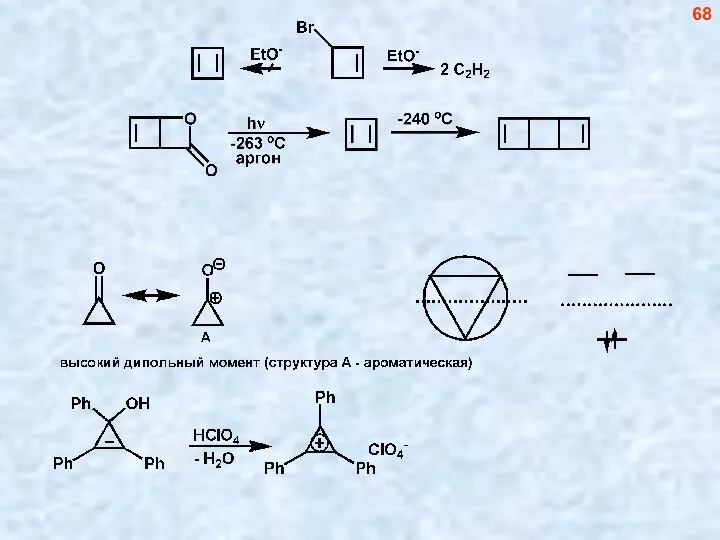
- 68. 68
- 69. 69
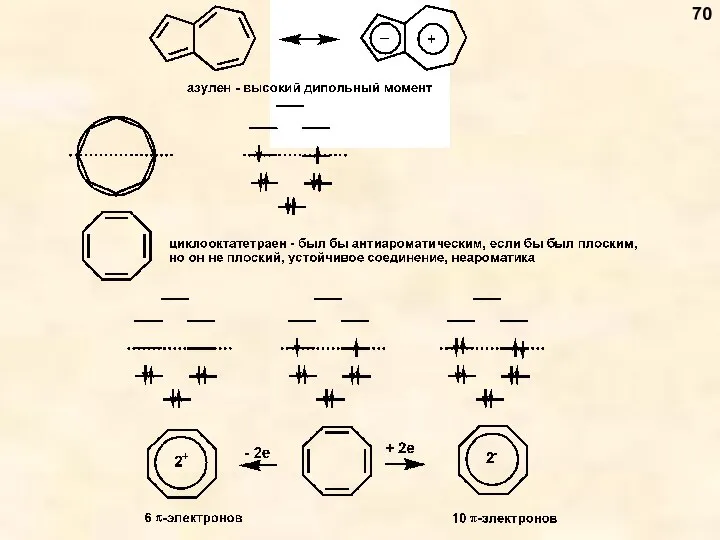
- 70. 70
- 71. Гетероароматичность 71
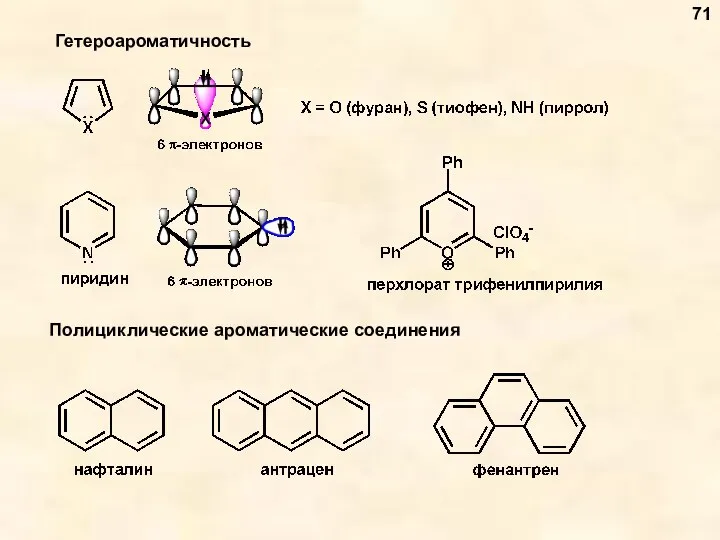
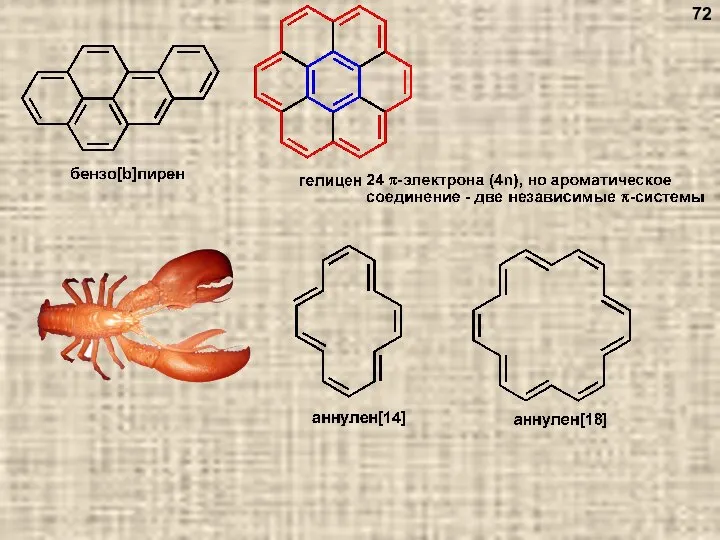
- 72. 72
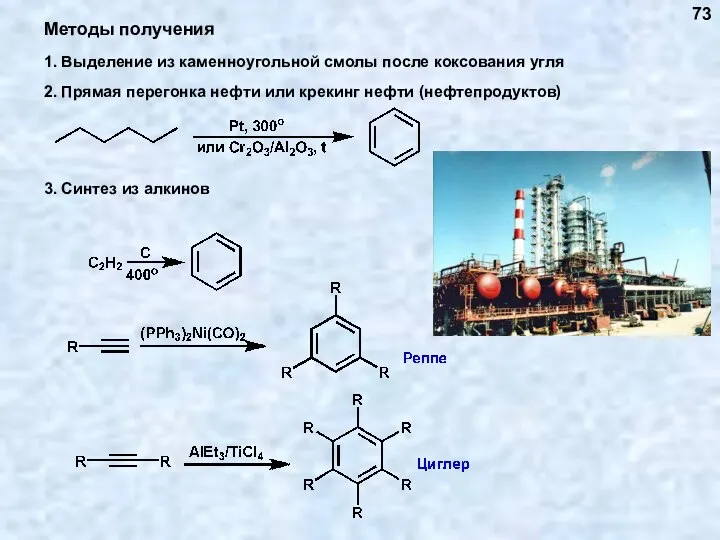
- 73. 1. Выделение из каменноугольной смолы после коксования угля 73
- 74. 74
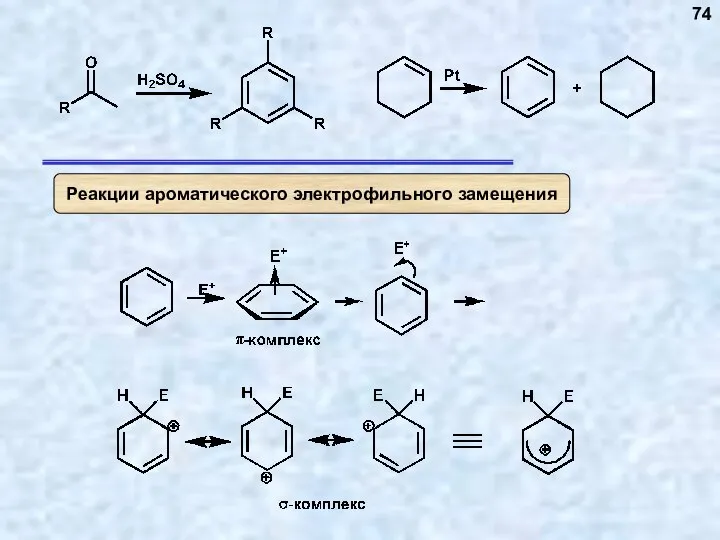
- 75. 75
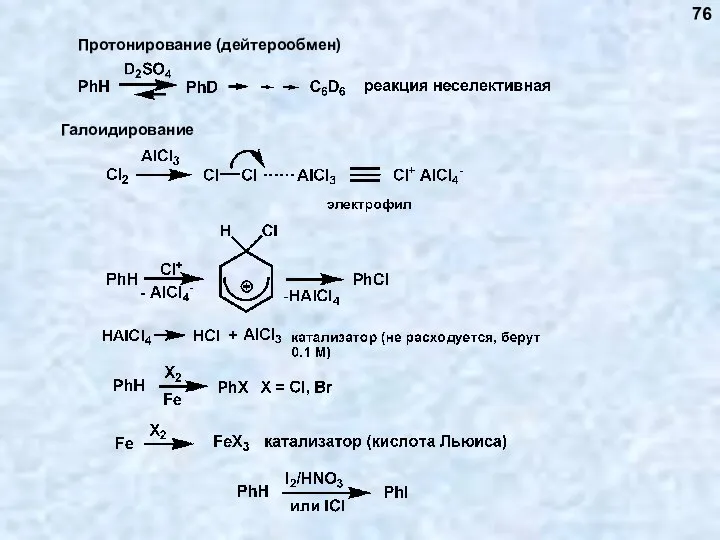
- 76. 76
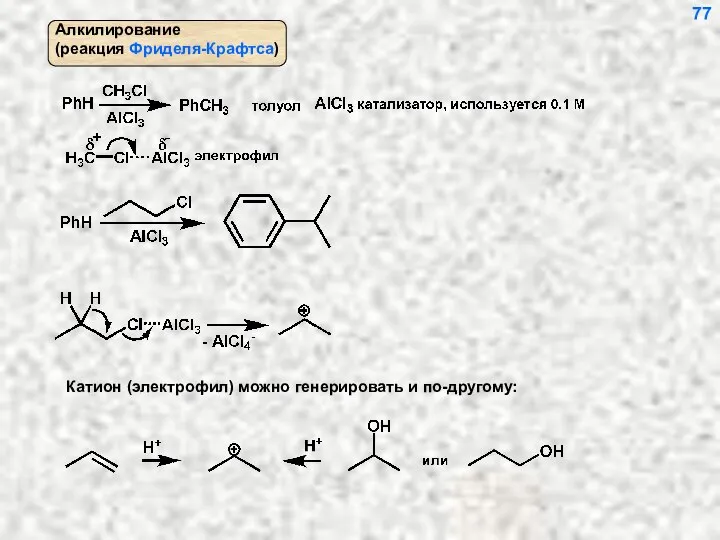
- 77. 77
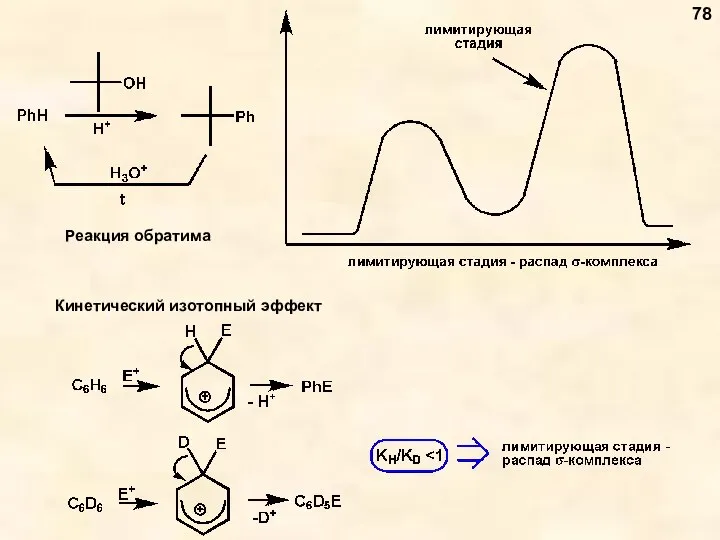
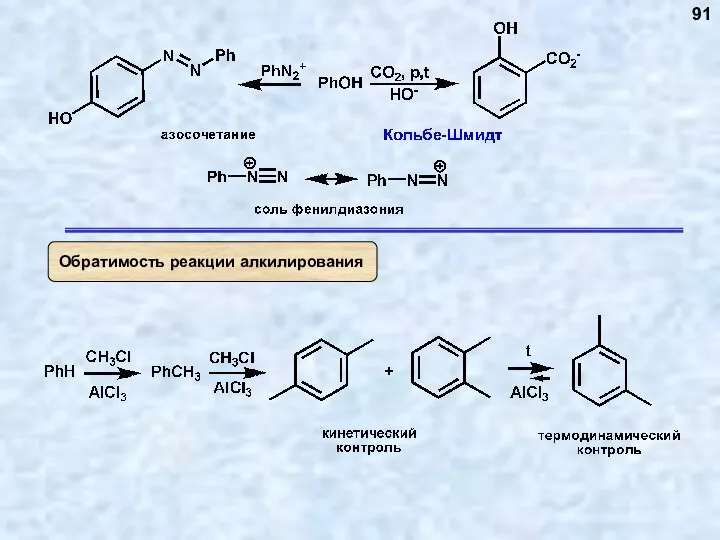
- 78. Реакция обратима 78
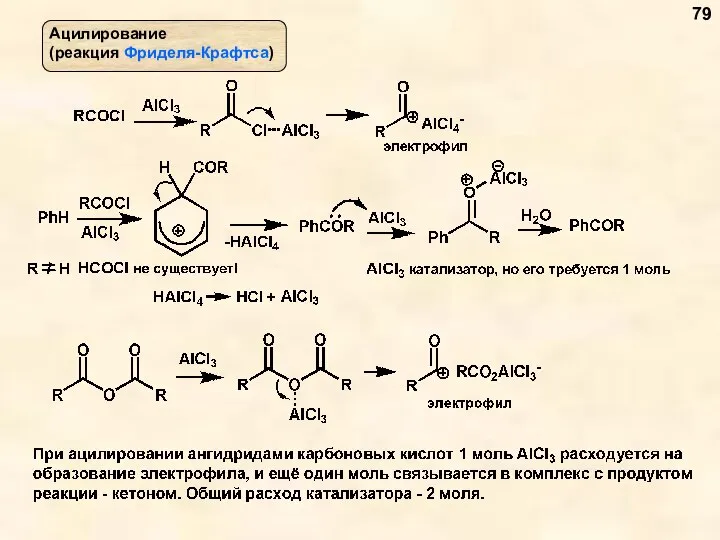
- 79. 79
- 80. 80
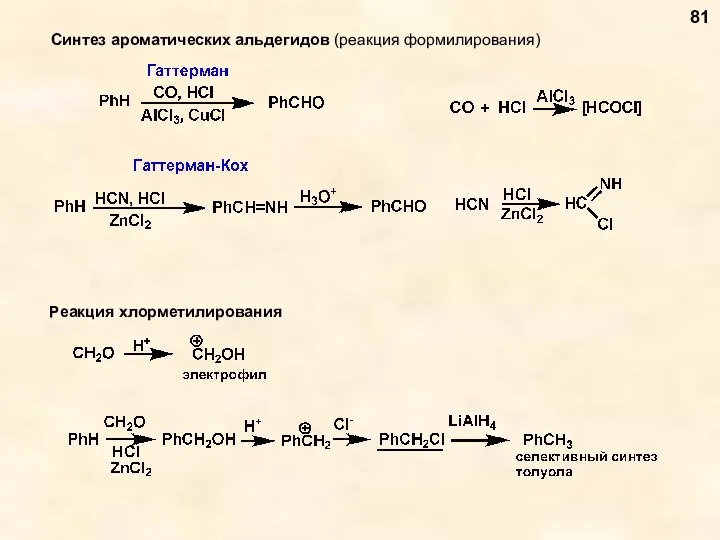
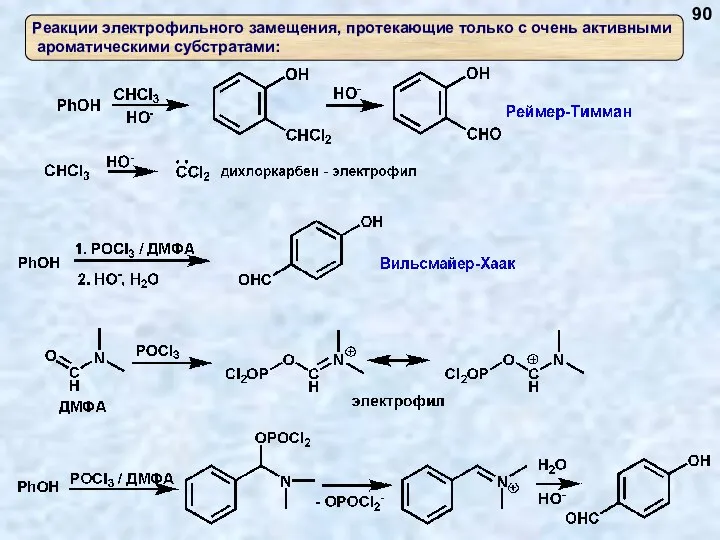
- 81. Синтез ароматических альдегидов (реакция формилирования) 81
- 82. Взаимодействие с альдегидами 82
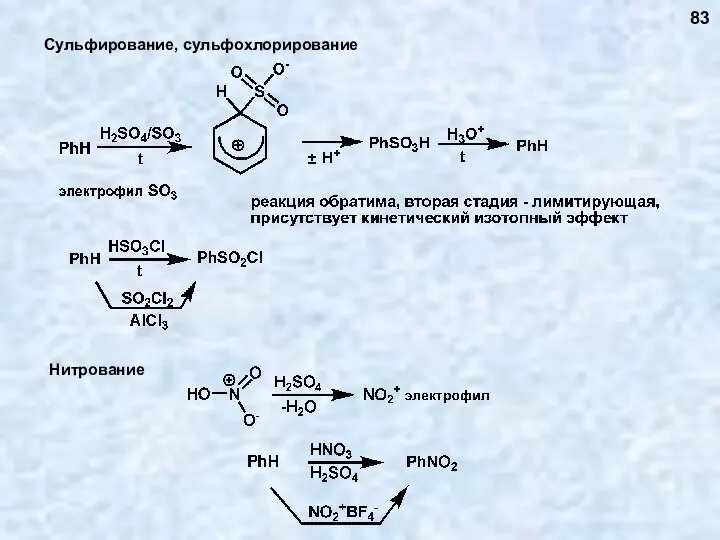
- 83. Сульфирование, сульфохлорирование 83
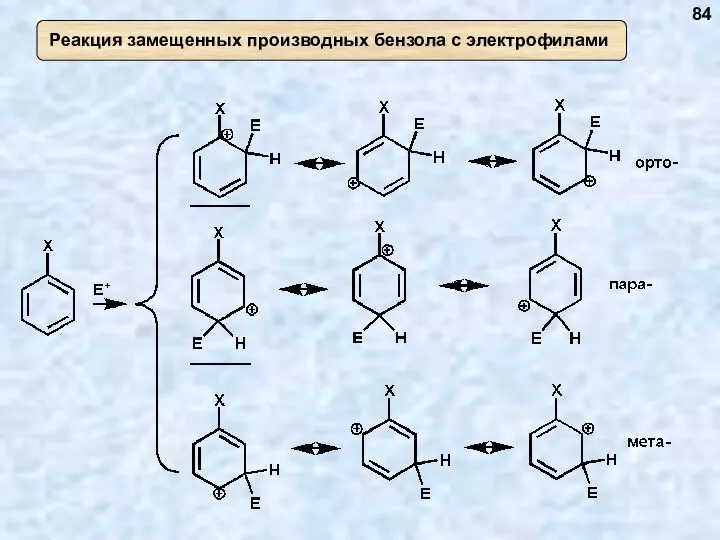
- 84. 84
- 85. 85
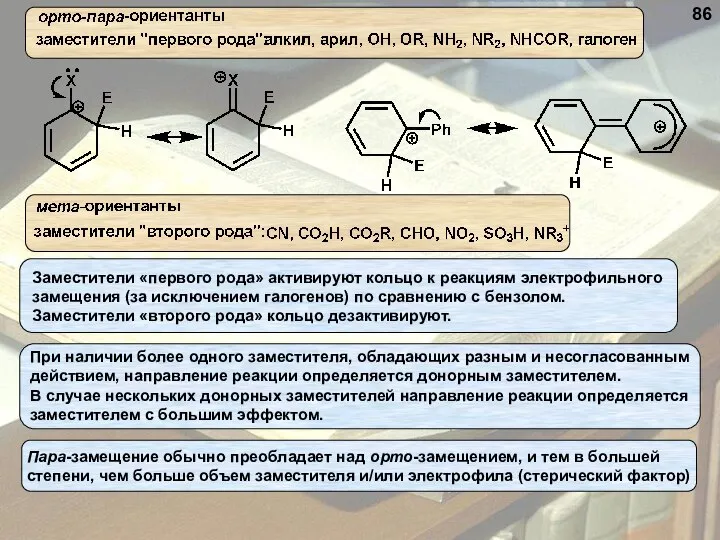
- 86. 86
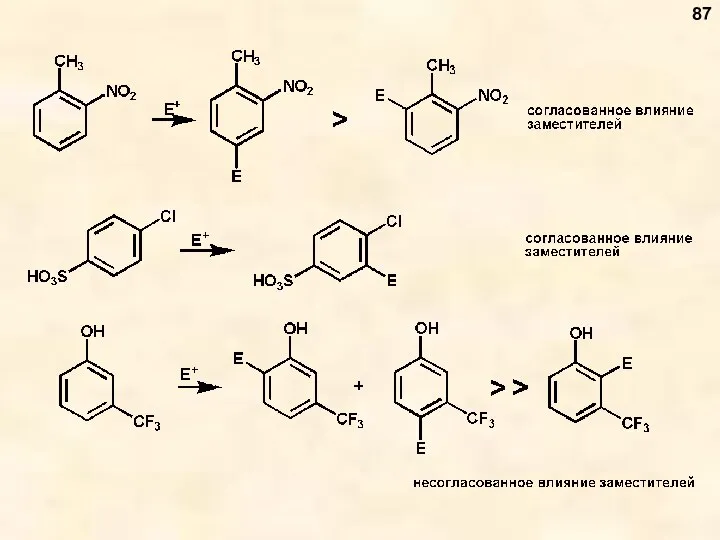
- 87. 87
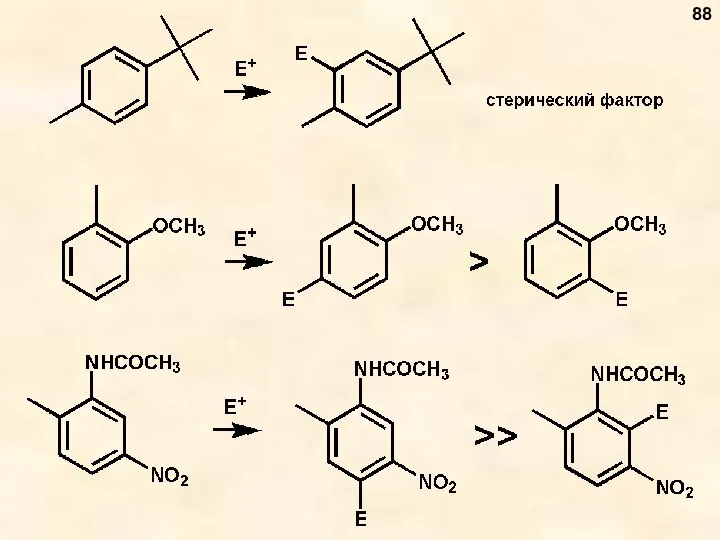
- 88. 88
- 89. 1. Реакции Фриделя-Крафтса (алкилирование, ацилирование) 3. Реакция хлорметилирования 4. Реакции формилирования (Гаттермана и Гаттермана-Коха) 5. Кислотно-катализируемые
- 90. 90
- 91. 91
- 92. 92
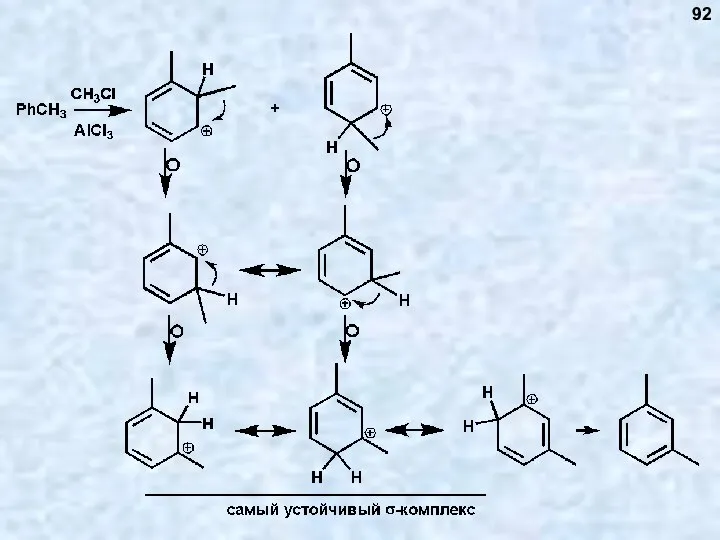
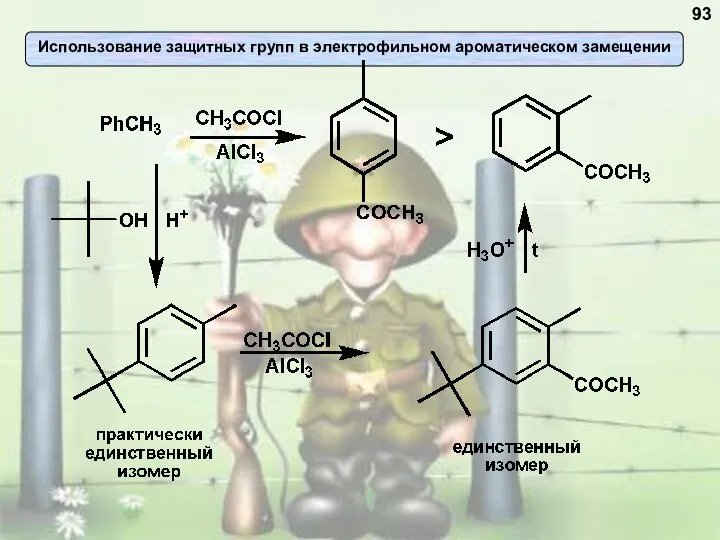
- 93. 93
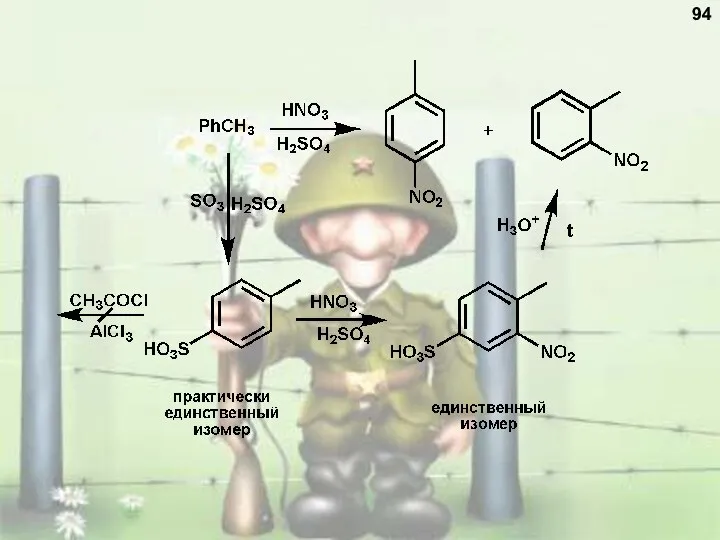
- 94. 94
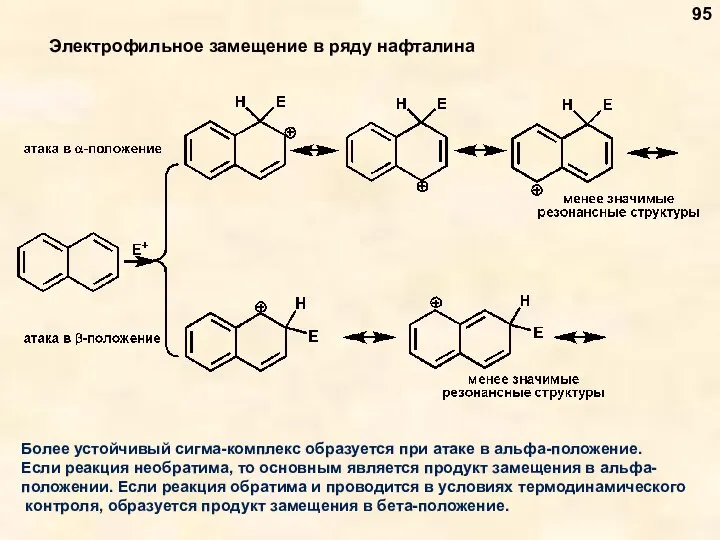
- 95. Электрофильное замещение в ряду нафталина Более устойчивый сигма-комплекс образуется при атаке в альфа-положение. Если реакция необратима,
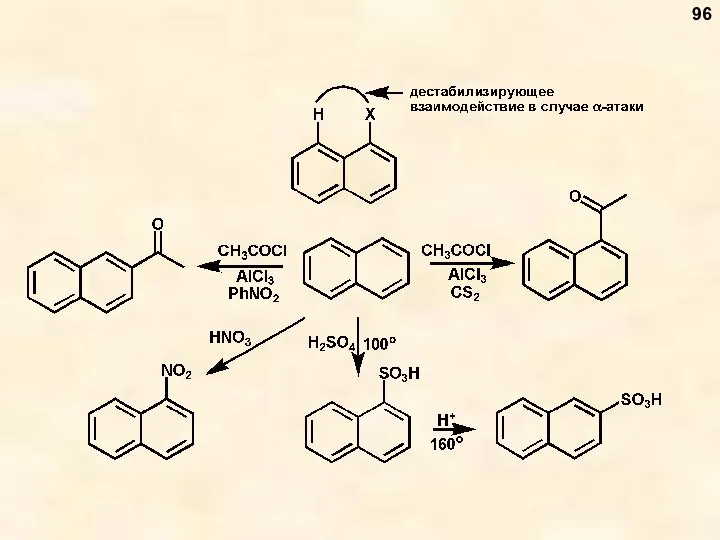
- 96. 96
- 97. 97
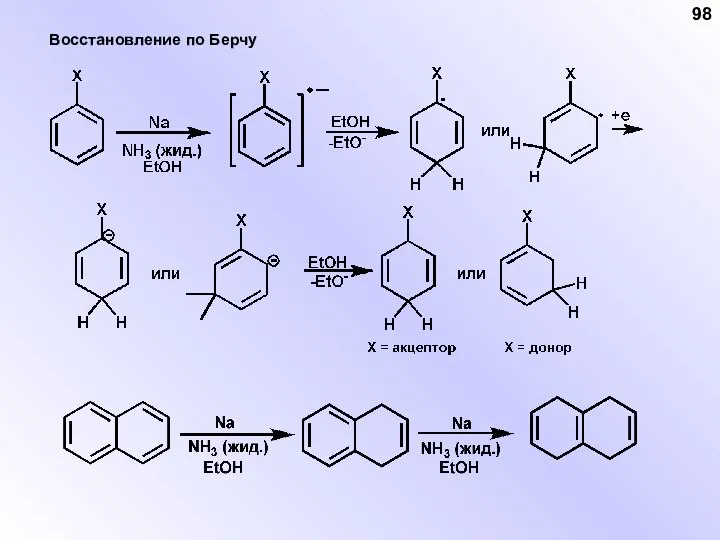
- 98. Восстановление по Берчу 98
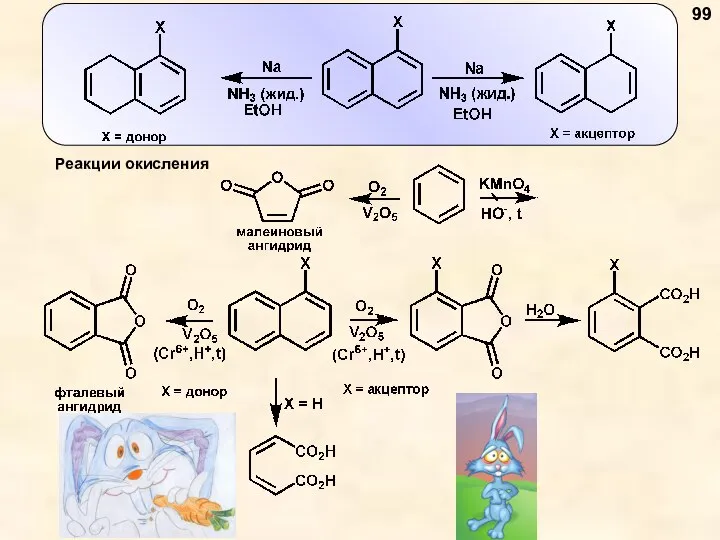
- 99. 99
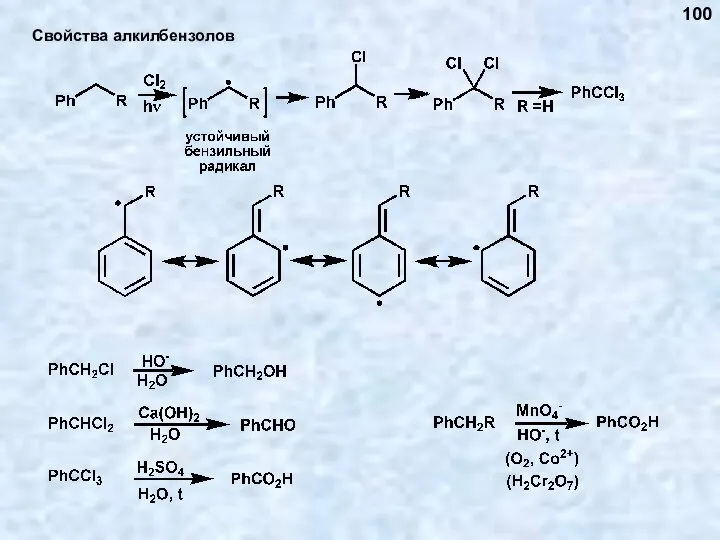
- 100. Свойства алкилбензолов 100
- 101. 101
- 103. Скачать презентацию

























 Химия: основные понятия
Химия: основные понятия Функции металлов в истинном металлоферменте. (Лекция 16)
Функции металлов в истинном металлоферменте. (Лекция 16) Методы диагностики плазмы
Методы диагностики плазмы Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Дифференциация магмы
Дифференциация магмы Основные классы неорганических соединений
Основные классы неорганических соединений Предельные углеводороды
Предельные углеводороды Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Кинетика химических реакций
Кинетика химических реакций Chemical reactions. (Chapter 5)
Chemical reactions. (Chapter 5) Условная оптимизация методом классического математического анализа с применением множителей
Условная оптимизация методом классического математического анализа с применением множителей Фармацевтичний аналіз
Фармацевтичний аналіз Фосфор
Фосфор Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Алкалоидтар
Алкалоидтар Metals
Metals Гидролиз органических веществ
Гидролиз органических веществ Мел - полезное ископаемое моего села
Мел - полезное ископаемое моего села Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть
Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть  Э.М. Спиридонов. Эволюция минералов ртути в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов ртути в зоне гипергенеза Использование активных методов обучения на уроках химии
Использование активных методов обучения на уроках химии Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Vitaminele
Vitaminele Основні методи синтезу та стабілізації наносистем
Основні методи синтезу та стабілізації наносистем Фенолы. Физические свойства
Фенолы. Физические свойства Химическая связь
Химическая связь Липиды омыляемые и неомыляемые
Липиды омыляемые и неомыляемые