Содержание
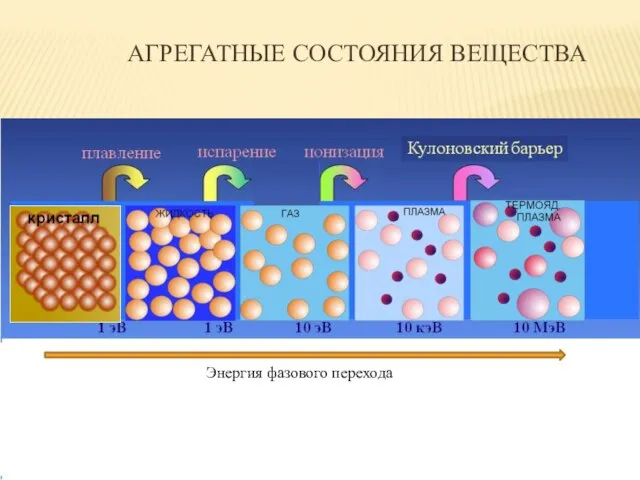
- 2. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА Энергия фазового перехода
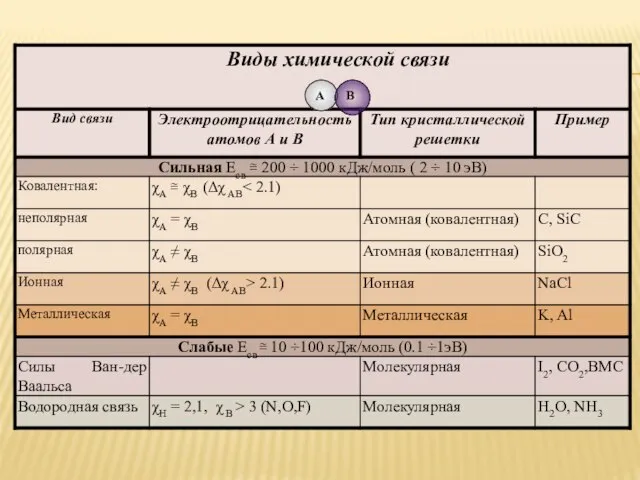
- 3. Химическая связь – это совокупность сил, действующих между атомами в молекуле или кристалле. Химическая связь имеет
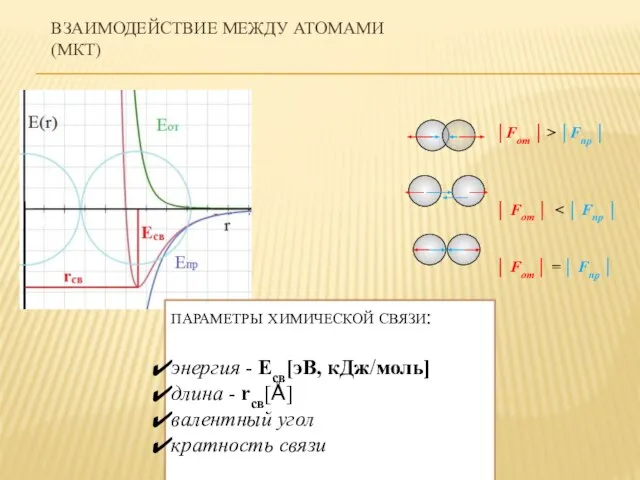
- 4. ВЗАИМОДЕЙСТВИЕ МЕЖДУ АТОМАМИ (МКТ) │Fот │ > │Fпр │ │ Fот │ │ Fот │ =
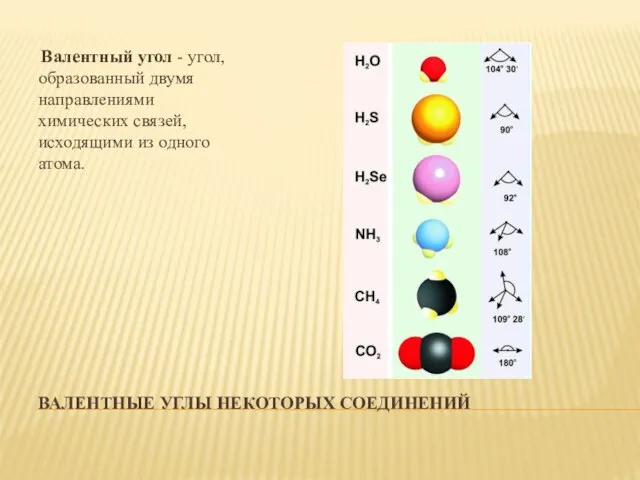
- 5. ВАЛЕНТНЫЕ УГЛЫ НЕКОТОРЫХ СОЕДИНЕНИЙ Валентный угол - угол, образованный двумя направлениями химических связей, исходящими из одного
- 6. А В
- 7. СПОСОБЫ ОПИСАНИЯ ХИМИЧЕСКОЙ СВЯЗИ Ковалентная связь
- 8. ЭЛЕКТРОННАЯ ТЕОРИЯ ХИМИЧЕСКОЙ СВЯЗИ (1912-1915г.) 1875 - 1946 Льюис, Гилберт Ньютон Ковалентная химическая связь образуется за
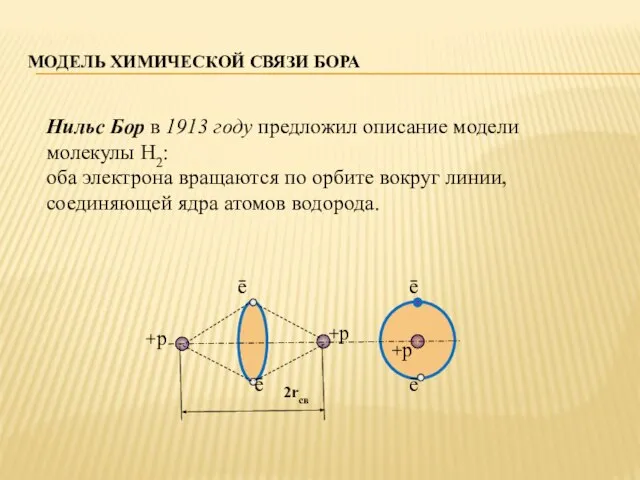
- 9. МОДЕЛЬ ХИМИЧЕСКОЙ СВЯЗИ БОРА Нильс Бор в 1913 году предложил описание модели молекулы Н2: оба электрона
- 10. КВАНТОВО-МЕХАНИЧЕСКОЕ ОПИСАНИЕ Приближенное решение уравнений Шредингера Фриц Лондон (1900 -1954) Вальтер Гайтлер (1904 -1981) Ф. Лондон
- 11. Метод валентных связей Основные принципы образования химической связи по методу ВС: Химическая связь образуется только в
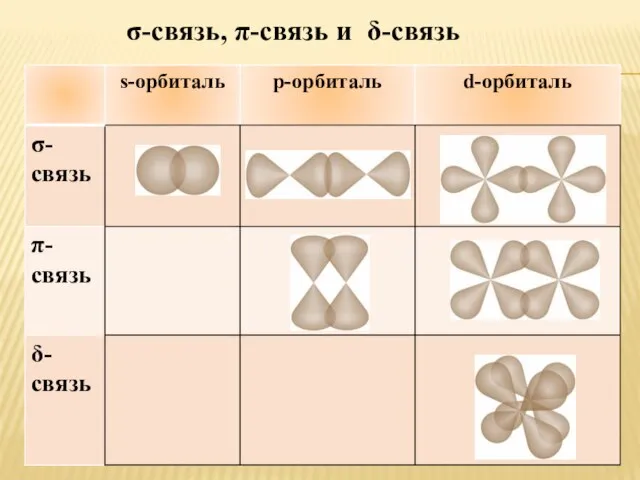
- 12. σ-связь, π-связь и δ-связь
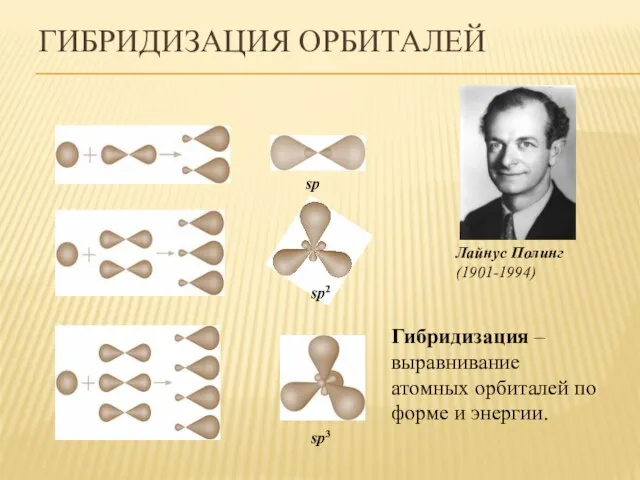
- 13. ГИБРИДИЗАЦИЯ ОРБИТАЛЕЙ sp2 sp sp3 Гибридизация – выравнивание атомных орбиталей по форме и энергии. Лайнус Полинг
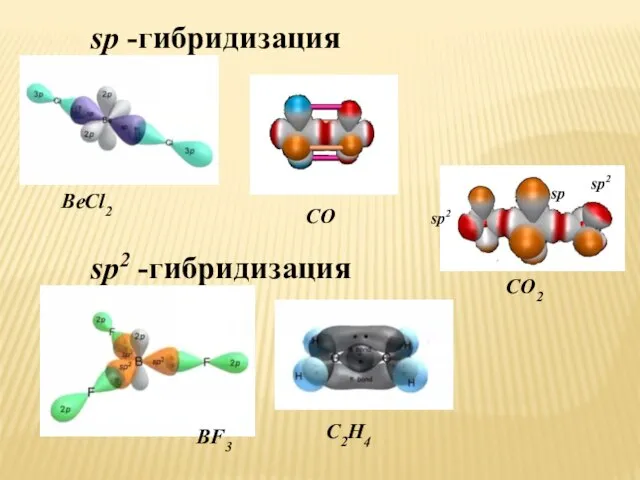
- 14. sp -гибридизация BeCl2 BF3 CО2 CО sp2 -гибридизация C2Н4 sp2 sp2 sp
- 15. sp3 -гибридизация H2О NH3 CН4
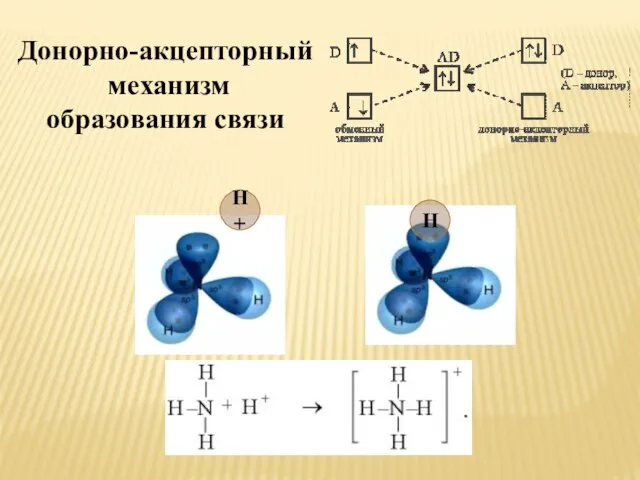
- 16. Донорно-акцепторный механизм образования связи Н+ Н
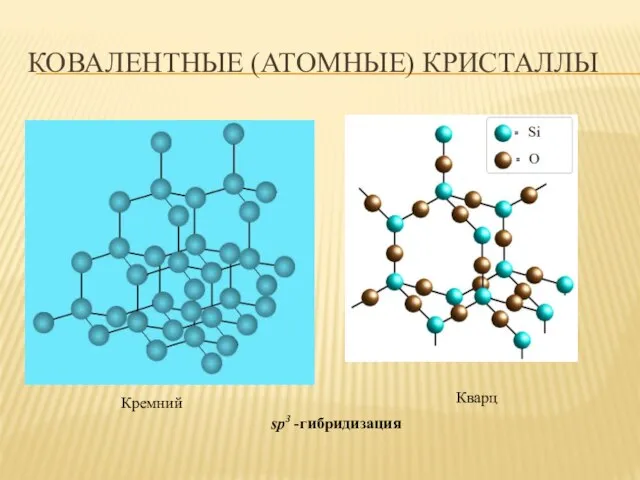
- 17. КОВАЛЕНТНЫЕ (АТОМНЫЕ) КРИСТАЛЛЫ Кремний Кварц sp3 -гибридизация
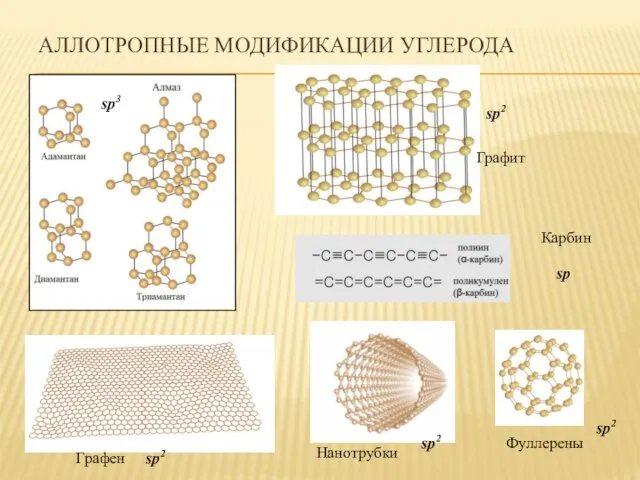
- 18. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ УГЛЕРОДА Графит Фуллерены Карбин Графен sp3 sp2 sp2 sp2 sp2 Нанотрубки sp
- 19. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Молекула рассматривается как единая частица. Каждый электрон в молекуле находиться в результирующем поле
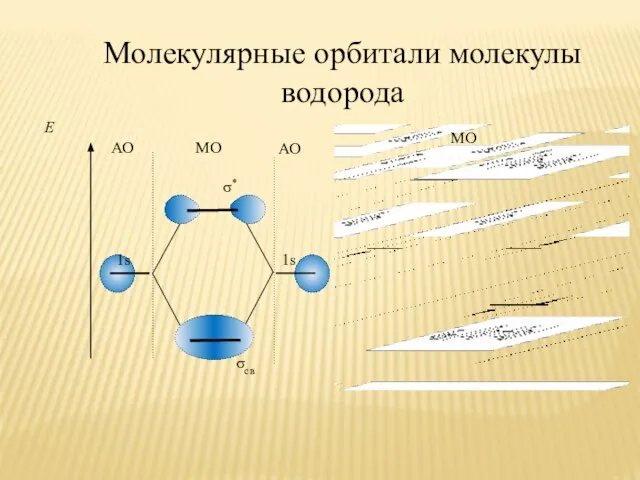
- 20. Молекулярные орбитали молекулы водорода
- 21. МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ СO диамагнетик СO [σсв(s)]2 [σ(s) р]2[σсв(px)]2[πсв(py)]2[πсв(pz)]2 σ*
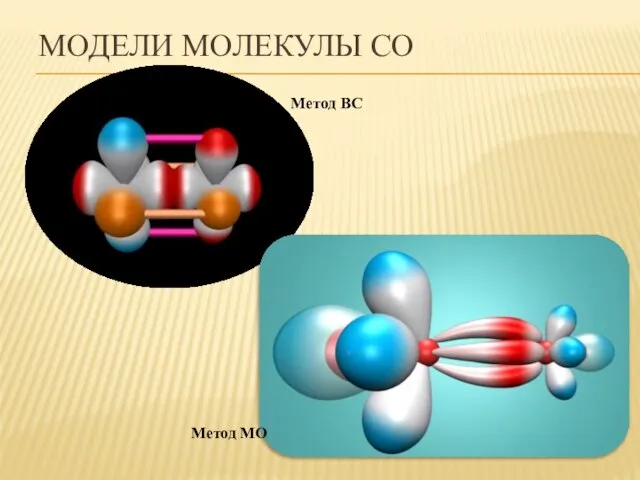
- 22. МОДЕЛИ МОЛЕКУЛЫ СО Метод ВС Метод МО
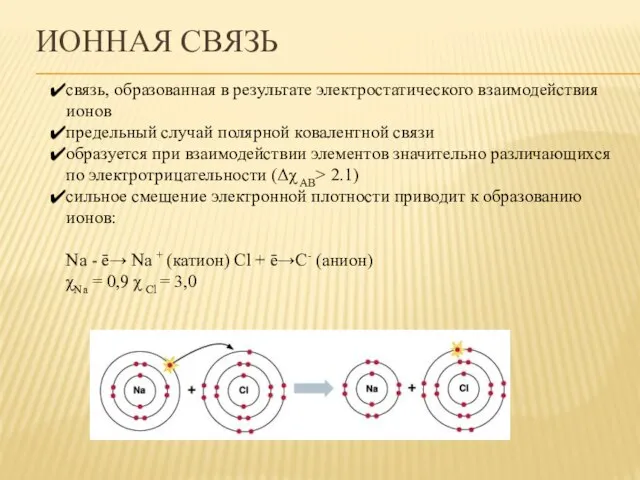
- 23. ИОННАЯ СВЯЗЬ связь, образованная в результате электростатического взаимодействия ионов предельный случай полярной ковалентной связи образуется при
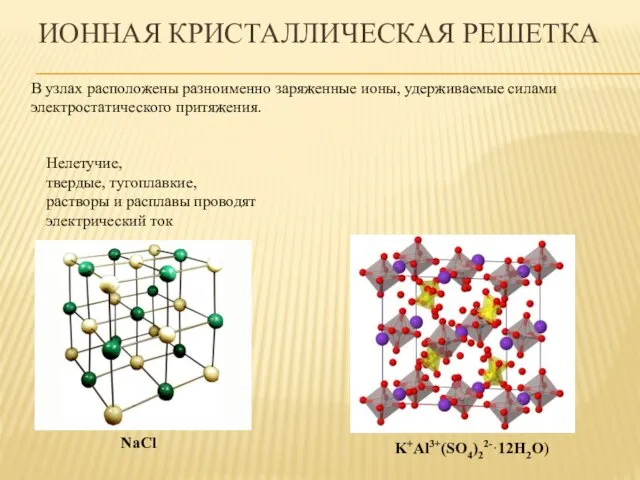
- 24. ИОННАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА K+Al3+(SO4)22-·12H2O) NaCl В узлах расположены разноименно заряженные ионы, удерживаемые силами электростатического притяжения. Нелетучие,
- 25. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ В узлах кристаллической решётки -ионы металла. Связь осуществляется за счет делокализованных электронов внешнего уровня
- 26. ПОВЕРХНОСТЬ МЕТАЛЛА ПОД ЭЛЕКТРОННЫМ МИКРОСКОПОМ Si Li
- 27. МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ Диполь - система из двух разноименных, но равных по величине электрических зарядов на некотором
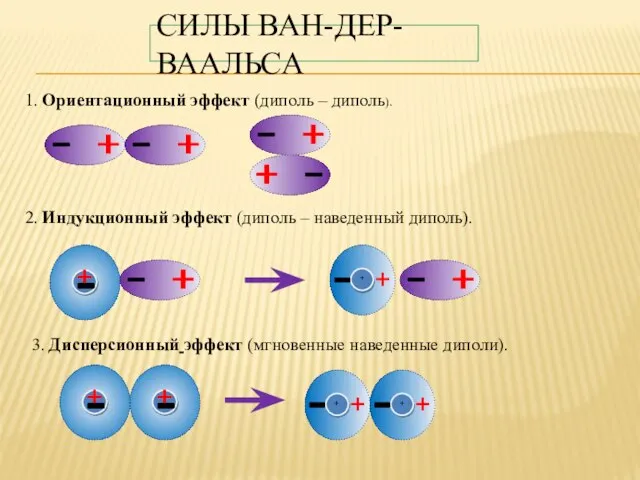
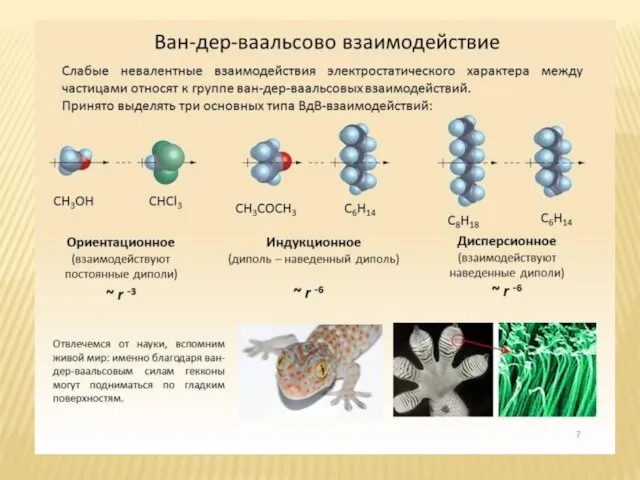
- 28. СИЛЫ ВАН-ДЕР-ВААЛЬСА 1. Ориентационный эффект (диполь – диполь). 2. Индукционный эффект (диполь – наведенный диполь). 3.
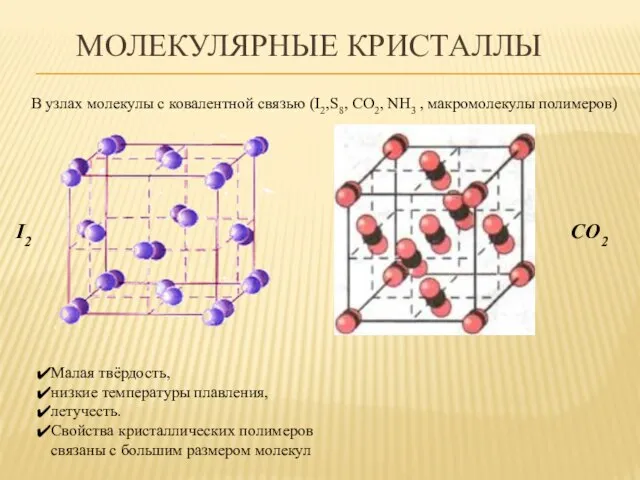
- 30. МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ В узлах молекулы с ковалентной связью (I2,S8, CO2, NH3 , макромолекулы полимеров) I2 CO2
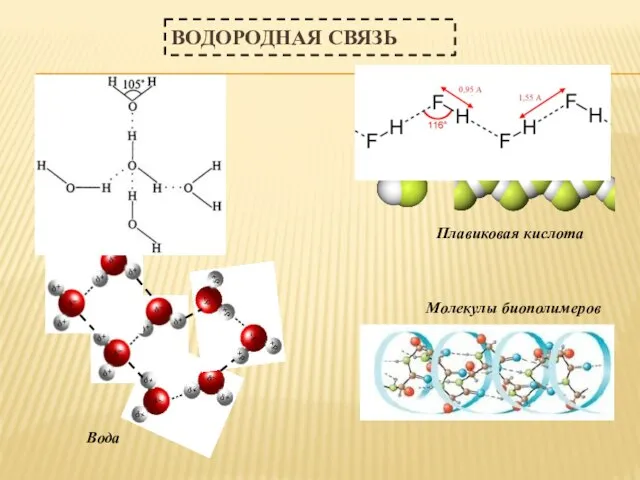
- 31. ВОДОРОДНАЯ СВЯЗЬ Химическая связь, образованная положительно заряженным водородом молекулы и электроотрицательным атомом другой молекулы, называется водородной
- 32. ВОДОРОДНАЯ СВЯЗЬ Вода Плавиковая кислота Молекулы биополимеров
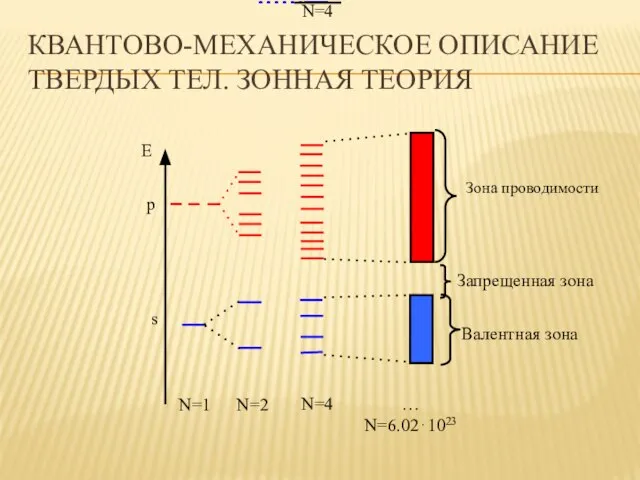
- 33. КВАНТОВО-МЕХАНИЧЕСКОЕ ОПИСАНИЕ ТВЕРДЫХ ТЕЛ. ЗОННАЯ ТЕОРИЯ … N=6.02⋅1023 E N=4 Зона проводимости Валентная зона
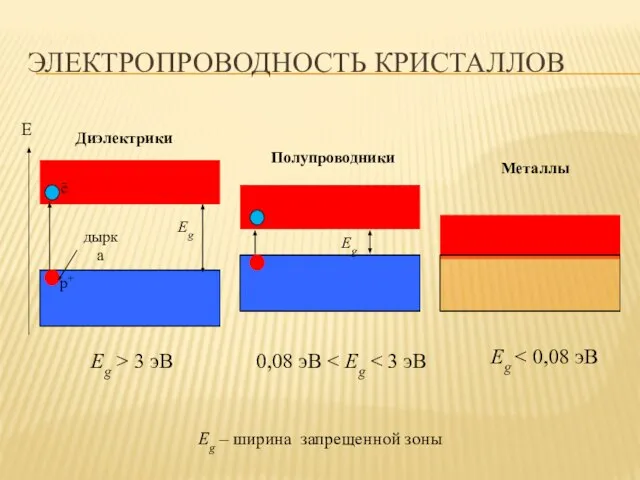
- 34. ЭЛЕКТРОПРОВОДНОСТЬ КРИСТАЛЛОВ Eg – ширина запрещенной зоны Металлы Диэлектрики Полупроводники Eg 0,08 эВ Eg > 3
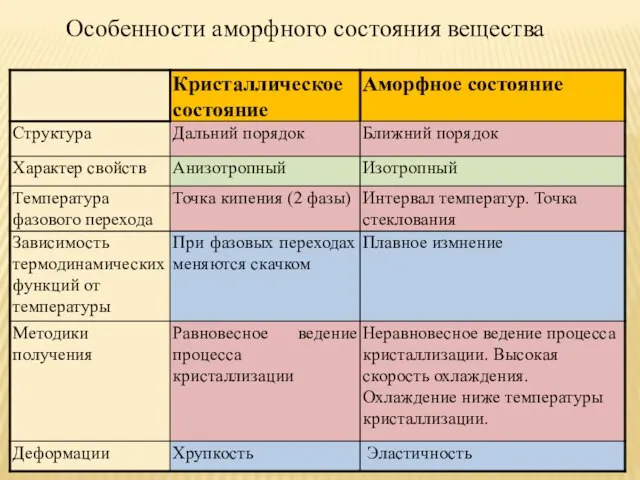
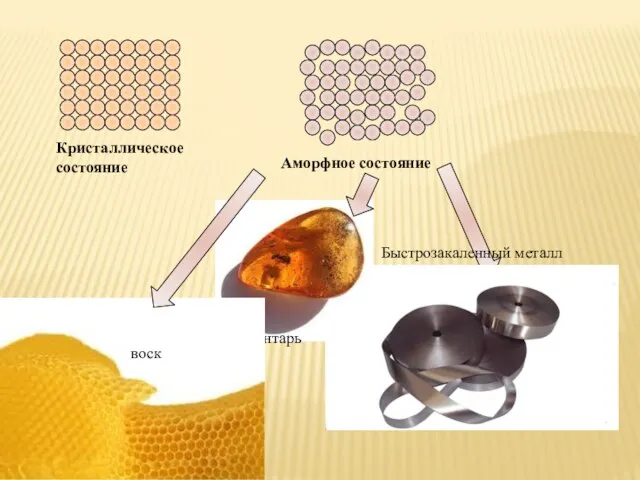
- 35. Особенности аморфного состояния вещества
- 36. Быстрозакаленный металл янтарь воск Кристаллическое состояние Аморфное состояние
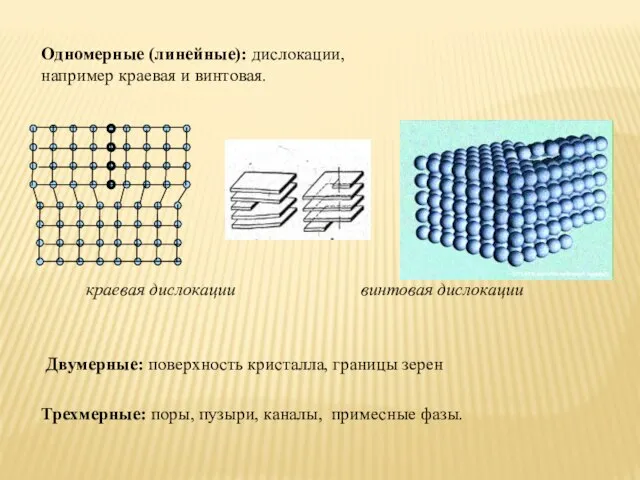
- 37. ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ Нульмерные (точечные): энергетические: фононы – кванты тепловой волны, результат искажения регулярности решетки, вызванные
- 38. Двумерные: поверхность кристалла, границы зерен Одномерные (линейные): дислокации, например краевая и винтовая. Трехмерные: поры, пузыри, каналы,
- 40. Скачать презентацию







![МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ СO диамагнетик СO [σсв(s)]2 [σ(s) р]2[σсв(px)]2[πсв(py)]2[πсв(pz)]2 σ*](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/521108/slide-20.jpg)





 Области применения серной, соляной, азотной, и уксусной кислот
Области применения серной, соляной, азотной, и уксусной кислот Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Алюминий и его соединения
Алюминий и его соединения Біогеохімічні цикли та їх еволюція
Біогеохімічні цикли та їх еволюція Презентация Витамин Е
Презентация Витамин Е  Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Естествознание. Раздел II. Химия с элементами экологии Урок по теме:
Естествознание. Раздел II. Химия с элементами экологии Урок по теме: Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть
Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть  Презентация по Химии "Пластмаса" - скачать смотреть бесплатно
Презентация по Химии "Пластмаса" - скачать смотреть бесплатно Кислотно-основное титрование. 4 лекция. Часть 2
Кислотно-основное титрование. 4 лекция. Часть 2 Реакции координированных лигандов
Реакции координированных лигандов Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Основные классы неорганических соединений
Основные классы неорганических соединений Электролиз
Электролиз ГОД ЭКОЛОГИИ-2013
ГОД ЭКОЛОГИИ-2013  Растворы
Растворы Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Химия и здоровье
Химия и здоровье  Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей В чём вкус хлеба?
В чём вкус хлеба? Катализ.Лекция
Катализ.Лекция Антибиотики как ЛС
Антибиотики как ЛС Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров
Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров КВН В МИРЕ ВЕЩЕСТВ
КВН В МИРЕ ВЕЩЕСТВ Полимерные реагенты в бурении
Полимерные реагенты в бурении Хімічний лабіринт
Хімічний лабіринт