Содержание
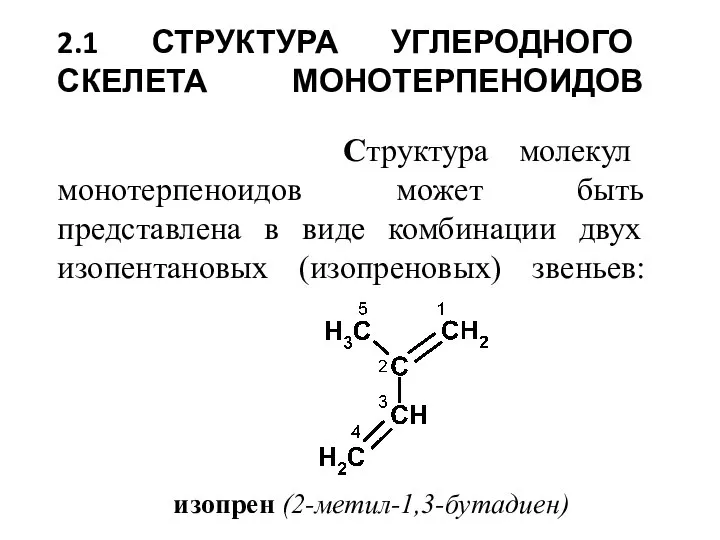
- 2. 2.1 СТРУКТУРА УГЛЕРОДНОГО СКЕЛЕТА МОНОТЕРПЕНОИДОВ Структура молекул монотерпеноидов может быть представлена в виде комбинации двух изопентановых
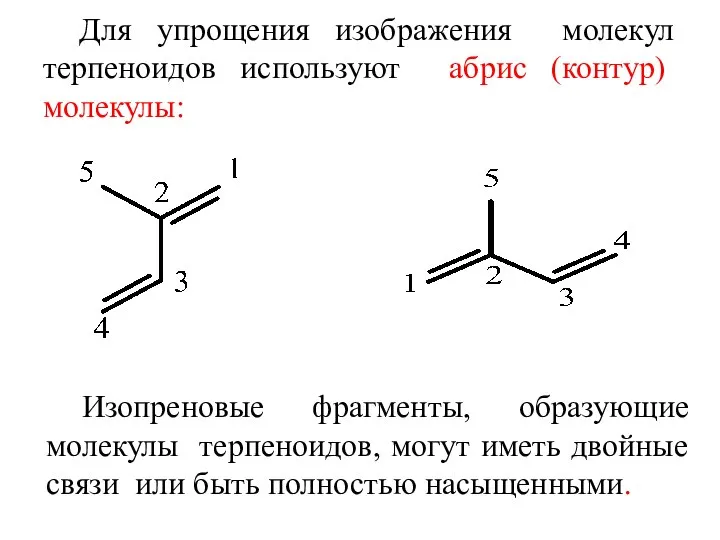
- 3. Для упрощения изображения молекул терпеноидов используют абрис (контур) молекулы: Изопреновые фрагменты, образующие молекулы терпеноидов, могут иметь
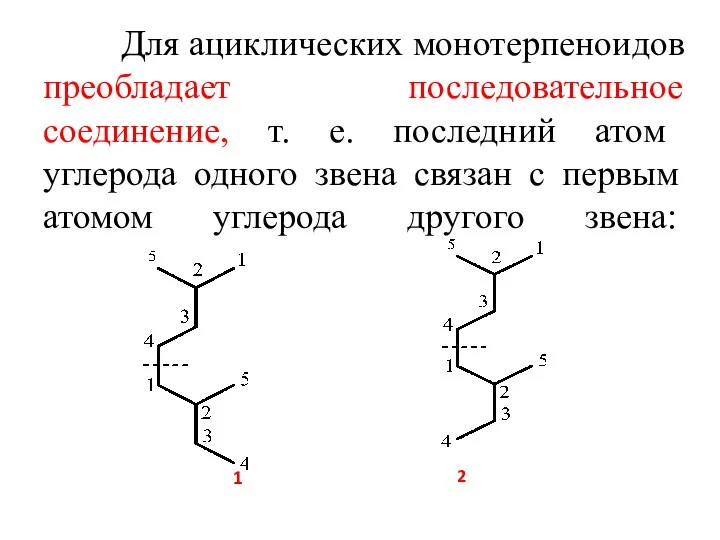
- 4. Для ациклических монотерпеноидов преобладает последовательное соединение, т. е. последний атом углерода одного звена связан с первым
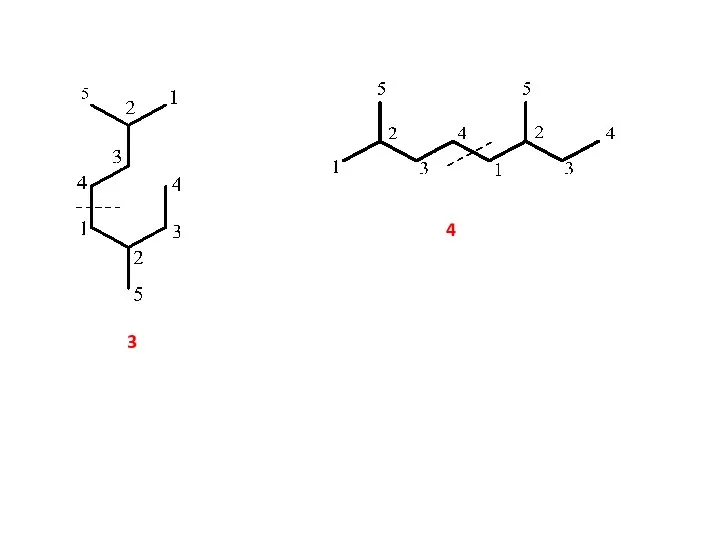
- 5. 3 4
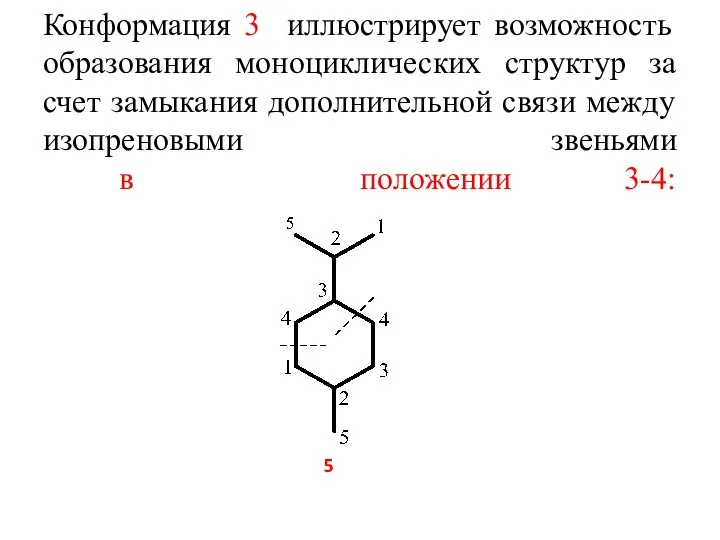
- 6. Конформация 3 иллюстрирует возможность образования моноциклических структур за счет замыкания дополнительной связи между изопреновыми звеньями в
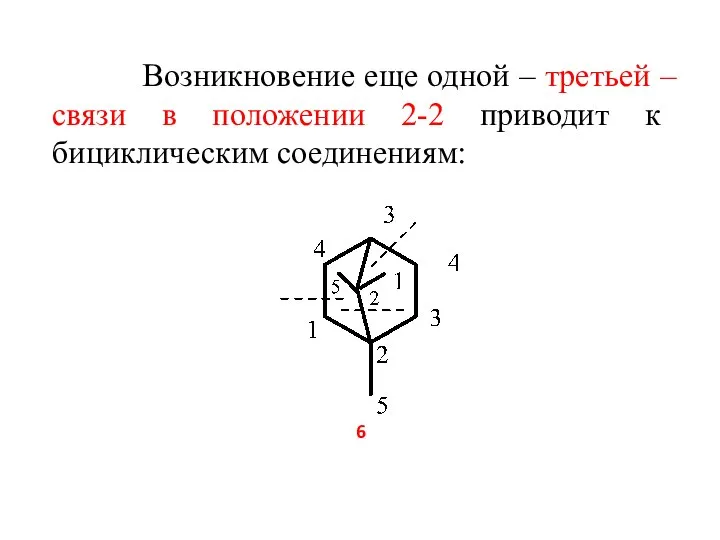
- 7. Возникновение еще одной – третьей – связи в положении 2-2 приводит к бициклическим соединениям: 6
- 8. 2.2 АЦИКЛИЧЕСКИЕ МОНОТЕРПЕНОИДЫ Ациклические монотерпеноиды широко распространены в природе и нередко являюся главными компонентов эфирных масел.
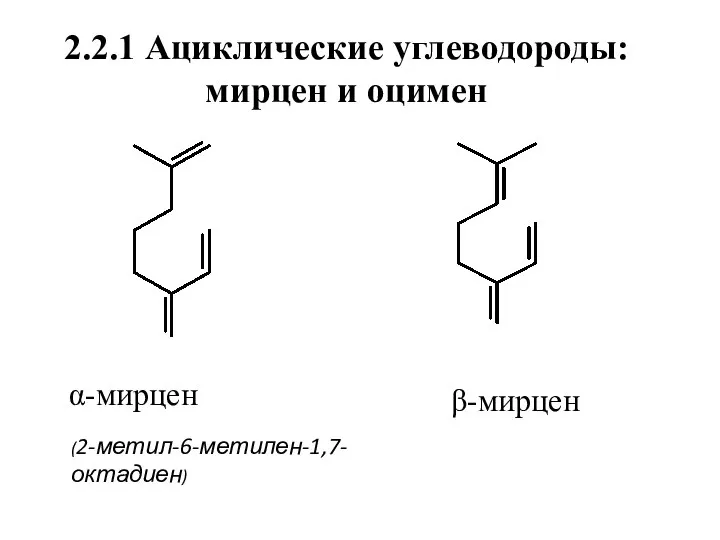
- 9. 2.2.1 Ациклические углеводороды: мирцен и оцимен α-мирцен (2-метил-6-метилен-1,7-октадиен) β-мирцен
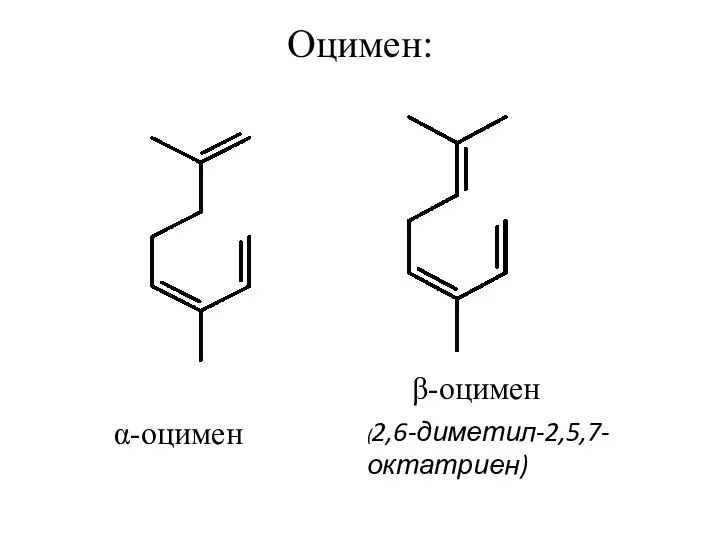
- 10. Оцимен: α-оцимен (2,6-диметил-2,5,7-октатриен) β-оцимен
- 11. Особенности строения углеводородов Приведенные соединения – изомеры, отличающиеся положением двойных связей. При этом положение сопряженной системы
- 12. Нахождение в природе, применение Мирцен и оцимен найдены во многих эфирных маслах. Чаще всего они присутствуют
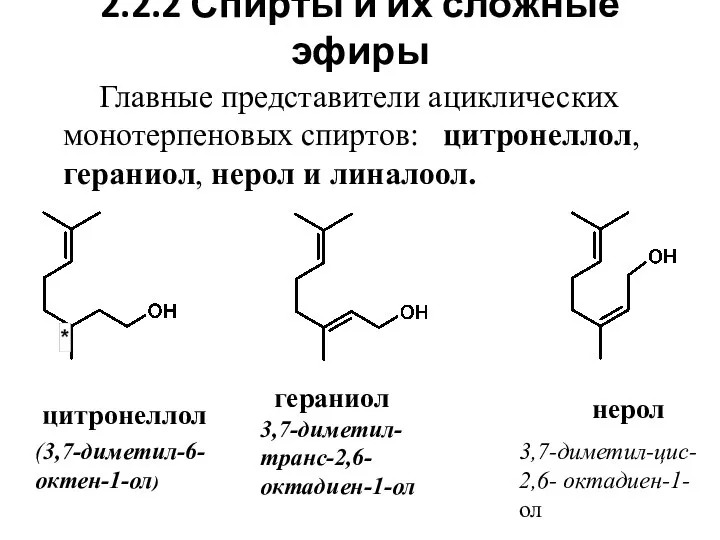
- 13. 2.2.2 Спирты и их сложные эфиры Главные представители ациклических монотерпеновых спиртов: цитронеллол, гераниол, нерол и линалоол.
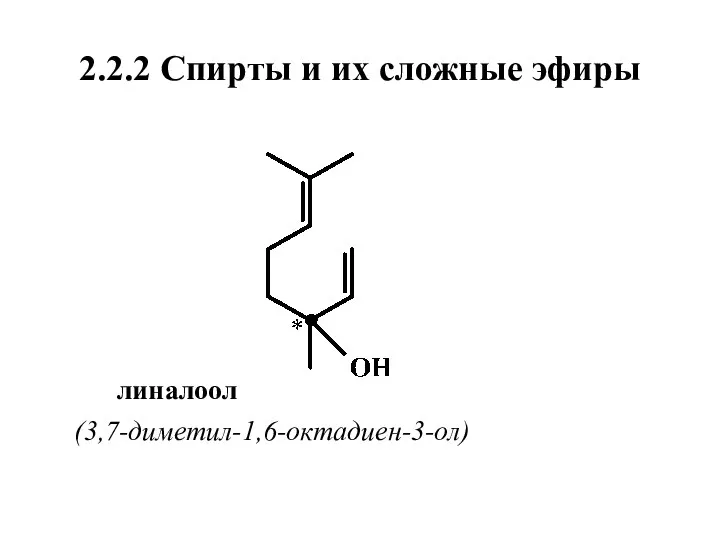
- 14. 2.2.2 Спирты и их сложные эфиры линалоол (3,7-диметил-1,6-октадиен-3-ол)
- 15. Особенности химического строения ациклических спиртов 1.В молекулах представленных спиртов изопреновые звенья связаны по типу 4 –
- 16. Особенности химического строения ациклических спиртов 4. Цитронеллол и линалоол имеют по одному хиральному атому (обозначен звездочкой)
- 17. Нахождение спиртов в природе, применение 1. Представленные спирты и их сложные эфиры (преимущественно ацетаты) широко распространены
- 18. Нахождение в природе, применение 3. Эти спирты содержатся также в цитронеллоловом масле, в масле розовой герани,
- 19. Нахождение спиртов в природе, применение 6. (-)-Линалоол в свободном виде и в форме ацетата содержится в
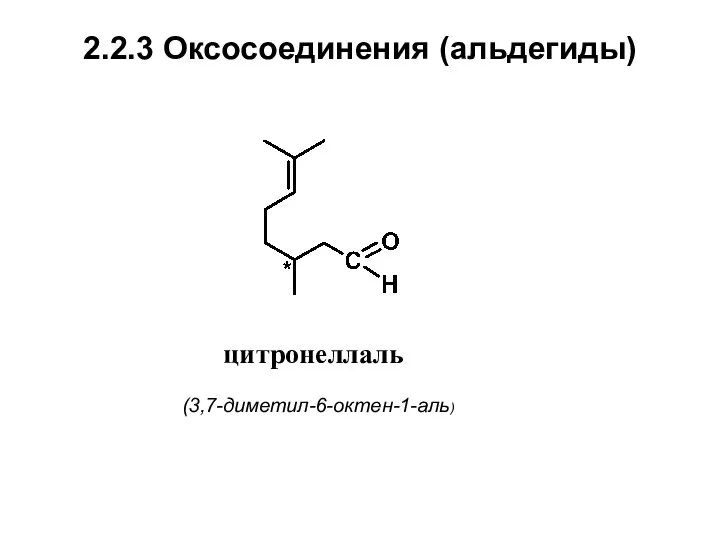
- 20. 2.2.3 Оксосоединения (альдегиды) цитронеллаль (3,7-диметил-6-октен-1-аль)
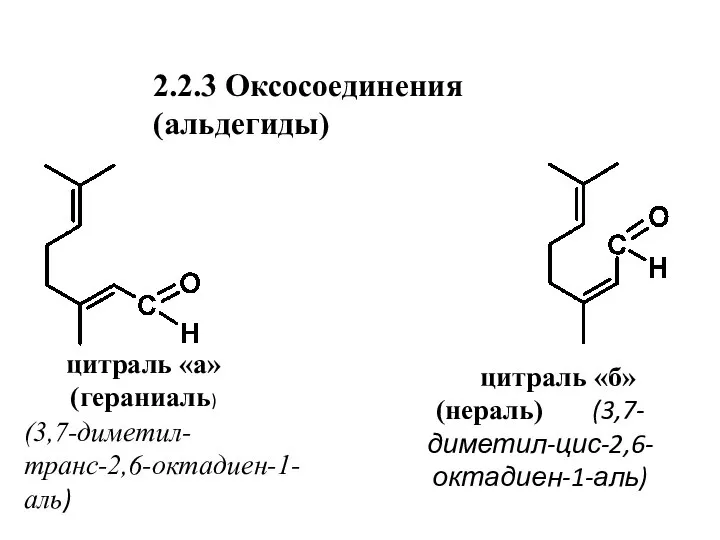
- 21. 2.2.3 Оксосоединения (альдегиды) цитраль «а» (гераниаль) цитраль «б» (нераль) (3,7-диметил-цис-2,6-октадиен-1-аль) (3,7-диметил-транс-2,6-октадиен-1-аль)
- 22. Нахождение в природе, применение альдегидов Цитронеллаль обладает запахом лимонного направления. Найден более чем в 50 эфирных
- 23. Нахождение в природе, применение альдегидов 3. Гераниаль и нераль (цитраль) сопутствуют друг другу в эфирных маслах.
- 24. Нахождение в природе, применение альдегидов 5. Цитраль применяют для составления парфюмерных композиций и пищевых эссенций, в
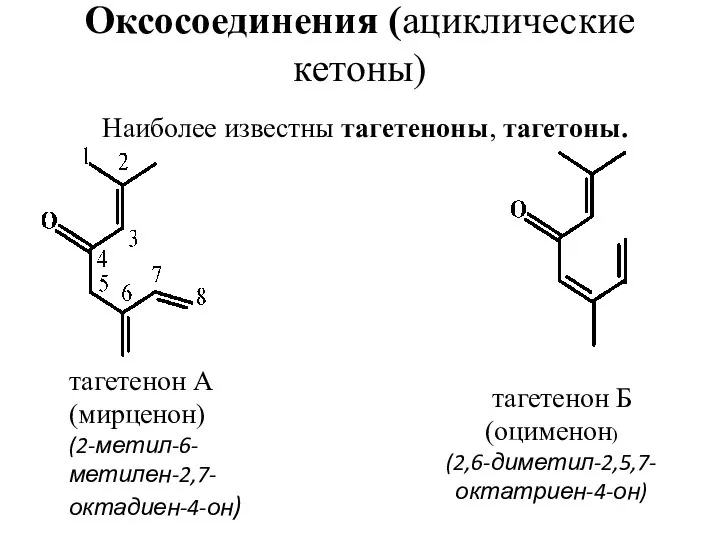
- 25. Оксосоединения (ациклические кетоны) Наиболее известны тагетеноны, тагетоны. тагетенон А (мирценон) (2-метил-6-метилен-2,7-октадиен-4-он) тагетенон Б (оцименон) (2,6-диметил-2,5,7-октатриен-4-он)
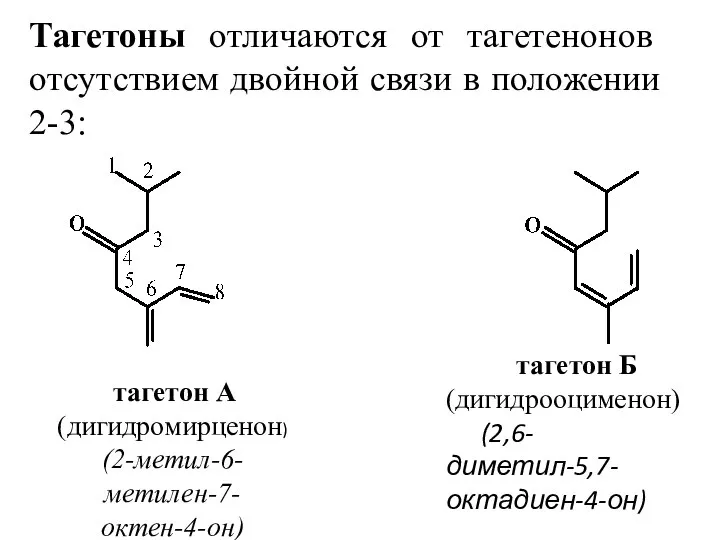
- 26. Тагетоны отличаются от тагетенонов отсутствием двойной связи в положении 2-3: тагетон А (дигидромирценон) (2-метил-6-метилен-7-октен-4-он) тагетон Б
- 27. Нахождение в природе, применение Тагетеноны и тагетоны содержатся в эфирном масле бархатцев (Tagetes) и определяют его
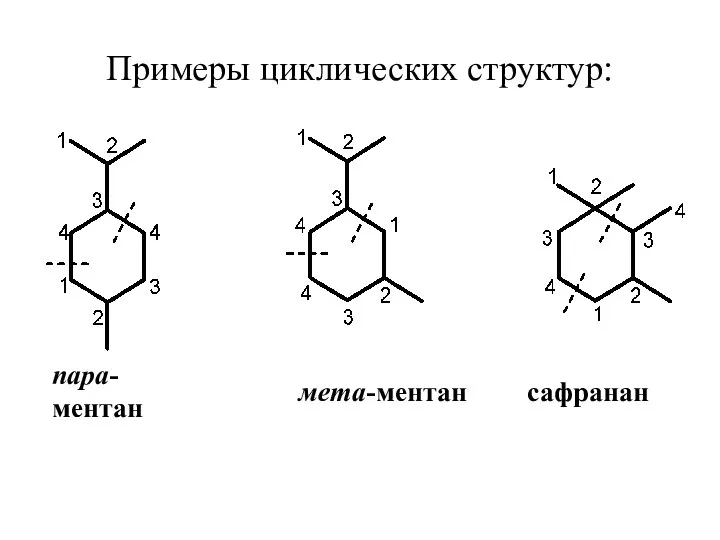
- 28. 2.3 МОНОЦИКЛИЧЕСКИЕ МОНОТЕРПЕНОИДЫ Большинство моноциклических монотерпеноидов имеет углеродный скелет п-ментана, который образован за счет 4-1 и
- 29. Примеры циклических структур: пара-ментан мета-ментан сафранан
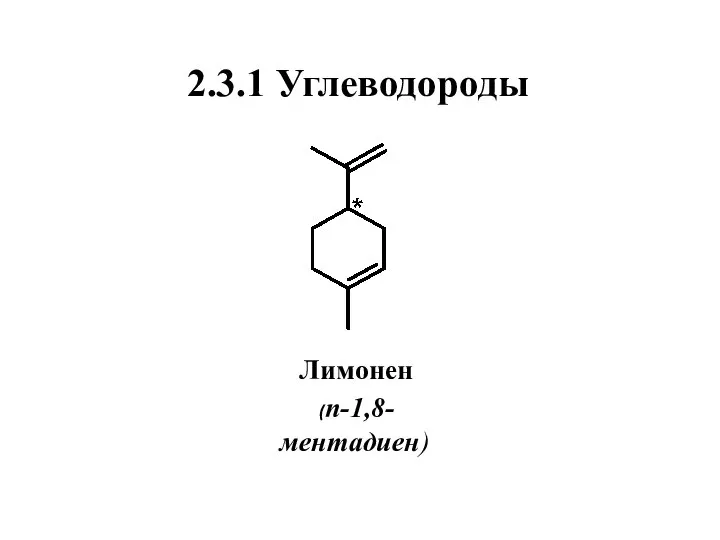
- 30. 2.3.1 Углеводороды Лимонен (п-1,8-ментадиен)
- 31. Нахождение в природе, применение Лимонен один из самых распространенных в природе монотерпеноидов. В составе эфирных масел
- 32. (-)-Лимонен и дипентен найдены в эфирных маслах хвойных. (+)-Лимонен обладает приятным запахом лимонного направления и находит
- 33. 2.3.2 Спирты и их сложные эфиры В соответствии с положением гидроксильной группы моноцикли-ческие спирты могут быть
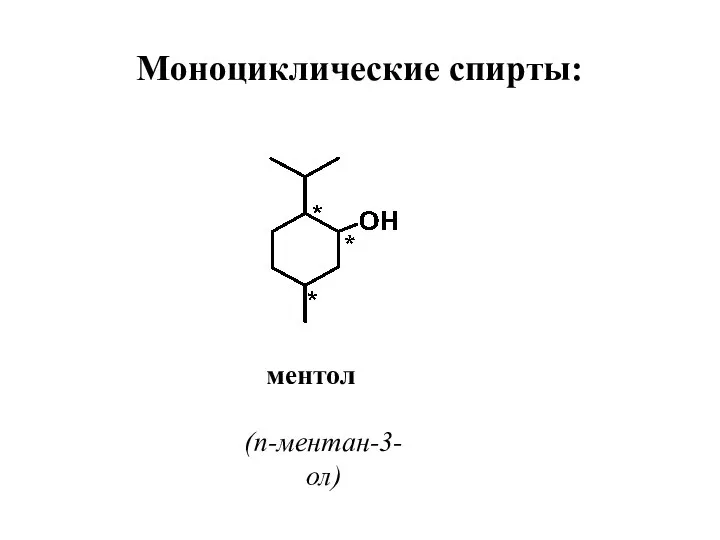
- 34. Моноциклические спирты: ментол (п-ментан-3-ол)
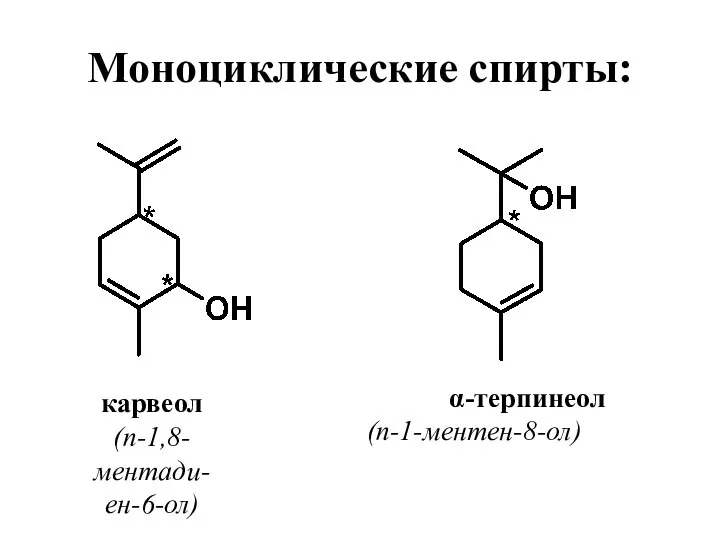
- 35. Моноциклические спирты: карвеол (п-1,8-ментади-ен-6-ол) α-терпинеол (п-1-ментен-8-ол)
- 36. Особености строения, нахождение в природе, применение Ментол – насыщенный вторичный спирт. Молекула имеет 3 хиральных центра
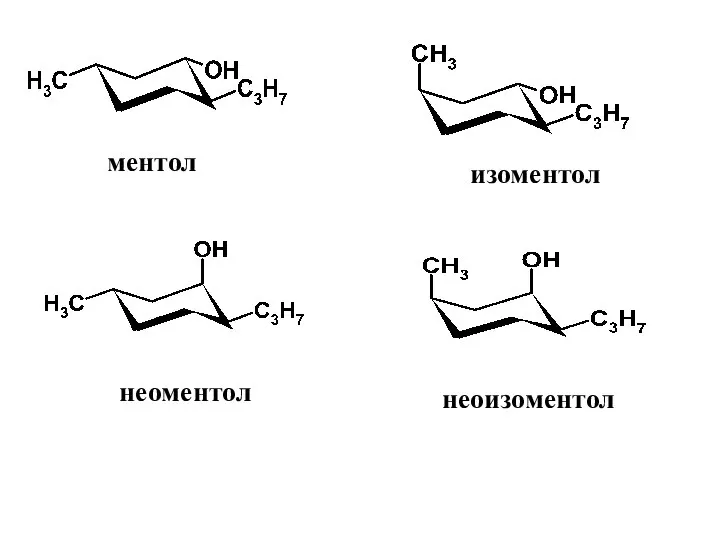
- 37. ментол изоментол неоментол неоизоментол
- 38. Диастереомеры ментола заметно отличаются по свойствам, в том числе по запаху и вкусу. Наиболее ценным является
- 39. Изоментол обладает более грубым мятным запахом с некоторым оттенком плесени. В эфирном масле перечной мяты его
- 40. Применение ментола Ментол широко используется в производстве зубных средств, жевательной резинки, в пищевой, табачной промышленности и
- 41. Карвеол содержится в небольших количествах в маслах тмина, укропа, кудрявой мяты. По запаху напоминает тмин. Используется
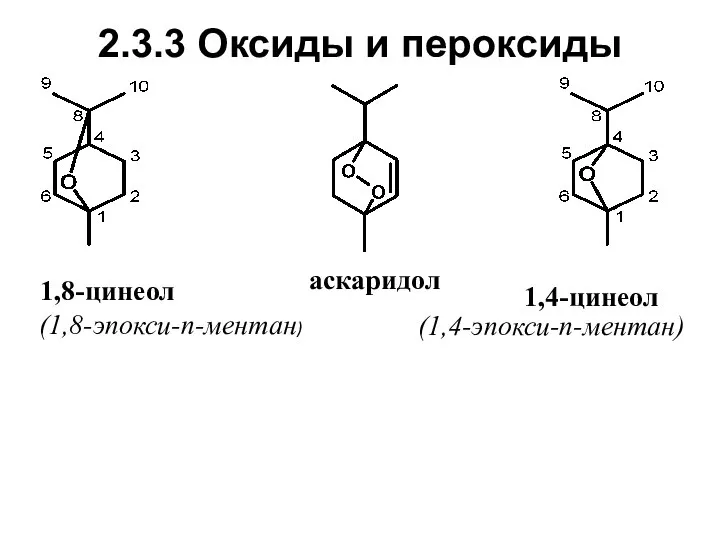
- 42. 2.3.3 Оксиды и пероксиды 1,8-цинеол 1,4-цинеол (1,8-эпокси-п-ментан) (1,4-эпокси-п-ментан) аскаридол
- 43. Нахождение в природе, применение 1,8-Цинеол – циклический простой эфир (окись); содержится во многих эфирных маслах. Является
- 44. Аскаридол – органическая перекись.. Содержится (до 70 %) в масле одного из видов полыни (Chenopodium antihelmenticum)
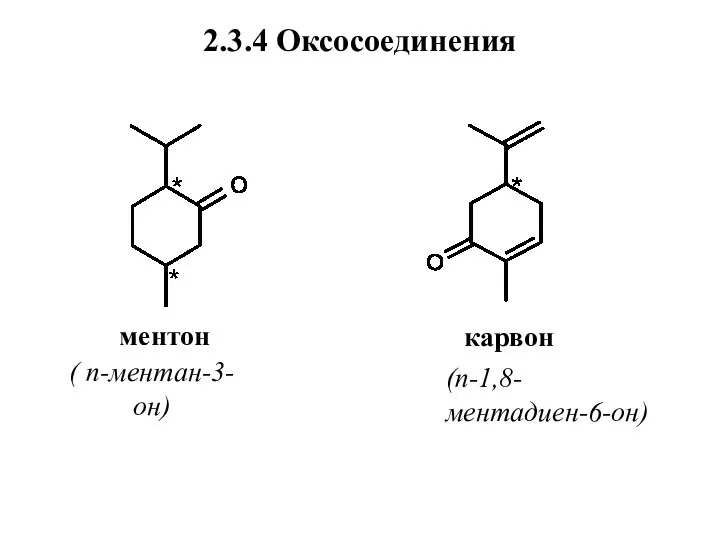
- 45. 2.3.4 Оксосоединения ментон карвон ( п-ментан-3-он) (п-1,8-ментадиен-6-он)
- 46. Нахождение в природе, применение Ментон имеет два хиральных атома углерода и, следовательно, два диастереомера – ментон
- 47. Карвон в природе найден в виде обоих энантиомеров и рацемической смеси. (+)-Карвон является главным компонентом масла
- 48. 2.4 БИЦИКЛИЧЕСКИЕ МОНОТЕРПЕНОИДЫ По характеру циклов и расположению заместителей бициклические структуры разделяют на группы, названия которым
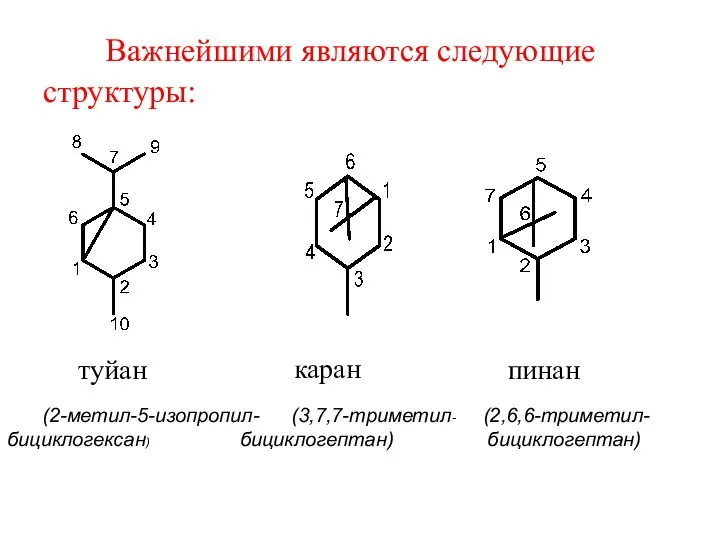
- 49. Важнейшими являются следующие структуры: туйан (2-метил-5-изопропил- (3,7,7-триметил- (2,6,6-триметил- бициклогексан) бициклогептан) бициклогептан) каран пинан
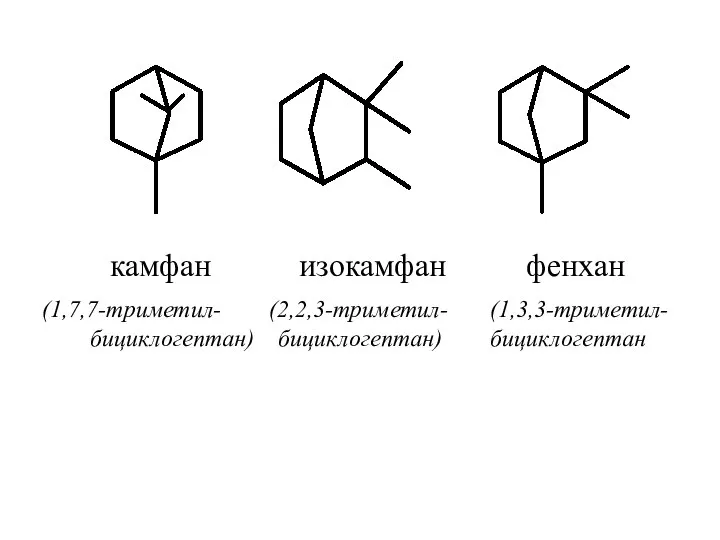
- 50. камфан изокамфан фенхан (1,7,7-триметил- (2,2,3-триметил- (1,3,3-триметил- бициклогептан) бициклогептан) бициклогептан
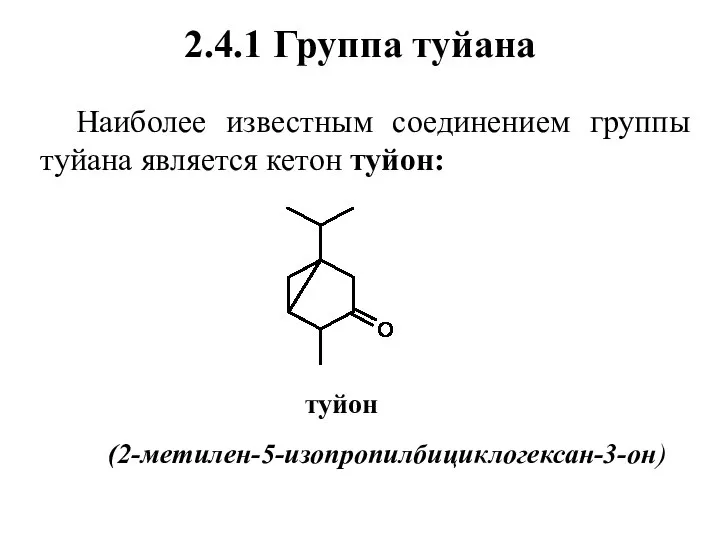
- 51. 2.4.1 Группа туйана Наиболее известным соединением группы туйана является кетон туйон: туйон (2-метилен-5-изопропилбициклогексан-3-он)
- 52. Нахождение в природе, применение Природный туйон представлен несколькими стереоизомерами, которые встречаются в туевом, пижмовом (до 60
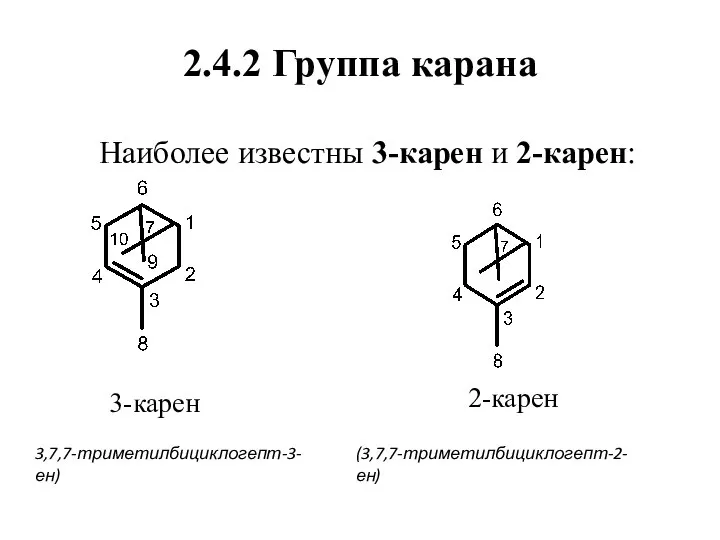
- 53. 2.4.2 Группа карана Наиболее известны 3-карен и 2-карен: 3-карен 2-карен 3,7,7-триметилбициклогепт-3-ен) (3,7,7-триметилбициклогепт-2-ен)
- 54. Нахождение в природе, применение (+)-3-Карен содержится в скипидарах (в индийском является главным компонентом), 2-карен найден в
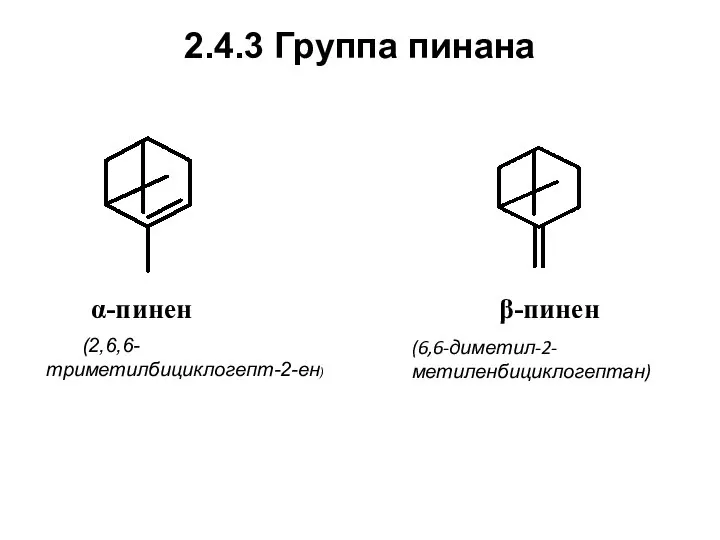
- 55. 2.4.3 Группа пинана α-пинен (2,6,6-триметилбициклогепт-2-ен) β-пинен (6,6-диметил-2-метиленбициклогептан)
- 56. Нахождение в природе, применение α-Пинен входит в состав очень многих эфирных масел, а в маслах большинства
- 57. В маслах некоторых хвойных, например, в масле калифорнийской сосны Pinus ponderosa, β-пинен преобладает. На основе β-пинена
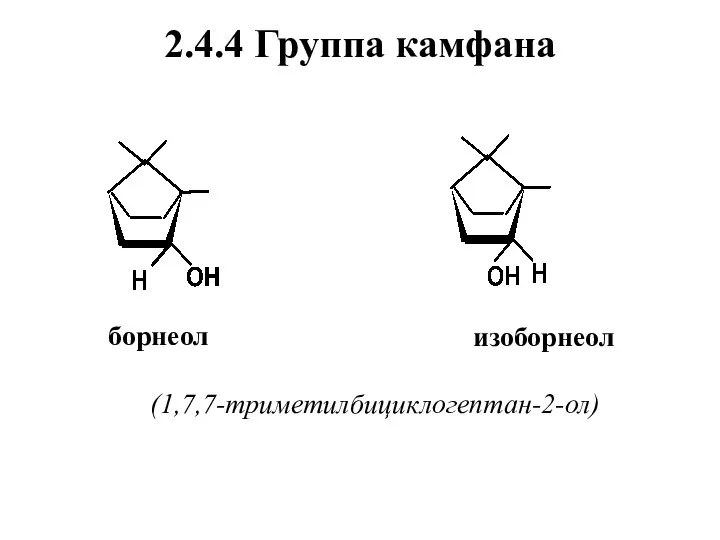
- 58. 2.4.4 Группа камфана борнеол изоборнеол (1,7,7-триметилбициклогептан-2-ол)
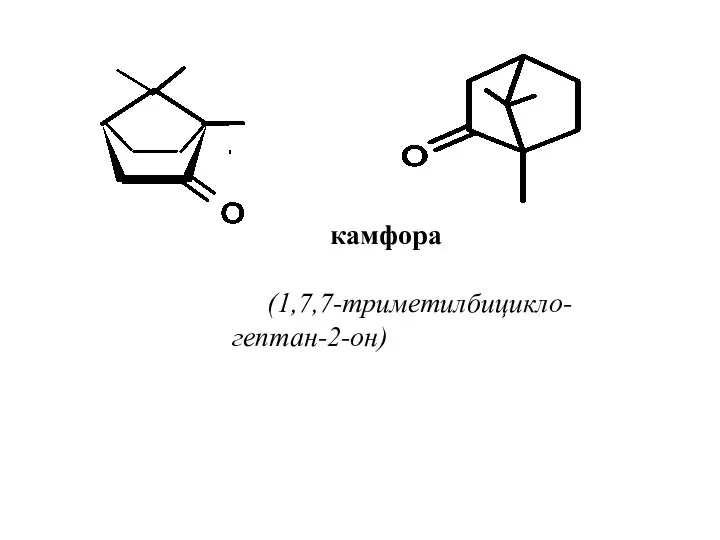
- 59. камфора (1,7,7-триметилбицикло-гептан-2-он)
- 60. Нахождение в природе, применение 1 Борнеол и изоборнеол – диастереомеры, отличающиеся положением гидроксильной группы: у борнеола
- 61. (+)-Борнеол содержится в смолообразных выделениях и эфирном масле камфорного лавра, произрастающего на островах Борнео и Суматра
- 62. Изоборнеол найден лишь в эфирных маслах некоторых видов можжевельника. Борнеол и изоборнеол имеют запах камфоры с
- 63. Камфора существует в виде двух энантиомеров. (+)-Камфора содержится в камфорном лавре, который является основным источником природной
- 64. Камфора является одним из наиболее широко используемых на практике соединений. Камфору применяют в производстве бездымного пороха,
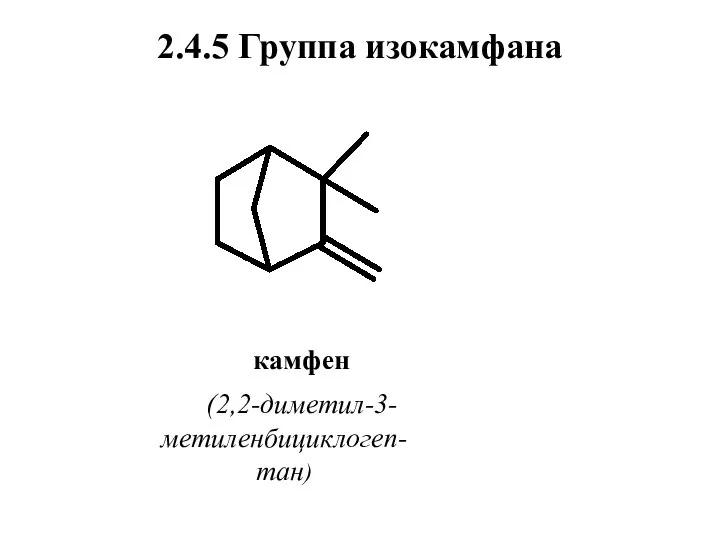
- 65. 2.4.5 Группа изокамфана камфен (2,2-диметил-3-метиленбициклогеп-тан)
- 66. Нахождение в природе, применение Камфен существует в виде двух энантиомеров. Правовращающий камфен находится в кипарисовом, эвкалиптовом,
- 67. Камфен имеет мягкий запах камфорного направления. Широко используется в композициях с запахом сосны, лаванды, цитрусовых, а
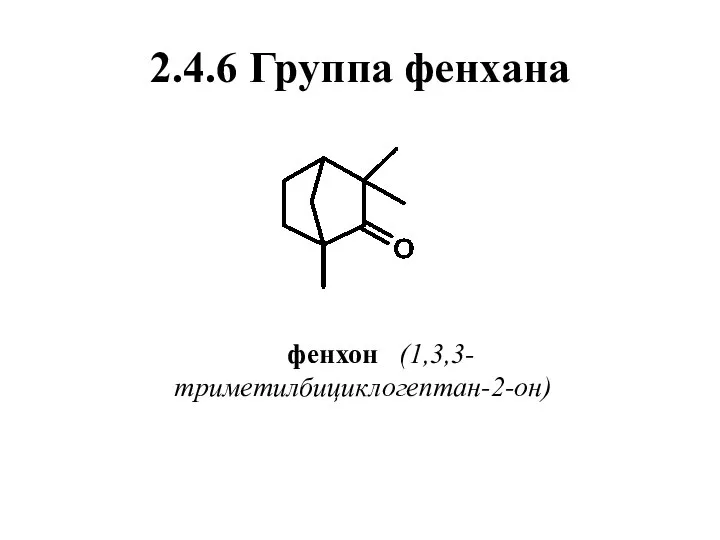
- 68. 2.4.6 Группа фенхана фенхон (1,3,3-триметилбициклогептан-2-он)
- 69. Нахождение в природе, применение Имеет две энантиомерные формы. (+)-Фенхон содержится в фенхелевом, укропном маслах,. (-)-Фенхон присутствует
- 70. 2.5 ФИЗИЧЕСКИЕ СВОЙСТВА 1 Агрегатное состояние. Большинство монотерпеноидов при комнатной темпе-ратуре находятся в жидком агрегатном состоянии.
- 71. 2 Температура кипения монотерпеноидов лежит в пределах 150-230 °С. Наиболее легкокипящими являются углеводороды бициклической структуры. Так,
- 72. При такой температуре многие органические соединения начинают разлагаться, поэтому при очистке монотерпеноидов методом дистилляции процесс ведут
- 73. 3 Относительная плотность монотерпе-ноидов меньше единицы; эти соединения легче воды. Наименьшую плотность имеют углеводороды (от 0,8
- 74. 4 Показатель преломления большинства рассмотренных соединений лежит в пределах 1,44-1,50. Показатель преломления возрастает с увеличением в
- 76. Скачать презентацию











































 Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки ПРИРОДНЫЕ И ПОПУТНЫЕ ГАЗЫ.
ПРИРОДНЫЕ И ПОПУТНЫЕ ГАЗЫ. Способы получения полимеров (Лекция 3)
Способы получения полимеров (Лекция 3) Исследовательская работа по химии “Минеральные краски’’
Исследовательская работа по химии “Минеральные краски’’ Растворы. Теория электролитической диссоциации
Растворы. Теория электролитической диссоциации Многоатомные спирты
Многоатомные спирты Нефть, как одна из основ жизни
Нефть, как одна из основ жизни Презентация по биологии Круговорот серы, фосфора и азота в биосфере
Презентация по биологии Круговорот серы, фосфора и азота в биосфере Химия и современный быт человека
Химия и современный быт человека Металлы в продуктах питания
Металлы в продуктах питания Интересные свойства редких металлов
Интересные свойства редких металлов Неорганические полимеры
Неорганические полимеры Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Практикум по органической и биоорганической химии
Практикум по органической и биоорганической химии Углерод Carboneum происходит от лат. carbo — уголь.
Углерод Carboneum происходит от лат. carbo — уголь. Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Лекарственное растительное сырье, содержащее производные простых фенолов
Лекарственное растительное сырье, содержащее производные простых фенолов Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Презентация по Химии "Карбонові кислоти. Естери. Жири. Мило" - скачать смотреть бесплатно
Презентация по Химии "Карбонові кислоти. Естери. Жири. Мило" - скачать смотреть бесплатно Адам мен жануар организміне бордың әсері
Адам мен жануар организміне бордың әсері Нахождение массовой доли
Нахождение массовой доли Биоэнергетика. Энергетическое сопряжение
Биоэнергетика. Энергетическое сопряжение Химия в сельском хозяйстве
Химия в сельском хозяйстве Презентация по Химии "Природный и попутный газ, их переработка. Коксохимическое производство" - скачать смотреть
Презентация по Химии "Природный и попутный газ, их переработка. Коксохимическое производство" - скачать смотреть  Элементы симметрии кристаллических структур
Элементы симметрии кристаллических структур Химическая термодинамика. Лекция 2
Химическая термодинамика. Лекция 2 Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Дисперсные
Дисперсные