Содержание
- 2. ВСАСЫВАНИЕ ЛИПИДОВ 1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь
- 3. РЕСИНТЕЗ ЛИПИДОВ В СТЕНКЕ КИШЕЧНИКА это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров,
- 4. Ресинтез эфиров холестерола Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-КоА: холестерол-ацилтрансферазы (АХАТ). Реэтерификация холестерола напрямую
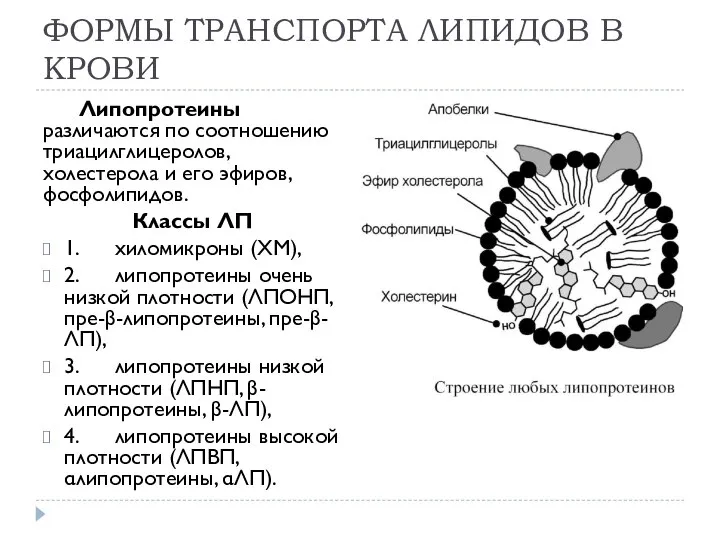
- 5. ФОРМЫ ТРАНСПОРТА ЛИПИДОВ В КРОВИ Липопротеины различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов. Классы
- 6. ТРАНСПОРТ ТРИАЦИЛГЛИЦЕРОЛОВ 1. Образование незрелых первичных ХМ в кишечнике. 2. Движение первичных ХМ через лимфатические протоки
- 7. ХАРАКТЕРИСТИКА И ФУНКЦИИ ХИЛОМИКРОНОВ Характеристика 1. Формируются в кишечнике из ресинтезированных жиров. 2. В их составе
- 8. ДИСЛИПОПРОТЕИНЕМИИ - это все изменения содержания липидов в плазме крови, характеризующиеся их повышением, снижением или полным
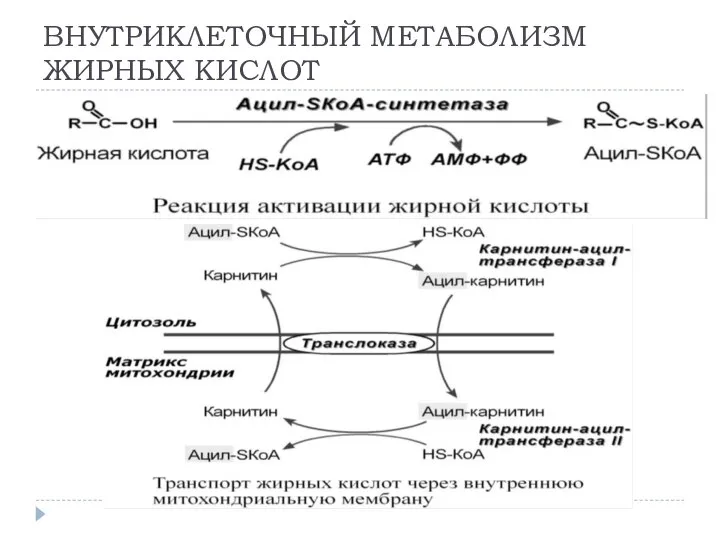
- 9. ВНУТРИКЛЕТОЧНЫЙ МЕТАБОЛИЗМ ЖИРНЫХ КИСЛОТ
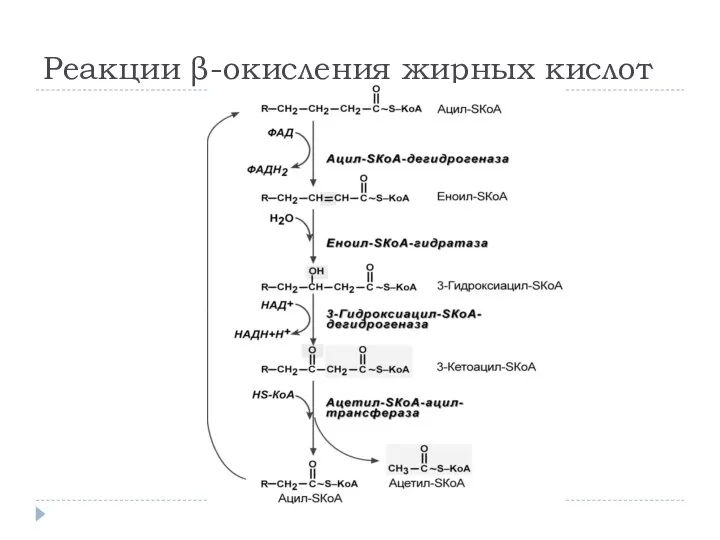
- 10. Реакции β-окисления жирных кислот
- 11. Энергетический выход β-окисления на примере пальмитиновой кислоты Образование АТФ = 108 АТФ. Расход АТФ на активацию
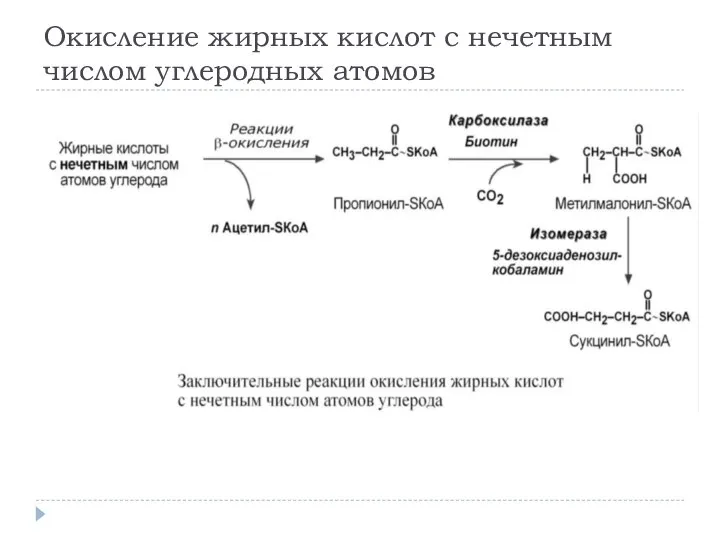
- 12. Окисление жирных кислот с нечетным числом углеродных атомов
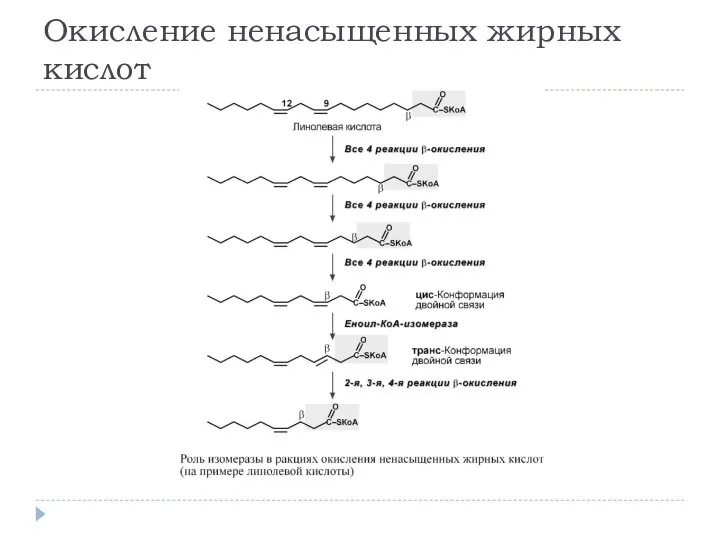
- 13. Окисление ненасыщенных жирных кислот
- 14. ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ В ПЕРОКСИСОМАХ Окисление жирных кислот в пероксисомах составляет около 30 % всего их
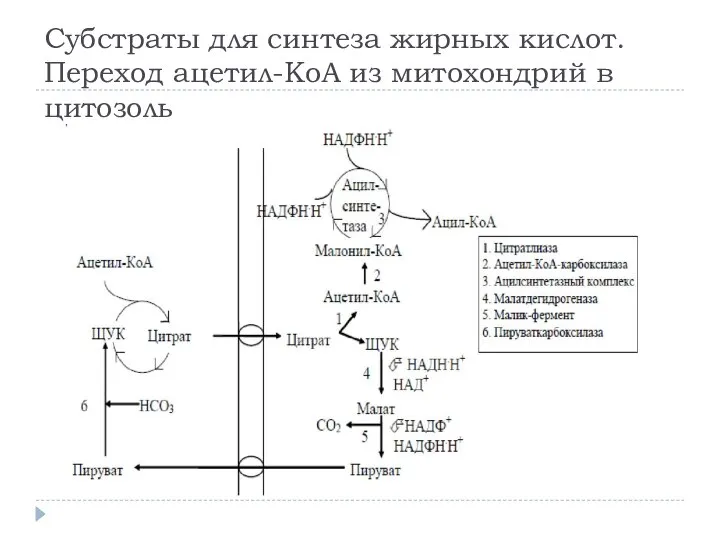
- 15. СИНТЕЗ ЖИРНЫХ КИСЛОТ 1. Образование ацетил-SКоА из глюкозы или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий
- 16. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитратлиазой до ацетил-SКоА и оксалоацетата. Оксалоацетат в дальнейшем восстанавливается
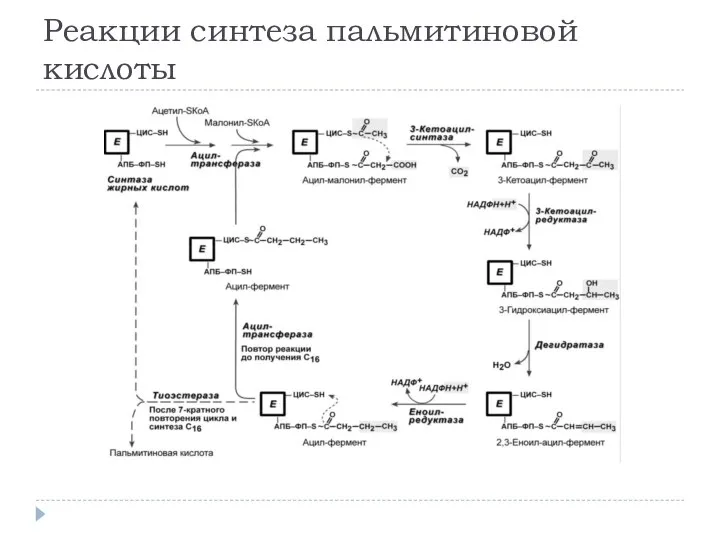
- 17. 4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит
- 18. Реакции синтеза пальмитиновой кислоты
- 19. Субстраты для синтеза жирных кислот. Переход ацетил-КоА из митохондрий в цитозоль
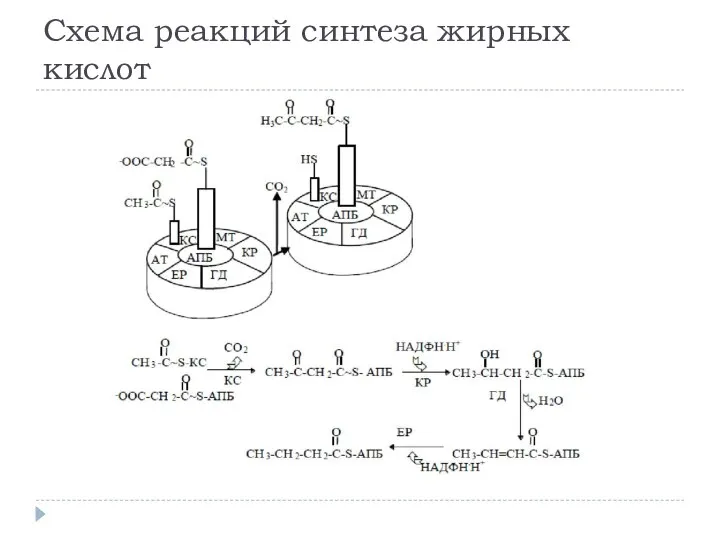
- 20. Схема реакций синтеза жирных кислот
- 21. УДЛИНЕНИЕ ЦЕПИ ЖИРНЫХ КИСЛОТ Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум. Здесь с участием
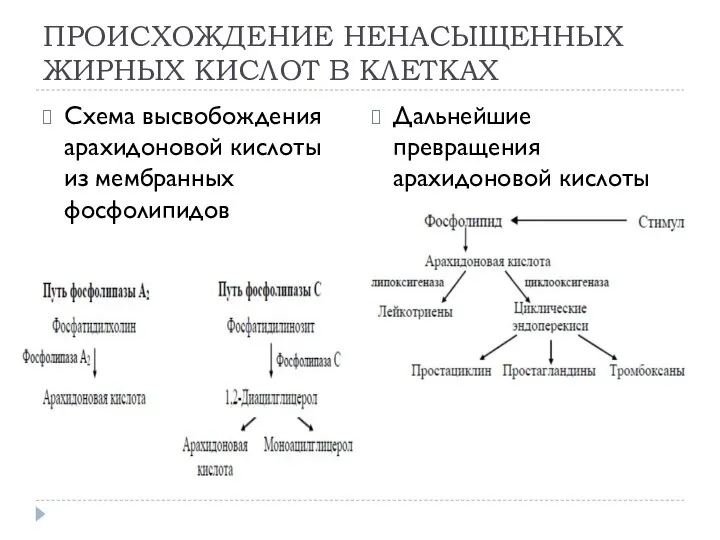
- 22. ПРОИСХОЖДЕНИЕ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ В КЛЕТКАХ Схема высвобождения арахидоновой кислоты из мембранных фосфолипидов Дальнейшие превращения арахидоновой
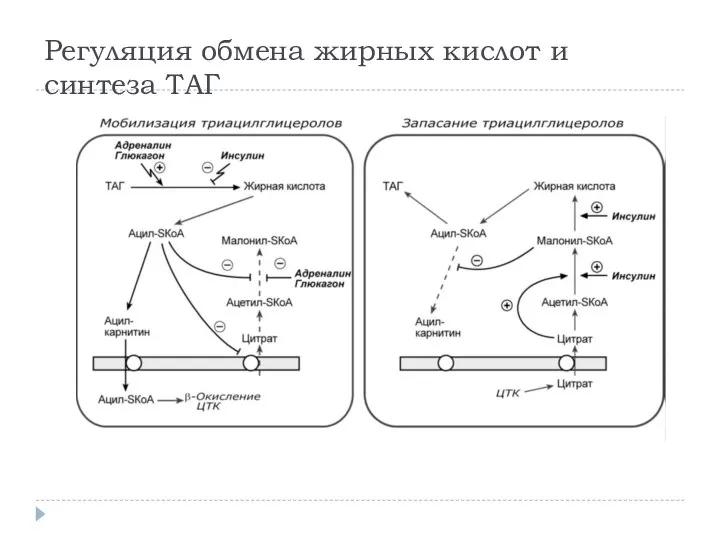
- 23. РЕГУЛЯЦИЯ ОБМЕНА ЖИРНЫХ КИСЛОТ Гормональная регуляция Синтез и окисление триацилглицеролов и жирных кислот зависит от соотношения
- 24. Регуляция обмена жирных кислот и синтеза ТАГ
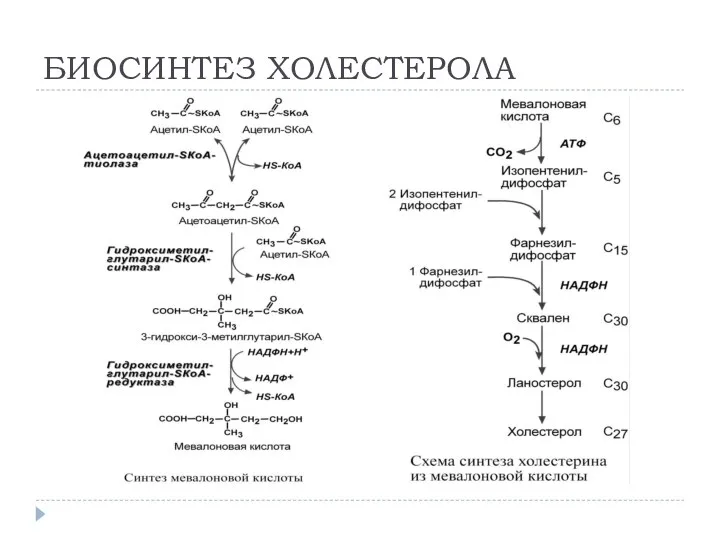
- 25. БИОСИНТЕЗ ХОЛЕСТЕРОЛА
- 26. РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза: 1. Метаболическая регуляция – по принципу обратной отрицательной связи
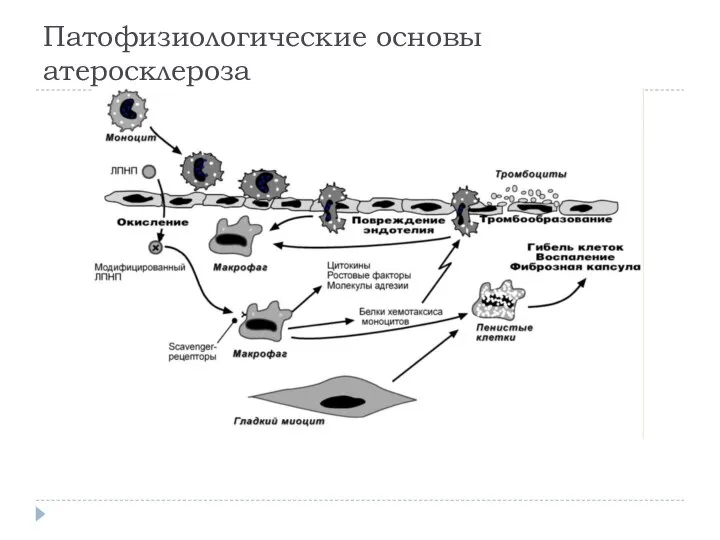
- 27. НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРОЛА Атеросклероз – это отложение холестерола и его эфиров в соединительной ткани стенок артерий,
- 28. Патофизиологические основы атеросклероза
- 30. Скачать презентацию















 ПИТЬ ИЛИ НЕ ПИТЬ?
ПИТЬ ИЛИ НЕ ПИТЬ? Заттардың сұйық пен газдағы қозғалуы мысалында диффузия үдерісін зерттеу
Заттардың сұйық пен газдағы қозғалуы мысалында диффузия үдерісін зерттеу Алканы «Гексан»
Алканы «Гексан» Мұнай тотықтырушы микроағзалардың өсу және дамуына күкірттің әсерін зерттеу
Мұнай тотықтырушы микроағзалардың өсу және дамуына күкірттің әсерін зерттеу Презентация по Химии "Химия и современный мир профессий" - скачать смотреть
Презентация по Химии "Химия и современный мир профессий" - скачать смотреть  В гостях у Хозяйки Медной горы. Покровская сельская библиотека
В гостях у Хозяйки Медной горы. Покровская сельская библиотека Біологічна роль Карбону та Силіцію
Біологічна роль Карбону та Силіцію 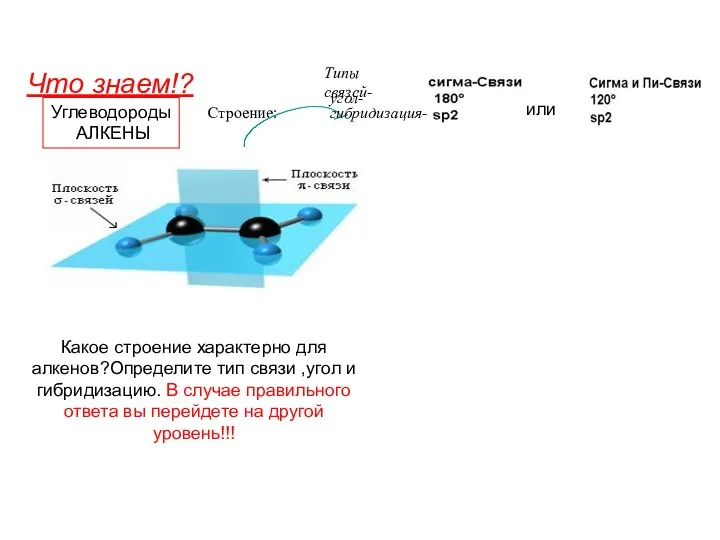 Углеводороды. Алкены
Углеводороды. Алкены Аттестационная работа. Мыловарение. Создание мыла своими руками
Аттестационная работа. Мыловарение. Создание мыла своими руками Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы
Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть
Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть  Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Анализ лекарственных форм
Анализ лекарственных форм Основания, их классификация и свойства
Основания, их классификация и свойства Аттестационная работа. Программа регионального компонента образовательной области Химия
Аттестационная работа. Программа регионального компонента образовательной области Химия Явления физические и химические. Признаки и условия протекания химических реакций
Явления физические и химические. Признаки и условия протекания химических реакций Көміртегінің мөлшері бойынша легірленген болаттың классификациясы
Көміртегінің мөлшері бойынша легірленген болаттың классификациясы Качественное и количественное определение содержания аскорбиновой кислоты в продуктах питания
Качественное и количественное определение содержания аскорбиновой кислоты в продуктах питания Первоначальная периодическая таблица Д.И.Менделеева
Первоначальная периодическая таблица Д.И.Менделеева Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5)
Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5) Алкины. Химические и физические свойства алкинов
Алкины. Химические и физические свойства алкинов Важнейшие соединения щелочных металлов, их свойства и применение.
Важнейшие соединения щелочных металлов, их свойства и применение. Конструкционная прочность материала и её связь со структурой
Конструкционная прочность материала и её связь со структурой Железоуглеродистые сплавы. Построение диаграммы fe-fe3с. Характеристика компонентов, фаз и структурных составляющих. (Лекция 3)
Железоуглеродистые сплавы. Построение диаграммы fe-fe3с. Характеристика компонентов, фаз и структурных составляющих. (Лекция 3) Моторные масла
Моторные масла Смазочные масла. Влияние добавки графена и углеродных нанотрубок
Смазочные масла. Влияние добавки графена и углеродных нанотрубок Химия Для студентов I курса специальностей: 2080165 — экология, 08040165 — товароведение и экспертиза товаров, 260800 — технология, конс
Химия Для студентов I курса специальностей: 2080165 — экология, 08040165 — товароведение и экспертиза товаров, 260800 — технология, конс Первоначальная периодическая таблица Д.И.Менделеева
Первоначальная периодическая таблица Д.И.Менделеева