Содержание
- 2. Обратимые и необратимые химические реакции Химические реакции, протекающие в одном направлении, называются необратимыми. Химические реакции, протекающие
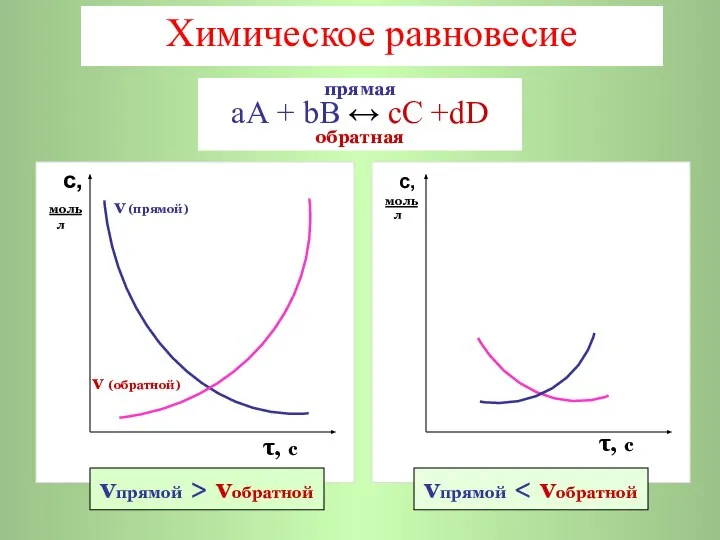
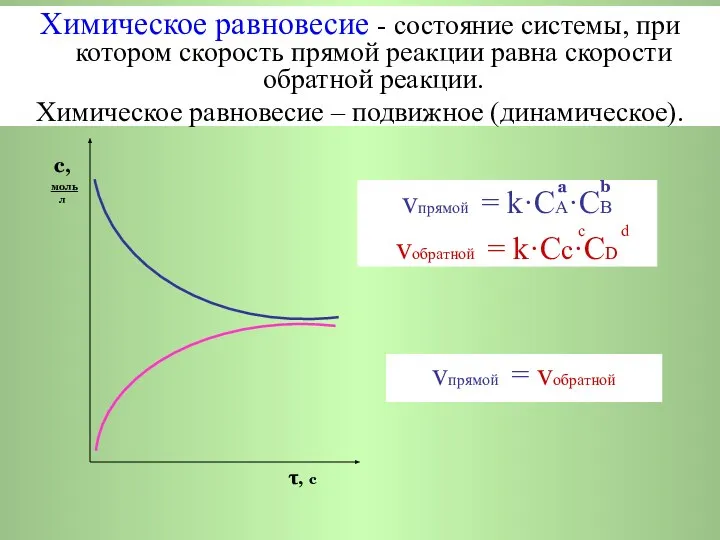
- 3. Химическое равновесие с, моль v (прямой) л v (обратной) τ, с с, моль л τ, с
- 4. a b vпрямой = k·CA·СB с d vобратной = k·Cс·СD с, моль л τ, с vпрямой
- 5. Принцип Ле-Шателье: «Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то
- 6. 1. Концентрация: а) при увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции (вправо); б)
- 8. Скачать презентацию



 Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Электрохимическая защита
Электрохимическая защита Карбоновые кислоты
Карбоновые кислоты Кислотные и основные свойства биоорганических соединений. (Лекция 2)
Кислотные и основные свойства биоорганических соединений. (Лекция 2) Островные силикаты (Орто)
Островные силикаты (Орто) Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Элементы V А группы. Азот и его соединения
Элементы V А группы. Азот и его соединения Валетные состояния атома углерода
Валетные состояния атома углерода Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу
Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу Смесители. Пропеллерная мешалка
Смесители. Пропеллерная мешалка Титан. Технология титана
Титан. Технология титана Классификация опасных грузов
Классификация опасных грузов Химия лекция (вебинар)
Химия лекция (вебинар) Кислород. Происхождение слова Кислород
Кислород. Происхождение слова Кислород Катализаторы
Катализаторы Презентация по Химии "Законы газового состояния вещества" - скачать смотреть
Презентация по Химии "Законы газового состояния вещества" - скачать смотреть  Выращивание кристаллов из соли
Выращивание кристаллов из соли Релаксационные свойства полимеров
Релаксационные свойства полимеров Создание косметических средств
Создание косметических средств Взаимосвязь между классами неорганических веществ
Взаимосвязь между классами неорганических веществ Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.
Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.  Бу́ферные систе́мы кро́ви
Бу́ферные систе́мы кро́ви Детонаційна стійкість бензину Підготувала учениця 11-Б класу ЖЕЛ №24 Гуленко Катерина
Детонаційна стійкість бензину Підготувала учениця 11-Б класу ЖЕЛ №24 Гуленко Катерина  Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях
Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях Atomic structure
Atomic structure Эндогенная серия. Скарновая группа
Эндогенная серия. Скарновая группа Стекло — твердое неорганическое вещество
Стекло — твердое неорганическое вещество