Содержание
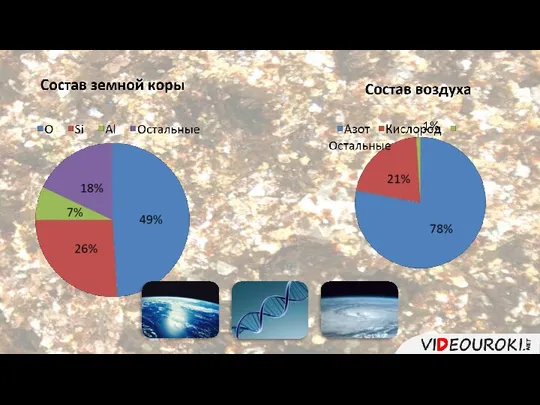
- 2. Халькогены – это элементы VIA группы. О S Se Te Po Название халькогены означает «рождающие руды».
- 3. Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам
- 4. По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения
- 7. Дж. Пристли t В 1774 г. получил кислород. К. Шееле Получил кислород нагреванием селитры. Дал название
- 12. Получение кислорода В промышленности Из жидкого воздуха.
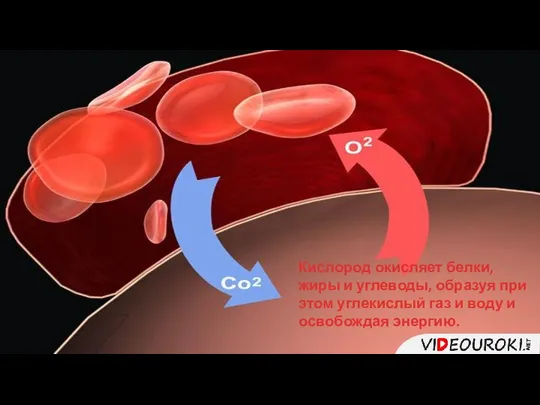
- 16. Кислород окисляет белки, жиры и углеводы, образуя при этом углекислый газ и воду и освобождая энергию.
- 17. O2 1 1 – в металлургии; 2 2 – газовая сварка и резка металлов; 3 3
- 19. Скачать презентацию














 Классификация методов аналитической химии
Классификация методов аналитической химии Обмен нуклеопротеинов
Обмен нуклеопротеинов Нуклеин қышқылдары. ДНҚ репликациясы
Нуклеин қышқылдары. ДНҚ репликациясы Некрохмалисті полісахариди
Некрохмалисті полісахариди Физический этап развития периодического закона
Физический этап развития периодического закона Хімічні явища в побуті
Хімічні явища в побуті Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Основы теории плавления и отвердевания металлов
Основы теории плавления и отвердевания металлов Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна
Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна  Строение атома
Строение атома Непредельные углеводороды
Непредельные углеводороды Строение атома и периодическая система элементов Д. И. Менделеева
Строение атома и периодическая система элементов Д. И. Менделеева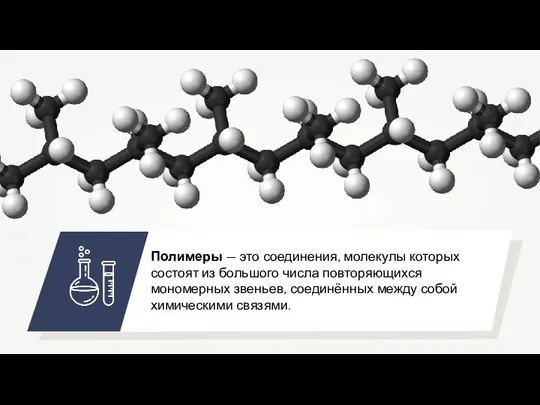 Органические и неорганические полимеры
Органические и неорганические полимеры Классификация химических реакций
Классификация химических реакций Определение активной реакции воды (рН)
Определение активной реакции воды (рН)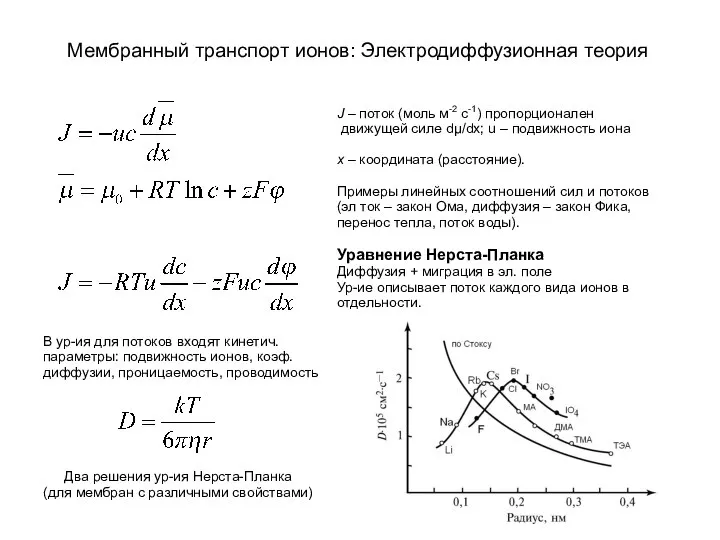 Мембранный транспорт ионов: электродиффузионная теория
Мембранный транспорт ионов: электродиффузионная теория Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Аттестационная работа. Программа элективного курса по химии «экологическая химия»
Аттестационная работа. Программа элективного курса по химии «экологическая химия» Спиртзавод ОАО «Петровский»
Спиртзавод ОАО «Петровский» Гидролиз солей.
Гидролиз солей.  Прогнозування хімічної обстановки під час застосування хімічної зброї
Прогнозування хімічної обстановки під час застосування хімічної зброї Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Сероводород
Сероводород Композиционные или композитные материалы
Композиционные или композитные материалы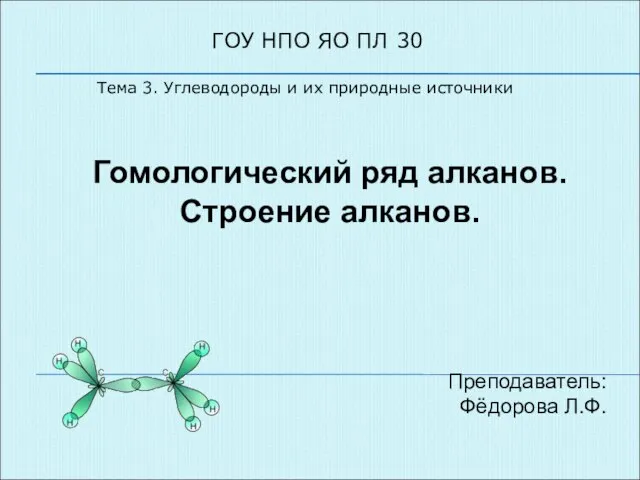 Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов
Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов Хімія та їжа
Хімія та їжа Одорант природный
Одорант природный