Содержание
- 2. Сероводород также имеет лечебное значение, он является составной частью некоторых минеральных вод (Пятигорск, Серноводск, Мацеста).
- 6. Горение сероводорода 2H2S + O2 = 2H2O + 2S↓ Горение сероводорода в недостатке кислорода: Горение сероводорода
- 8. Типы солей сернистой кислоты Na2SO3, BaSO3 Сернистая кислота — это слабая двухосновная кислота, ей соответствуют два
- 9. Взаимодействие сернистого газа с кислородом 2SO2 + O2 = 2SO3
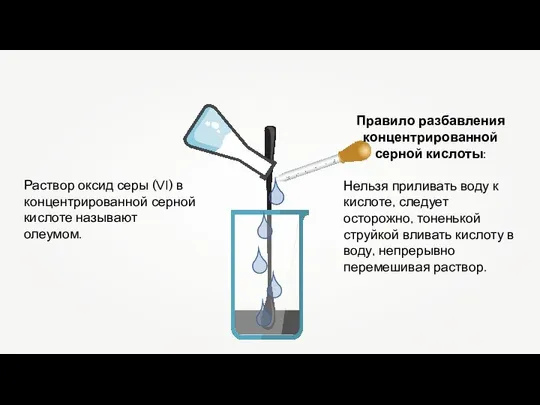
- 12. Раствор оксид серы (VI) в концентрированной серной кислоте называют олеумом. Правило разбавления концентрированной серной кислоты: Нельзя
- 13. Химические свойства разбавленной серной кислоты 3H2SO4 + 2Al = Al2(SO4)3 + 3H2↑ Взаимодействует с металлами, стоящими
- 14. Химические свойства разбавленной серной кислоты H2SO4 + 2NaOH = Na2SO4 + 2H2O Реагирует с основаниями: Взаимодействует
- 15. Серная кислота является двухосновной кислотой, поэтому ей соответствуют два типа солей: K2SO4, CaSO4 Средние — сульфаты:
- 16. Для качественного обнаружения серной кислоты и её солей чаще всего используют BaCl2. В результате серная кислота
- 17. Химические свойства концентрированной серной кислоты 2H2SO4 + Cu = CuSO4 + 2H2O + SO2↑ Способна взаимодействовать
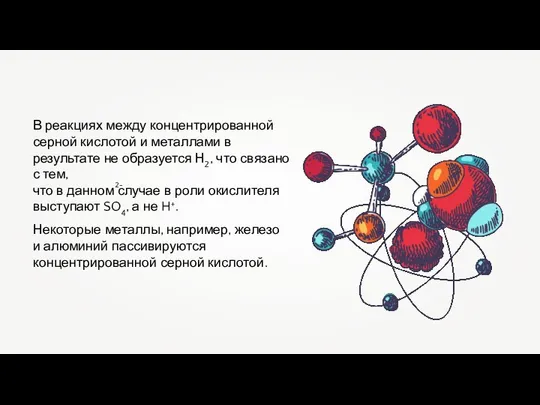
- 18. В реакциях между концентрированной серной кислотой и металлами в результате не образуется Н2, что связано с
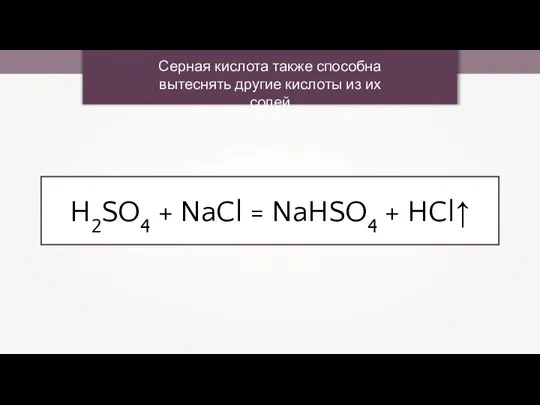
- 19. Серная кислота также способна вытеснять другие кислоты из их солей H2SO4 + NaCl = NaHSO4 +
- 20. Применение серной кислоты: H2SO4 – производство минеральных удобрений, соляной, уксусной и многих других кислот, моющих средств,
- 21. Применение солей серной кислоты: H2SO4 – используют в качестве минеральных удобрений; – в строительстве; – для
- 22. Получение серной кислоты на производстве S + O2 = SO2 2H2S + 3O2 = 2SO2 +
- 24. Скачать презентацию

















 Инертные газы
Инертные газы Олимпиада по фармацевтической химии. Своя игра
Олимпиада по фармацевтической химии. Своя игра Топливо. Механические топки
Топливо. Механические топки Ионообменная хроматография
Ионообменная хроматография Рідкі кристали
Рідкі кристали  Презентация по Химии "Проблема вмісту нітратів у харчових продуктах" - скачать смотреть бесплатно
Презентация по Химии "Проблема вмісту нітратів у харчових продуктах" - скачать смотреть бесплатно Классификация полимеров 11 класс Соловова Е.А., учитель химии высшей квалификационной категории, МОУ СОШ №15 г.Балашов, 2010
Классификация полимеров 11 класс Соловова Е.А., учитель химии высшей квалификационной категории, МОУ СОШ №15 г.Балашов, 2010 Очищение грязной воды
Очищение грязной воды Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения: Используя оксид ртути (II) напишит
Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения: Используя оксид ртути (II) напишит NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Первоначальные химические понятия
Первоначальные химические понятия Химическое равновесие
Химическое равновесие Презентация по Химии "Презентация Кристаллические и аморфные тела" - скачать смотреть
Презентация по Химии "Презентация Кристаллические и аморфные тела" - скачать смотреть  Загальна характеристика ферментів
Загальна характеристика ферментів Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Соли азотной кислоты
Соли азотной кислоты Эфиры. Жиры
Эфиры. Жиры Нефть и газ. Химический состав и свойства
Нефть и газ. Химический состав и свойства Каучук Презентація учня 11-Б класу гімназії №117 ім. Лесі Українки м. Києва Мусієнка Андрія
Каучук Презентація учня 11-Б класу гімназії №117 ім. Лесі Українки м. Києва Мусієнка Андрія  Липиды - жиры и жироподобные органические соединения, практически нерастворимые в воде
Липиды - жиры и жироподобные органические соединения, практически нерастворимые в воде Презентация Классификация полимеров 11 класс
Презентация Классификация полимеров 11 класс  Структурная химия и кристаллохимия. Введение
Структурная химия и кристаллохимия. Введение ФКХ-Л2 2016
ФКХ-Л2 2016 Побутові хімікати
Побутові хімікати Класс органических соединений фенолы
Класс органических соединений фенолы Периодическая таблица Д.И. Менделеева. Своя игра
Периодическая таблица Д.И. Менделеева. Своя игра Краткая история химии
Краткая история химии Соединения кремния Силикатная промышленность.
Соединения кремния Силикатная промышленность.