Называть: вещества по их химическим формулам; типы химических реакций
Составлять: формулы важнейших
неорганических соединений изученных классов; схемы строения атомов первых 20 элементом Т.М.; уравнения химических реакций
Характеризовать: химические элементы от H до Са на основе их положения в Периодической системе Менделеева и особенностей строения их атомов; химические свойства веществ – представителей различных классов неорганических соединений.
Объяснять: физический смысл порядкового номера химического элемента, номеров группы (для элементов главных подгрупп) и периода в Периодической системе; закономерности в изменении свойств химических элементов и их соединений; сущность химических реакций (ОВР и ионного обмена); взаимосвязь веществ
Определять: принадлежность веществ к определенному классу; тип химической реакции по известным классификационным признакам; вид химической связи и степень окисления элементов; возможность протекания реакций ионного обмена
Проводить: опыты, подтверждающие химический свойства изученных классов неорганических веществ; опыты по получению, собиранию и изучению свойств неорганических веществ
Вычислять массовую долю химического элемента в веществе; массовую долю растворенного вещества в растворе; количество вещества, объём или массу вещества по количеству вещества, объёму или массе реагентов или продуктов реакции
То что, нужно уметь!








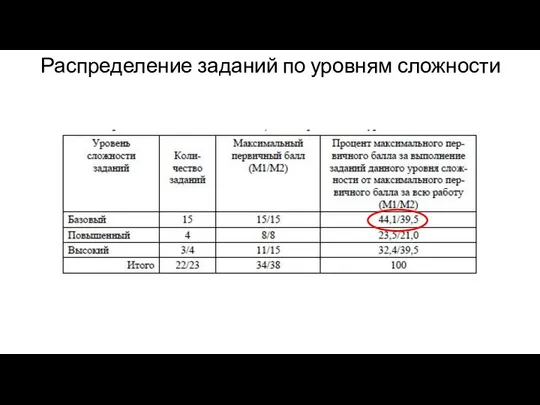

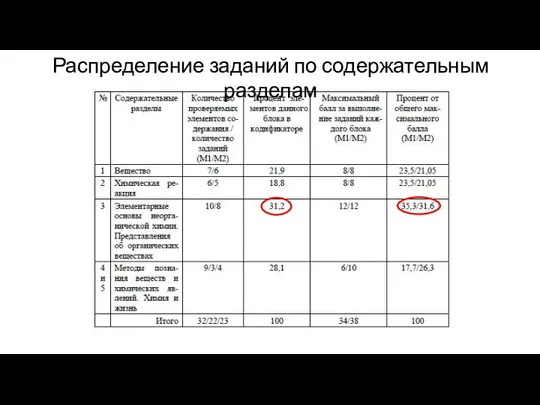

 Химиялық термодинамиканың негіздері. Негізгі түсініктері мен аңдары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен аңдары. Термохимиялық есептеулер Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення 6 классов ферментов и тривиальные названия некоторых основных групп
6 классов ферментов и тривиальные названия некоторых основных групп Алюминий AL- химический элемент
Алюминий AL- химический элемент ХИМИЧЕСКИЕ ВЕЩЕСТВА И ОПАСНЫЕ ОБЪЕКТЫ.
ХИМИЧЕСКИЕ ВЕЩЕСТВА И ОПАСНЫЕ ОБЪЕКТЫ. Знання хімії в різні епохи
Знання хімії в різні епохи Презентация по Химии "Поліпропілен" - скачать смотреть бесплатно
Презентация по Химии "Поліпропілен" - скачать смотреть бесплатно Значення хімії у повсякденному житті Значення хімії у побуті
Значення хімії у повсякденному житті Значення хімії у побуті  Виды частиц в органической химии. Типы реакций
Виды частиц в органической химии. Типы реакций Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Презентация исследовательской работы на тему: «Витамин С и его значение» Ученика 8а класса Чипизубова Дениса ЖМСОШ№1
Презентация исследовательской работы на тему: «Витамин С и его значение» Ученика 8а класса Чипизубова Дениса ЖМСОШ№1 IIIB (d-элемент). Скандий
IIIB (d-элемент). Скандий Промышленная очистка воды
Промышленная очистка воды Oxygen, O2
Oxygen, O2 Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Молярный объём. Относительная плотность
Молярный объём. Относительная плотность Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Пленки Лэнгмюра - Блоджетт
Пленки Лэнгмюра - Блоджетт Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Поліетилен
Поліетилен Физические и химические явления. Химические реакции
Физические и химические явления. Химические реакции Исследовательская (проектная) работа Вулкан в домашних условиях
Исследовательская (проектная) работа Вулкан в домашних условиях Метаболизм белков и аминокислот
Метаболизм белков и аминокислот Работа студентки II курса Козловой Екатерины
Работа студентки II курса Козловой Екатерины  Предмет коллоидной химии. Общая характеристика дисперсных систем
Предмет коллоидной химии. Общая характеристика дисперсных систем «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс)