Содержание
- 2. Цели лекции: Обучающая - Сформировать знания о строении, номенклатуре и реакционной способности гидроксикислот. Развивающая – Расширить
- 3. Классификация. Номенклатура. Гидроксикислоты – производные карбоновых кислот, у которых один или несколько атомов водорода в радикале
- 4. Классификация. Номенклатура. Номенклатура. По заместительной номенклатуре ИЮПАК название производят от названия соответствующей карбоновой кислоты с префиксом
- 5. Отдельные представители Отдельные представители: 1. Молочная кислота (2-гидроксипропановая кислота, α-гидроксипропионовая кислота) Алифатическая, одноосновная, двухатомная. Соли –
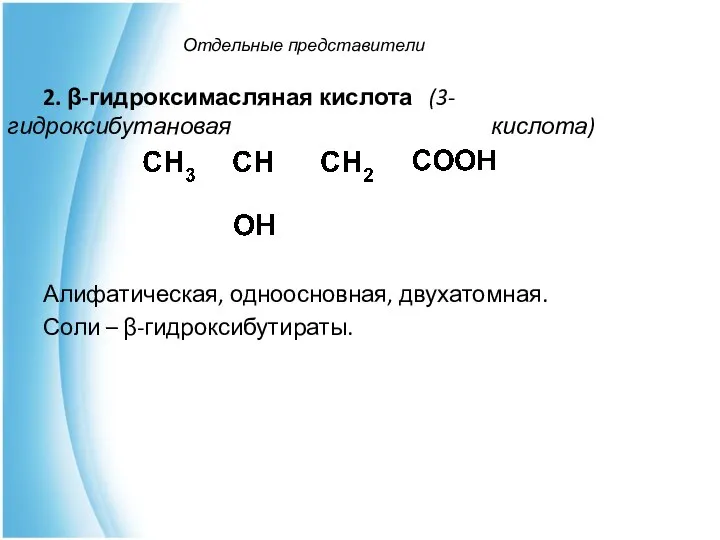
- 6. Отдельные представители 2. β-гидроксимасляная кислота (3-гидроксибутановая кислота) Алифатическая, одноосновная, двухатомная. Соли – β-гидроксибутираты.
- 7. Отдельные представители 3. Яблочная кислота (2-гидроксибутандиовая кислота, α-гидроксиянтарная кислота) Алифатическая, двухосновная, трехатомная. Соли – малаты. Содержится
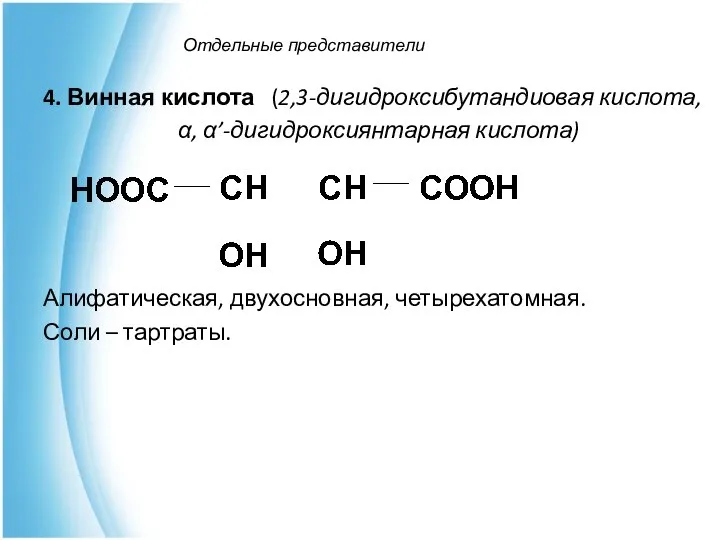
- 8. Отдельные представители 4. Винная кислота (2,3-дигидроксибутандиовая кислота, α, α’-дигидроксиянтарная кислота) Алифатическая, двухосновная, четырехатомная. Соли – тартраты.
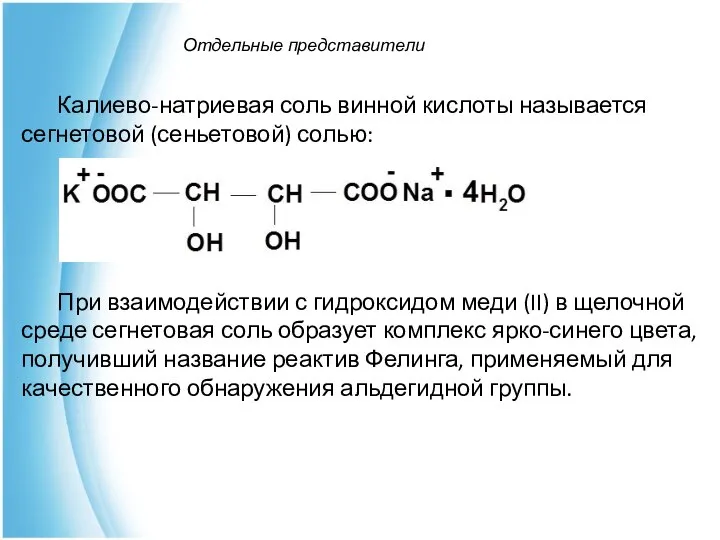
- 9. Отдельные представители Калиево-натриевая соль винной кислоты называется сегнетовой (сеньетовой) солью: При взаимодействии с гидроксидом меди (II)
- 10. Отдельные представители 5. Лимонная кислота (2-гидроксипропан-1,2,3-трикарбоновая кислота) Алифатическая, трехосновная, четырехатомная. Соли - цитраты. Широко используются в
- 11. Отдельные представители 6. Салициловая кислота (2-гидроксибензойная кислота) Ароматическая, одноосновная, двухатомная. Соли - салицилаты. Обладает антисептическими свойствами,
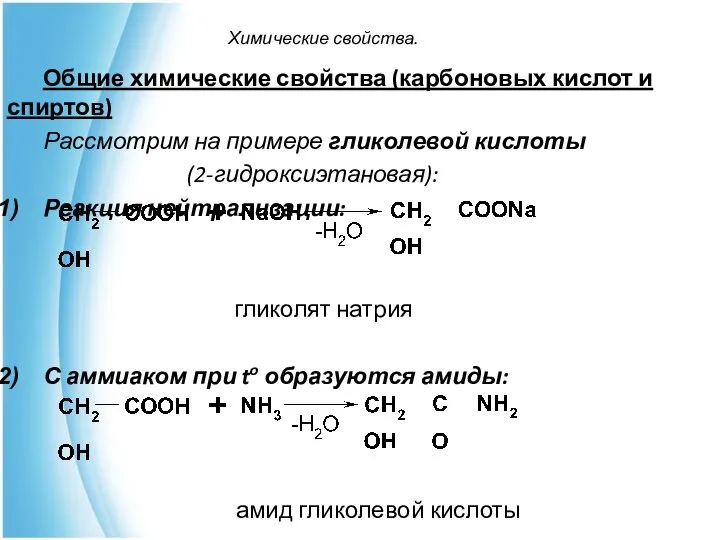
- 12. Химические свойства. Общие химические свойства (карбоновых кислот и спиртов) Рассмотрим на примере гликолевой кислоты (2-гидроксиэтановая): Реакция
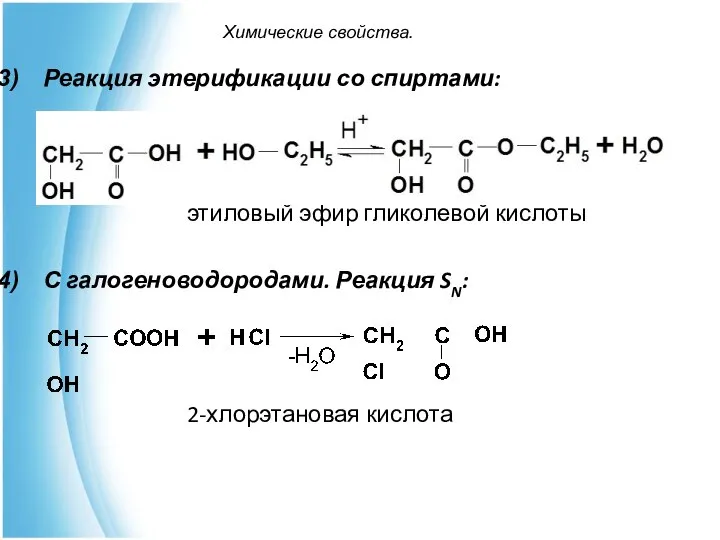
- 13. Химические свойства. Реакция этерификации со спиртами: этиловый эфир гликолевой кислоты С галогеноводородами. Реакция SN: 2-хлорэтановая кислота
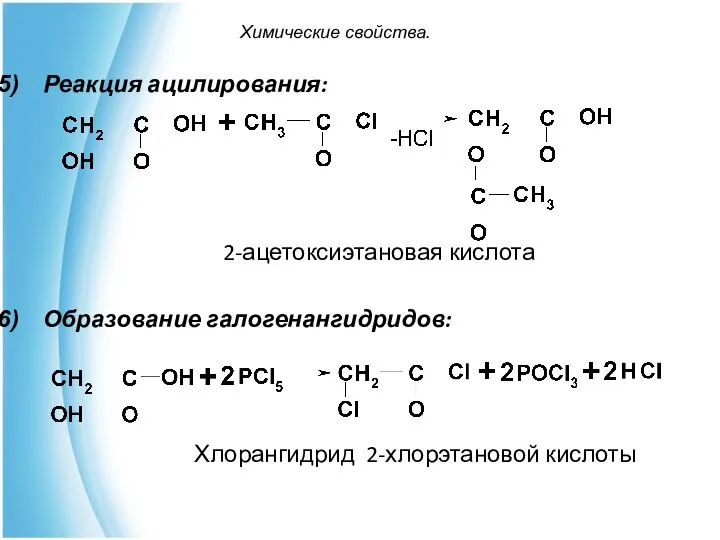
- 14. Химические свойства. Реакция ацилирования: 2-ацетоксиэтановая кислота Образование галогенангидридов: Хлорангидрид 2-хлорэтановой кислоты
- 15. Химические свойства. Реакции окисления: При ферментативном окислении молочной кислоты образуется пировиноградная кислота, яблочной – щавелевоуксусная кислота.
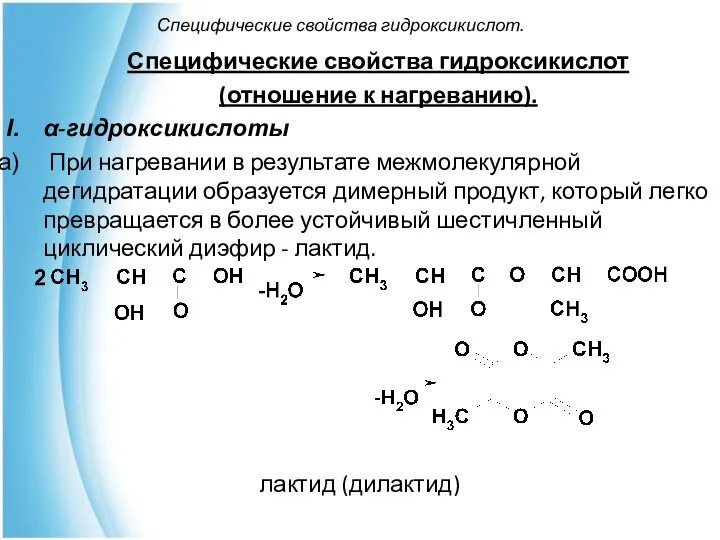
- 16. Специфические свойства гидроксикислот. Специфические свойства гидроксикислот (отношение к нагреванию). α-гидроксикислоты При нагревании в результате межмолекулярной дегидратации
- 17. Специфические свойства гидроксикислот. Лактидами называются циклические эфиры, построенные из двух и более остатков гидроксикислот (не обязательно
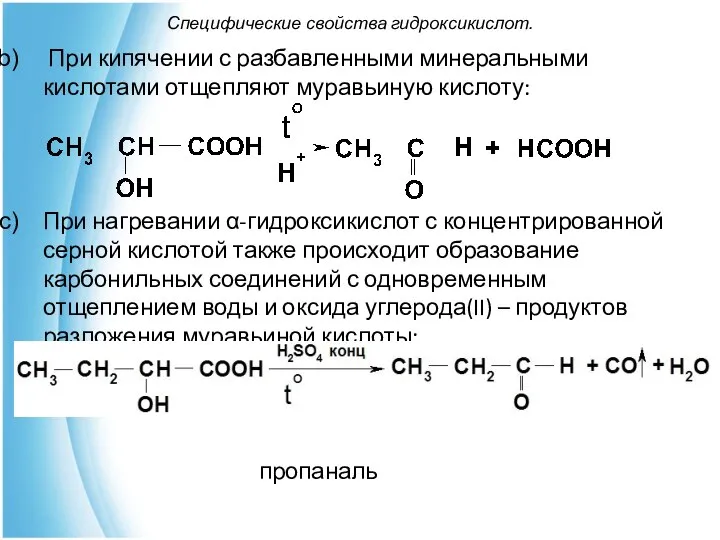
- 18. Специфические свойства гидроксикислот. При кипячении с разбавленными минеральными кислотами отщепляют муравьиную кислоту: При нагревании α-гидроксикислот с
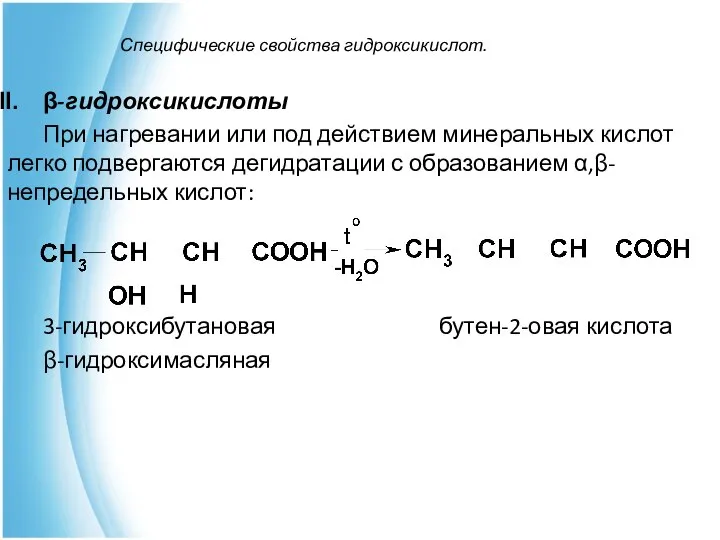
- 19. Специфические свойства гидроксикислот. β-гидроксикислоты При нагревании или под действием минеральных кислот легко подвергаются дегидратации с образованием
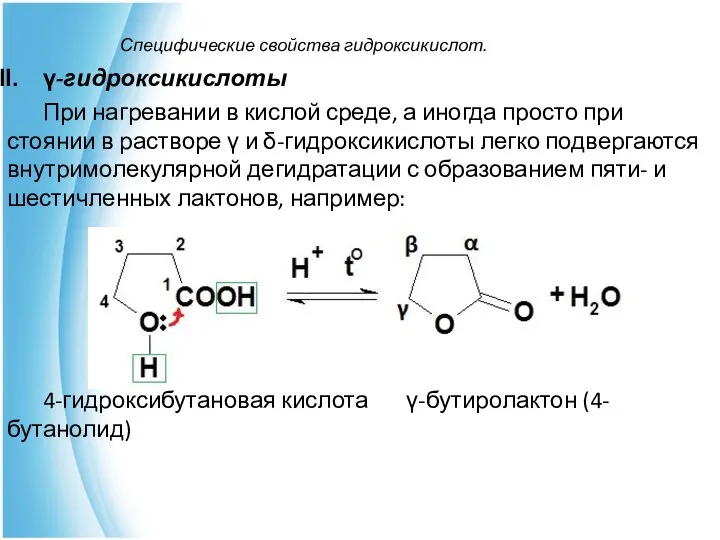
- 20. Специфические свойства гидроксикислот. γ-гидроксикислоты При нагревании в кислой среде, а иногда просто при стоянии в растворе
- 21. Специфические свойства гидроксикислот. Лактонами называются внутренние сложные эфиры гидроксикислот. По номенклатуре ИЮПАК лактоны, образованные из алифатических
- 22. Ароматические гидроксикислоты. Ароматические гидроксикислоты (фенолокислоты) Это производные ароматических карбоновых кислот, у которых один или несколько атомов
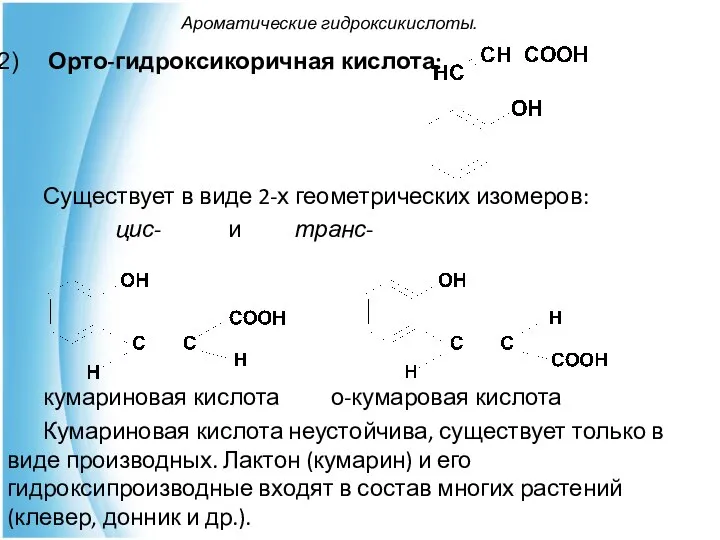
- 23. Ароматические гидроксикислоты. Орто-гидроксикоричная кислота: Существует в виде 2-х геометрических изомеров: цис- и транс- кумариновая кислота о-кумаровая
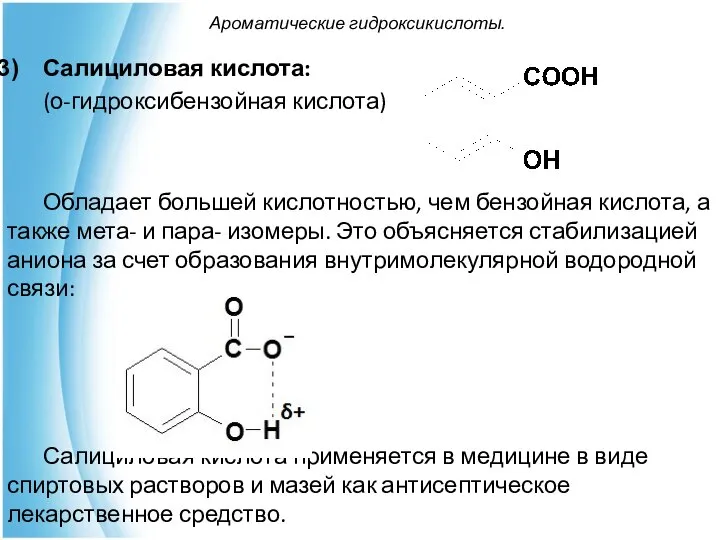
- 24. Ароматические гидроксикислоты. Салициловая кислота: (о-гидроксибензойная кислота) Обладает большей кислотностью, чем бензойная кислота, а также мета- и
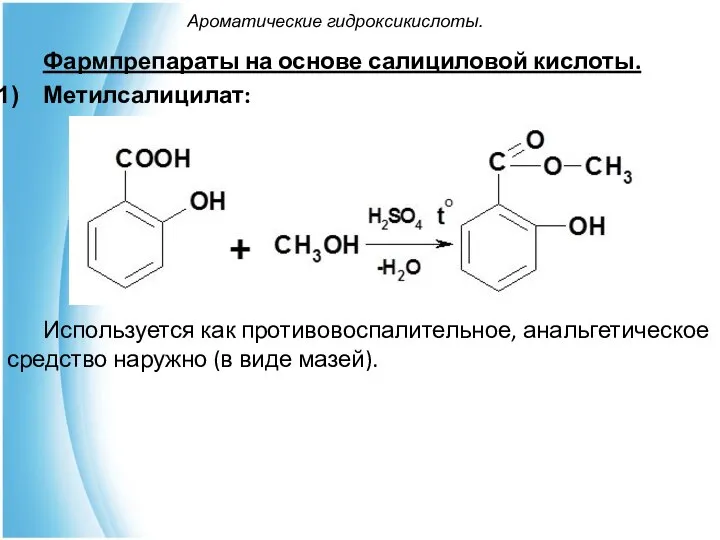
- 25. Ароматические гидроксикислоты. Фармпрепараты на основе салициловой кислоты. Метилсалицилат: Используется как противовоспалительное, анальгетическое средство наружно (в виде
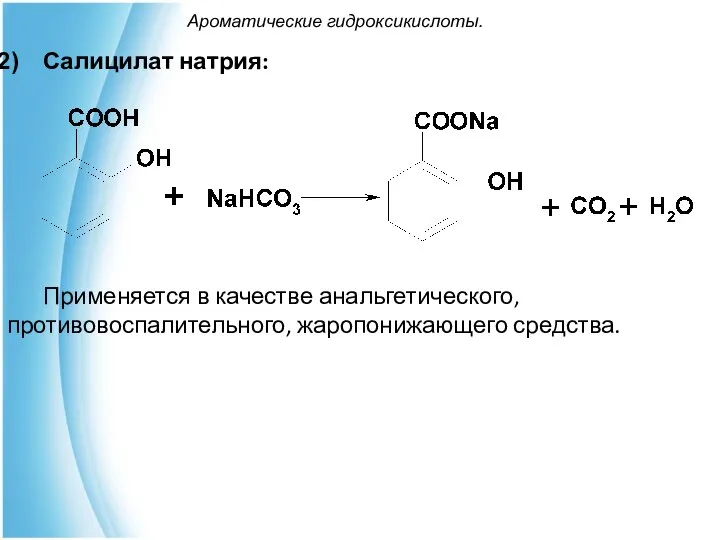
- 26. Ароматические гидроксикислоты. Салицилат натрия: Применяется в качестве анальгетического, противовоспалительного, жаропонижающего средства.
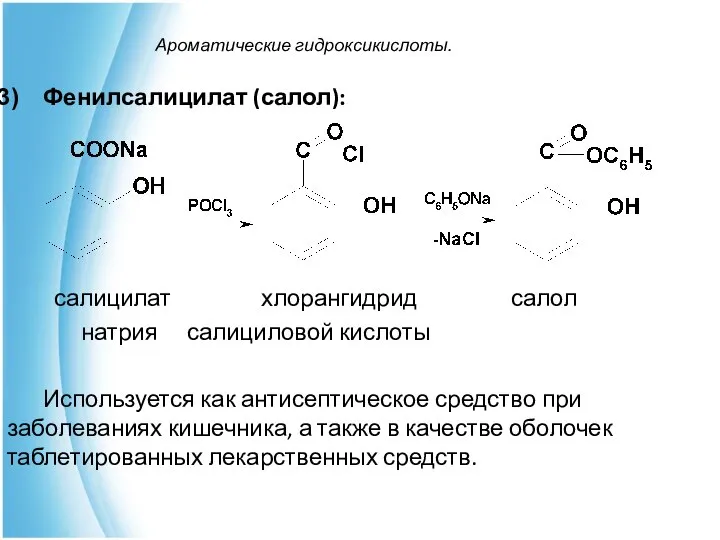
- 27. Ароматические гидроксикислоты. Фенилсалицилат (салол): салицилат хлорангидрид салол натрия салициловой кислоты Используется как антисептическое средство при заболеваниях
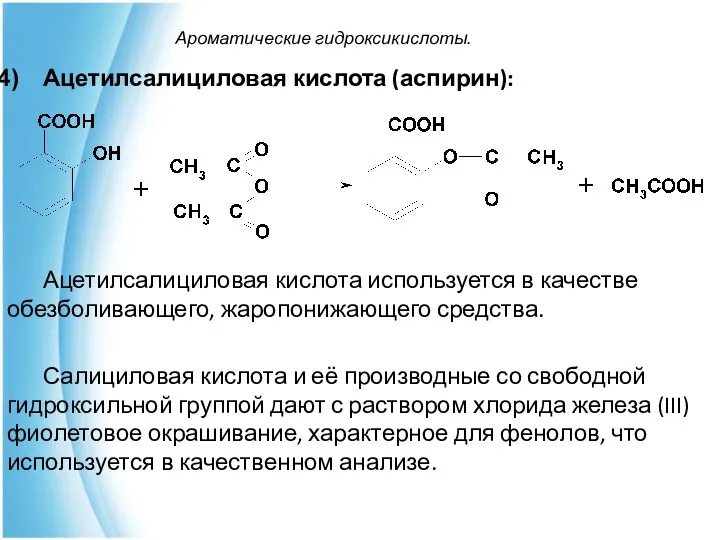
- 28. Ароматические гидроксикислоты. Ацетилсалициловая кислота (аспирин): Ацетилсалициловая кислота используется в качестве обезболивающего, жаропонижающего средства. Салициловая кислота и
- 30. Скачать презентацию











 Презентация по Химии "Презентація про мене" - скачать смотреть
Презентация по Химии "Презентація про мене" - скачать смотреть  Фосфор
Фосфор Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті ОГЭ, вопрос 16 1-4
ОГЭ, вопрос 16 1-4 Начальные этапы обмена липидов
Начальные этапы обмена липидов Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл
Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно
Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно Щавелевая кислота
Щавелевая кислота Хімічний елемент Літій
Хімічний елемент Літій Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Предельные одноатомные спирты
Предельные одноатомные спирты Серебра нитрат и другие препараты серебра. Ртути окись желтая
Серебра нитрат и другие препараты серебра. Ртути окись желтая Посвящение в химики!
Посвящение в химики! Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4)
Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4) Узинская ООШ исслед.работа Лобановой Елизаветы
Узинская ООШ исслед.работа Лобановой Елизаветы ТБ в школе и в быту
ТБ в школе и в быту Твердые тела и их свойства
Твердые тела и их свойства  Геология и геохимия нефти и газа
Геология и геохимия нефти и газа Азотсодержащие органические соединения
Азотсодержащие органические соединения Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 Юные химики
Юные химики Курсовая работа. Влияние микроэлементов на физиологические процессы
Курсовая работа. Влияние микроэлементов на физиологические процессы Материаловедение. Текстильные волокна, пряжа и ткань
Материаловедение. Текстильные волокна, пряжа и ткань Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Презентация по Химии "Углерод" - скачать смотреть
Презентация по Химии "Углерод" - скачать смотреть  Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Теория химического строения А. М. Бутлерова. Часть III
Теория химического строения А. М. Бутлерова. Часть III Платина. Свойства
Платина. Свойства