Содержание
- 2. Критерий протекания окислительно-восстановительных реакций Разность Е1 и Е2называется разностью потенциалов или ЭДС реакции (∆ E или
- 3. Нормальный водородный электрод. Электродный потенциал можно измерить только с помощью другого электрода- электрода сравнения. В качестве
- 5. Ряд стандартных электродных потенциалов Стандартный окислительно-восстановительный потенциал (электродный потенциал), Е0 - потенциал электрода в стандартных условиях:
- 6. Уравнение Нернста Если химическая реакция протекает в условиях, отличных от стандартных, то потенциал любой окислительно-восстановительной системы
- 8. Скачать презентацию
Слайд 2
Критерий протекания окислительно-восстановительных реакций
Разность Е1 и Е2называется разностью потенциалов или
Критерий протекания окислительно-восстановительных реакций
Разность Е1 и Е2называется разностью потенциалов или
ЭДС реакции (∆ E или ЭДС), т.е
∆ E(ЭДС)=Е1-Е2= Еox1/Red1 - Еox2/Red2, где
E1- электродный потенциал восстанавливающейся системы (окисленная форма вещ-ва – окислитель)
E2- электродный потенциал окисляющейся системы (восстановленная форма вещ-ва – восстановитель)
Известно, что связь между свободной энергией Гиббса и электродным потенциалом выражается уравнением:
∆ G= -nF∆Е,
Где ∆ G изменение свободной энергии Гиббса
∆ Е(ЭДС)- электродвижущая сила ОВР, а так как
∆G <0 - термодинамический критерий протекания реакци, то
∆Е=Е1-Е2 >0 - это и есть критерий направленности ОВР, т.е это необходимое, но , не всегда достаточное условие самопроизвольного протекания любой ОВР.
∆ E(ЭДС)=Е1-Е2= Еox1/Red1 - Еox2/Red2, где
E1- электродный потенциал восстанавливающейся системы (окисленная форма вещ-ва – окислитель)
E2- электродный потенциал окисляющейся системы (восстановленная форма вещ-ва – восстановитель)
Известно, что связь между свободной энергией Гиббса и электродным потенциалом выражается уравнением:
∆ G= -nF∆Е,
Где ∆ G изменение свободной энергии Гиббса
∆ Е(ЭДС)- электродвижущая сила ОВР, а так как
∆G <0 - термодинамический критерий протекания реакци, то
∆Е=Е1-Е2 >0 - это и есть критерий направленности ОВР, т.е это необходимое, но , не всегда достаточное условие самопроизвольного протекания любой ОВР.
Слайд 3
Нормальный водородный электрод.
Электродный потенциал можно измерить только с помощью другого электрода-
Нормальный водородный электрод.
Электродный потенциал можно измерить только с помощью другого электрода-
электрода сравнения. В качестве электрода сравнения принимают нормальный водородный электрод.
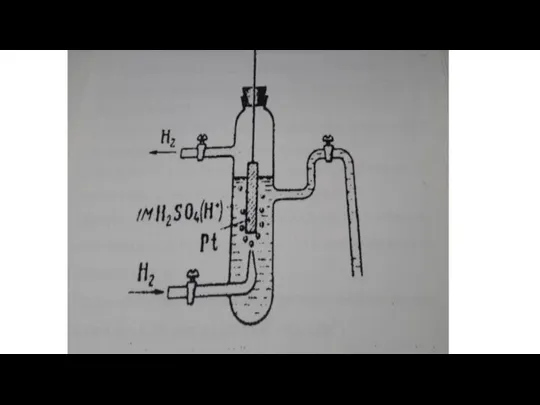
Нормальный водородный электрод- водородный электрод, потенциал которого условно принят равным нулю. Он представляет сосуд с однозарядным раствором H2SO4, через который непрерывно; пропускается водород при давлении 1,013 * 105Па (1 ат) и Т=298К. В раствор кислоты опущена платиновая пластинка (рис. Нормальный водородный электрод.).
Платиновая пластинка способна адсорбировать из своей поверхности водород. В растворе, содержащем катионы H+ и на поверхности, насыщщеной водородом пластинки устанавливается равновесие:
½ H2(Pt) H+(p)+e
Схематично водородный электрод записывается в виде (1/2Н2(pt)|H+)
Нормальный водородный электрод- водородный электрод, потенциал которого условно принят равным нулю. Он представляет сосуд с однозарядным раствором H2SO4, через который непрерывно; пропускается водород при давлении 1,013 * 105Па (1 ат) и Т=298К. В раствор кислоты опущена платиновая пластинка (рис. Нормальный водородный электрод.).
Платиновая пластинка способна адсорбировать из своей поверхности водород. В растворе, содержащем катионы H+ и на поверхности, насыщщеной водородом пластинки устанавливается равновесие:
½ H2(Pt) H+(p)+e
Схематично водородный электрод записывается в виде (1/2Н2(pt)|H+)
Слайд 4
Слайд 5
Ряд стандартных электродных потенциалов
Стандартный окислительно-восстановительный потенциал (электродный потенциал), Е0 -
потенциал
Ряд стандартных электродных потенциалов
Стандартный окислительно-восстановительный потенциал (электродный потенциал), Е0 -
потенциал
электрода в стандартных условиях: P=1,013*105Па (1ат) и Т=298К,
См(ионов)=1 моль/л. Значения Е0 определяются относительно нормального водородного электрода.
Если ОВР протекает в стандартных условиях, то пользуются величинам Е0, значения которых приведены в таблице (в ряду СЭП).
Выводы из ряда СЭП:
1.Чем меньше Е0, тем более сильным восстановителем является металл и, тем более слабым окислителем является его ион (Li, Li+).
2.Чем больше Е0, тем более сильным окислителем является неметалл и, тем более слабым восстановителем является его ион (F2,F-)
3.Водород из разбавленных кислот(HCl, H2SO4)может быть вытеснен только металлами, Е0 которых имеют знак(-), т.е. стоят выше водорода )(относительно нуля).
4.Каждый металл способен вытеснять из растворов солей все металлы, стоящие в ряду СЭП ниже его (Zn+ Cu2+ Cu+ Zn2+)
См(ионов)=1 моль/л. Значения Е0 определяются относительно нормального водородного электрода.
Если ОВР протекает в стандартных условиях, то пользуются величинам Е0, значения которых приведены в таблице (в ряду СЭП).
Выводы из ряда СЭП:
1.Чем меньше Е0, тем более сильным восстановителем является металл и, тем более слабым окислителем является его ион (Li, Li+).
2.Чем больше Е0, тем более сильным окислителем является неметалл и, тем более слабым восстановителем является его ион (F2,F-)
3.Водород из разбавленных кислот(HCl, H2SO4)может быть вытеснен только металлами, Е0 которых имеют знак(-), т.е. стоят выше водорода )(относительно нуля).
4.Каждый металл способен вытеснять из растворов солей все металлы, стоящие в ряду СЭП ниже его (Zn+ Cu2+ Cu+ Zn2+)
Слайд 6
Уравнение Нернста
Если химическая реакция протекает в условиях, отличных от стандартных, то
Уравнение Нернста
Если химическая реакция протекает в условиях, отличных от стандартных, то
потенциал любой окислительно-восстановительной системы можно рассчитать по уравнению Нернста
Е=Е0+2,3RT lg Cxокисл
nF Cyвосст ,где
Сокисл,Свосст- концентрации окисленной и восстановленной форм
x,y- стехиометрические коэфиценты в уравнении реакции
Для стандартных услвоий после подстановки постоянных величин (R,T,F) уравнение Нернста имеет вид:
Е=Е0+ 0,059 lg Cxокисл
n Cyвосст
Для водородного электрода, уравнение Нернста имеет вид:
Е=0+ 0,059 lg cM(H+) = 0,059*lgCM(H+)=-0.059pH
1 cM(H2)
Для металлического электрода Men+/Me восстановленная форма есть чистый металл, для которого CM(Me)=1 моль/л ,
Сx окисл=CM (Men+)
Е=Е0+ 0,059 lg cM (Men+)
n
Е=Е0+2,3RT lg Cxокисл
nF Cyвосст ,где
Сокисл,Свосст- концентрации окисленной и восстановленной форм
x,y- стехиометрические коэфиценты в уравнении реакции
Для стандартных услвоий после подстановки постоянных величин (R,T,F) уравнение Нернста имеет вид:
Е=Е0+ 0,059 lg Cxокисл
n Cyвосст
Для водородного электрода, уравнение Нернста имеет вид:
Е=0+ 0,059 lg cM(H+) = 0,059*lgCM(H+)=-0.059pH
1 cM(H2)
Для металлического электрода Men+/Me восстановленная форма есть чистый металл, для которого CM(Me)=1 моль/л ,
Сx окисл=CM (Men+)
Е=Е0+ 0,059 lg cM (Men+)
n
Следующая -
Облачковое молочко



 Зелёная химия
Зелёная химия Электролитическая диссоциация
Электролитическая диссоциация Биохимия. Введение
Биохимия. Введение «Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г
«Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть
Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть  Углеводы. Строение и функции
Углеводы. Строение и функции Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Разноцветные кристаллы
Разноцветные кристаллы Периодическая Система Д. И. Менделеева в свете учения о строении атома
Периодическая Система Д. И. Менделеева в свете учения о строении атома Ферменты. Свойства ферментов
Ферменты. Свойства ферментов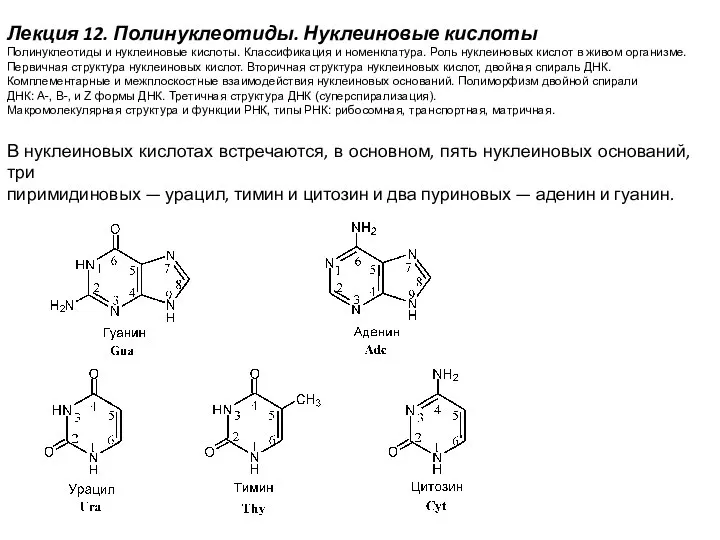 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты Методи визначення питомої поверхні
Методи визначення питомої поверхні Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде
Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Бор (Borum)
Бор (Borum) Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Воздух - источник жизни на земле. (3 класс)
Воздух - источник жизни на земле. (3 класс) Металлы в природе. Общие способы их получения.
Металлы в природе. Общие способы их получения. Задача о смесях
Задача о смесях МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА.
МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА. Индивидуальные задания для самостоятельной работы студентов нехимических специальностей
Индивидуальные задания для самостоятельной работы студентов нехимических специальностей Процессы технологии природных энергоносителей и углеродных материалов
Процессы технологии природных энергоносителей и углеродных материалов Технология поликристаллического кремния. Его применение
Технология поликристаллического кремния. Его применение Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары
Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары Презентация по Химии "Металлы. Типы сплавов" - скачать смотреть
Презентация по Химии "Металлы. Типы сплавов" - скачать смотреть  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс