Содержание
- 2. Вопросы для рассмотрения 1. Окислительно-восстановительные реакции. 2. Расчет молярных масс эквивалента окислителя и восстановителя. 3. Метод
- 3. Окисли́тельно-восстанови́тельные реа́кции (ОВР) — - химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав
- 4. Значение окислительно-восстановительных процессов Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций. На их долю приходится
- 5. Окисление веществ, поступающих в организм Стадии превращения: - постепенное удаление атомов водорода ( - 2Н+ -
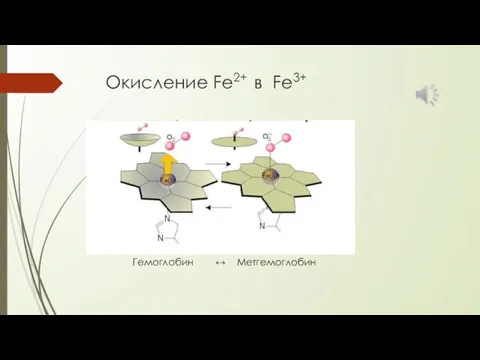
- 6. Окисление Fe2+ в Fe3+ Гемоглобин ↔ Метгемоглобин
- 7. Образование свободных радикалов Fe2+ + →•O-O• + H+ → Fe3+ + HO-O• e Red1 + молекула
- 8. Антиоксиданты Витамины группы Е – токоферолы Аскорбиновая кислота Антиоксиданты – вещества, обратимо реагирующие со свободными радикалами
- 9. Окислительно-восстановительная реакция Окислитель + Восстановитель ↔ Восстановленная + Окисленная форма ок-ля форма восс-ля ↔
- 10. Примеры окислителей Атомы или молекулы сильно электроотрицательных элементов : F2 O2 Cl2 N2 S Сложные анионы,
- 11. Примеры восстановителей Атомы электроположительных элементов (атомы щелочных и щелочно-земельных металлов) Na Li K Ba Ca Sr
- 12. Примеры веществ с двойственными свойствами S2- SO32- SO42- -2 +4 +6 NH4 NO2- NO3- -3 +3
- 13. Окислительно-восстановительная активность перманганат-иона в различных средах
- 14. Сопряженные редокс-системы Ох1 + Red2 ↔ Red1 + Ox2 e 2 MnO4- + 5 CH3-CH-COOH +
- 15. Расчет молекулярных масс эквивалентов окислителя и восстановителя Расчет проводится по формуле: Mэ = 1/z × M,
- 17. Ионно-электронный баланс (метод полуреакций) Ионная схема реакции с указанием характера среды Ионно-электронные уравнения процессов восстановления окислителя
- 18. Баланс атомов кислорода и водорода
- 19. Уравнивание числа атомов кислорода и водорода Возможные варианты: а) избыточный кислород в левой части уравнения: в
- 20. Кислая среда
- 21. Щелочная среда
- 22. Нейтральная среда
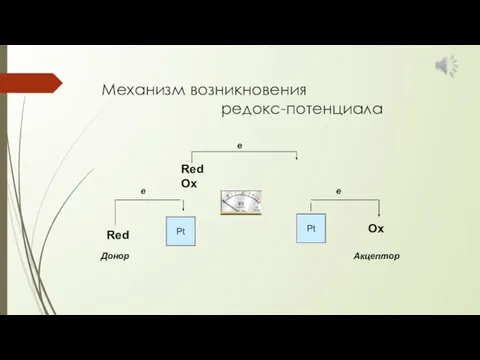
- 23. Механизм возникновения редокс-потенциала Red Ox e Pt Pt Red Ox Донор Акцептор е е
- 24. Редокс - потенциал ВОЗНИКНОВЕНИЕ О-В ПОТЕНЦИАЛА Fe2+ - 1 e = Fe3+ восст-ль ок-ль
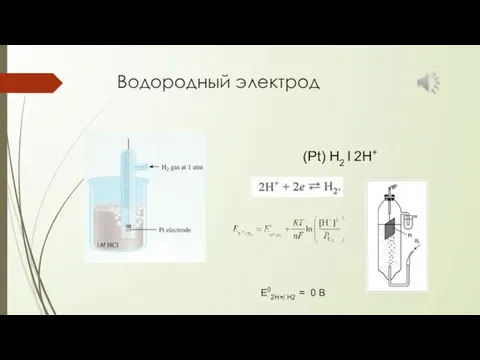
- 25. Водородный электрод (Pt) H2 l 2H+ Е02Н+/ Н2 = 0 В
- 26. Редокс-потенциал Величина потенциала зависит от: природы окисленной и восстановленной форм вещества; концентрации окисленной и восстановленной форм;
- 27. Герман Вальтер Нернст 1864 – 1941 Немецкий химик Лауреат Нобелевской Премии 1920 года за признание работ
- 28. Стандартные окислительно-восстановительные потенциалы
- 29. Выводы, которые можно сделать из сопоставления окислительно-восстановительных потенциалов Чем выше окислительно-восстановительный потенциал системы, тем более сильные
- 30. Мидпойнт – потенциалы
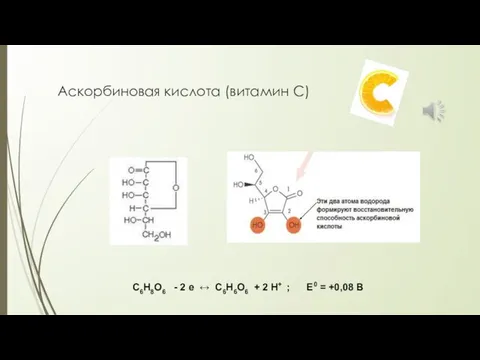
- 31. Аскорбиновая кислота (витамин С) С6Н8О6 - 2 е ↔ С6Н6О6 + 2 Н+ ; Е0 =
- 32. Задание 1. Какая реакция произойдет, если привести в контакт следующие две равновесные окислительно-восстановительные системы. Напишите уравнения
- 33. Задание 2. Какой из приведенных окислителей следует взять для перевода Mn2+ → MnO4- Eo = 1,51
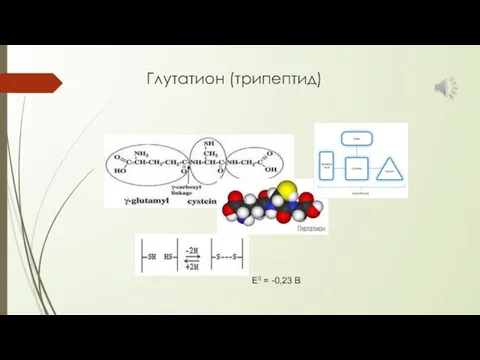
- 34. Глутатион (трипептид) Е0 = -0,23 В
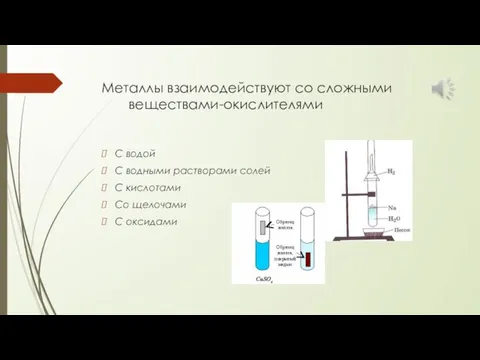
- 35. Металлы взаимодействуют со сложными веществами-окислителями С водой С водными растворами солей С кислотами Со щелочами С
- 36. Взаимодействие металлов с водой 2 Cs + 2H2O = 2 CsOH + H2
- 37. Электродный потенциал Ме0 – n e Men+ Mnn+ + n e Mn0
- 38. Механизм возникновения электродного потенциала Zn0 - 2 e ↔ Zn2+ Cu2+ + 2e ↔ Cu0
- 39. Стандартные электродные потенциалы, В φ0 Men+ Me0,В Ме0 - n e ↔ Men+
- 40. Окислительные свойства серной кислоты Разбавленная серная кислота – окислитель за счет ионов Н+: 2 Н+ +
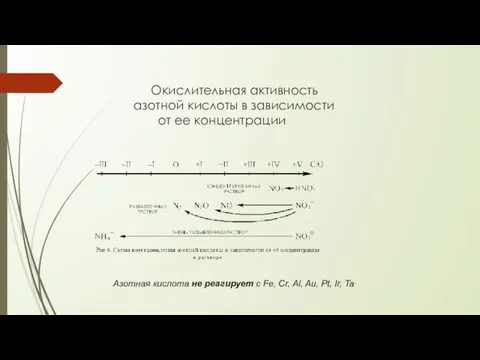
- 41. Окислительная активность азотной кислоты в зависимости от ее концентрации Азотная кислота не реагирует с Fe, Cr,
- 42. Вопрос 1. Какое из веществ может быть только окислителем? 1. K2SO3; 2. Al; 3. KMnO4; 4.
- 43. Вопрос 2. Какое из веществ может быть только восстановителем? 1. K2Cr2O7; 2. FeSO4; 3. Fe2(SO4)3; 4.
- 44. Вопрос 3. Рассчитайте молярную массу эквивалента окислителя в реакции: KMnO4 + FeSO4 + H2SO4 → MnSO4
- 45. Вопрос 4. Какая из систем проявляет самые сильные окислительные свойства? MnO4- + 5e + 8H+ ↔
- 47. Скачать презентацию





































 Производства аммиака. Лекция 7
Производства аммиака. Лекция 7 Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Курс «Неорганическая химия» Лектор: Третьяков Юрий Дмитриевич Расписание лекций: вторник – 10:50 – 12:25 пятни
Курс «Неорганическая химия» Лектор: Третьяков Юрий Дмитриевич Расписание лекций: вторник – 10:50 – 12:25 пятни Аминокислоты
Аминокислоты Строение и функция углеводов и жиров
Строение и функция углеводов и жиров Железо
Железо Презентация по Химии "Альдегиды, свойства, получение, применение" - скачать смотреть
Презентация по Химии "Альдегиды, свойства, получение, применение" - скачать смотреть  Презентация Дисахариды
Презентация Дисахариды Новые стеклообразные материалы и методы их синтеза. Аморфные и стеклообразные материалы
Новые стеклообразные материалы и методы их синтеза. Аморфные и стеклообразные материалы Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»
Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»  Задачи на «избыток-недостаток»
Задачи на «избыток-недостаток»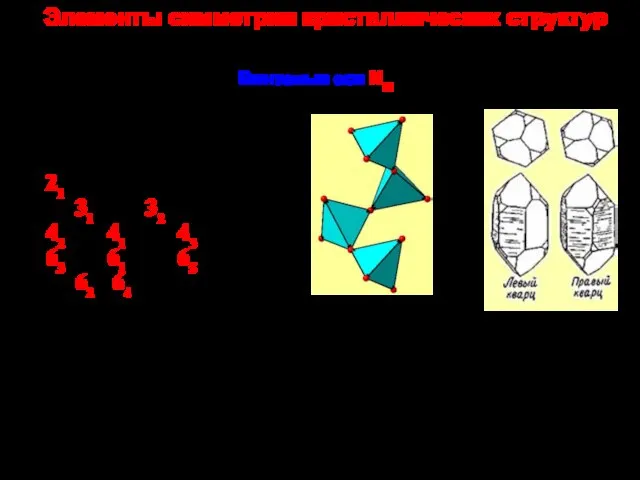 Элементы симметрии кристаллических структур
Элементы симметрии кристаллических структур Алмази
Алмази  Сырье для химической промышленности
Сырье для химической промышленности Химия элементов VIA группы. Сера
Химия элементов VIA группы. Сера Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома
Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома Бензен
Бензен Сульфур Негативній вплив сульфуровмісних сполук
Сульфур Негативній вплив сульфуровмісних сполук  Фазовые превращения в стали (1)
Фазовые превращения в стали (1) Ферменты
Ферменты Кинетика химических реакций
Кинетика химических реакций Основные понятия и определения. Химическая кинетика
Основные понятия и определения. Химическая кинетика Масс-спектрометрия
Масс-спектрометрия Полімери. Застосування
Полімери. Застосування Поверхностные явлении и дисперсные системы (коллоидная химия)
Поверхностные явлении и дисперсные системы (коллоидная химия) Основные законы химии
Основные законы химии Первоначальная периодическая таблица Д.И.Менделеева
Первоначальная периодическая таблица Д.И.Менделеева Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот (цикл Кребса)