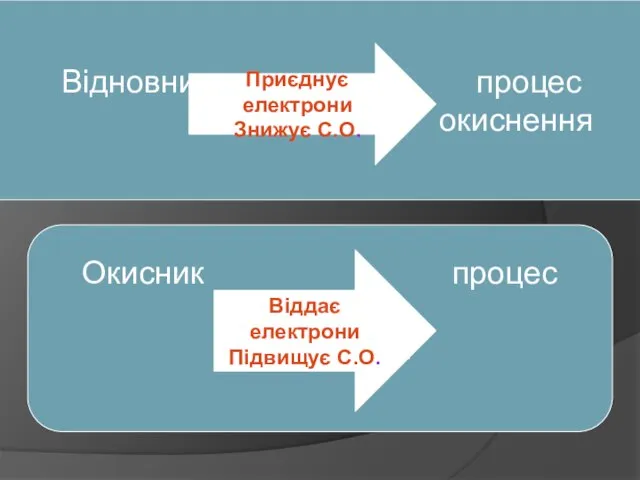
- Записуємо схему реакції
Zn + H2SO4(к) = ZnSO4 +SO2 + H2O
-
Визначаємо СО елементів у лівій і правій частині схеми, підкреслюємо ті, які змінили СО
0 +1 +6 -2 +2+6 -2 +4 -2 +1 -2
Zn + H2SO4(к) = ZnSO4 +SO2 + H2O - Складаємо схему електронного балансу, вказуємо окисник і відновник
0 +2
Zn – 2e Zn 1 відновник
+6 +4 2
S + 2e S 1 окисник
- Підставляємо одержані коефіцієнти у схему
Zn + H2SO4(к) = ZnSO4 +SO2 + H2O
- Зрівнюємо кількість атомів інших елементів і перевіряємо за Оксигеном
Zn +2H2SO4(к) = ZnSO4 +SO2 + 2H2O
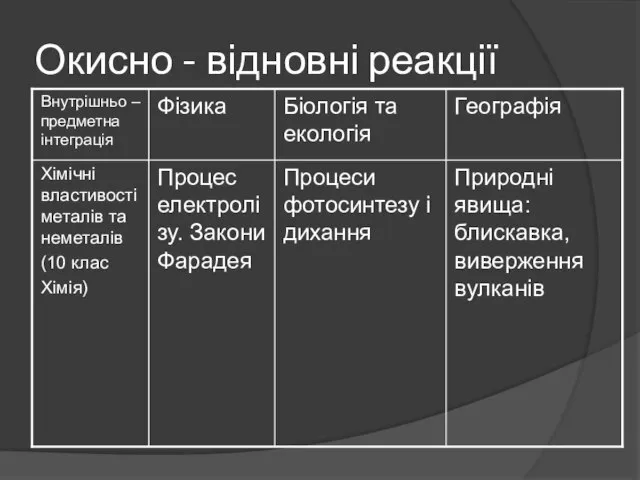
Алгоритм складання рівнянь
окисно – відновних реакцій



 Молекулы и атомы
Молекулы и атомы КИСЛОТЫ Путешествие в мир кислот Учитель: Переходцева Л.А. Учащиеся 8 а класса: Абросимов Евгений, Шемелина Яна, Шевченко Евгения
КИСЛОТЫ Путешествие в мир кислот Учитель: Переходцева Л.А. Учащиеся 8 а класса: Абросимов Евгений, Шемелина Яна, Шевченко Евгения Любовь как цепь биохимических реакций
Любовь как цепь биохимических реакций Метаморфизм. Факторы метаморфизма
Метаморфизм. Факторы метаморфизма Методы исследования структуры кристаллов
Методы исследования структуры кристаллов Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Презентация по Химии "Решение задач по химическим уравнениям" - скачать смотреть
Презентация по Химии "Решение задач по химическим уравнениям" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Урок розв’язування задач
Урок розв’язування задач Арены. Бензол С6Н6
Арены. Бензол С6Н6 Ауыр металдар
Ауыр металдар Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Биологические мембраны. Структурная организация
Биологические мембраны. Структурная организация Металлический водород
Металлический водород Основы органической химии
Основы органической химии Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Углеводородные и неуглеводородные соединения нефти. Физические свойства нефти. Химические классификации нефти
Углеводородные и неуглеводородные соединения нефти. Физические свойства нефти. Химические классификации нефти Презентация по химии Электрофильное замещение в ароматических соединениях.
Презентация по химии Электрофильное замещение в ароматических соединениях.  Алюминий и его соединения
Алюминий и его соединения Научные фокусы. Лавовая лампа
Научные фокусы. Лавовая лампа Альдегиды и кетоны
Альдегиды и кетоны Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены
Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены Увлекательная химия
Увлекательная химия ПИЩЕВЫЕ ДОБАВКИ-Е Выполнила ученица 10 класса Цатурова Аида Арташевна
ПИЩЕВЫЕ ДОБАВКИ-Е Выполнила ученица 10 класса Цатурова Аида Арташевна Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Растворы
Растворы