Содержание
- 2. ПЛАН: Определение гомологического ряда алканов Метан Строение алканов Номенклатура алканов Изомерия алканов Получение алканов Физические свойства
- 3. ОПРЕДЕЛЕНИЕ Алканы – алифатические (ациклические) углеводороды, в молекулах которых атомы углерода связаны между собой одинарными σ-связями,
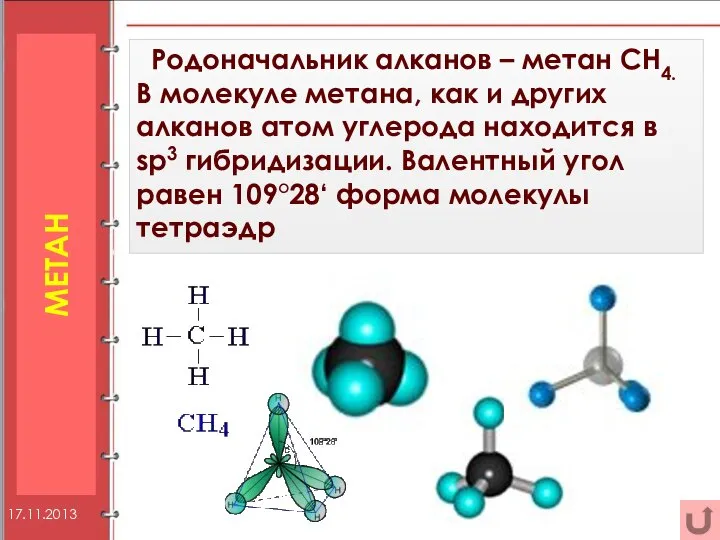
- 4. МЕТАН Родоначальник алканов – метан СН4. В молекуле метана, как и других алканов атом углерода находится
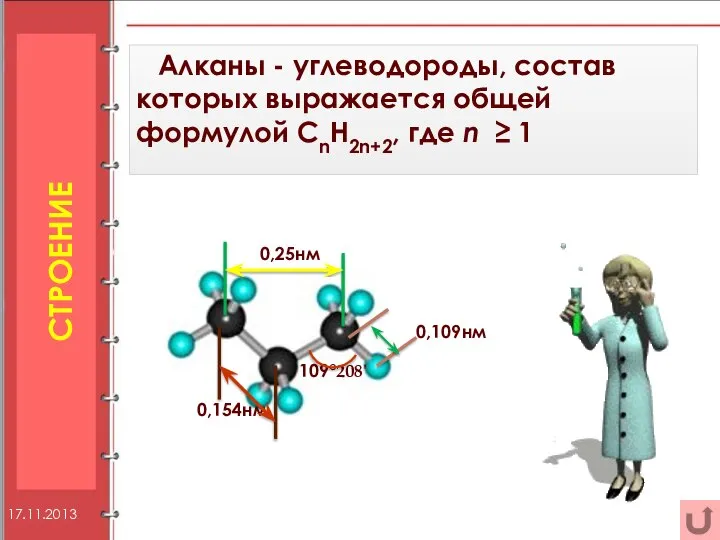
- 5. СТРОЕНИЕ Алканы - углеводороды, состав которых выражается общей формулой CnH2n+2, где n ≥ 1 0,25нм 0,109нм
- 6. ЗАКРЕПИМ Общая формула алканов CnH2n+2 Гибридизация sp3 Все связи атома углерода направлены к вершинам тетраэдра Все
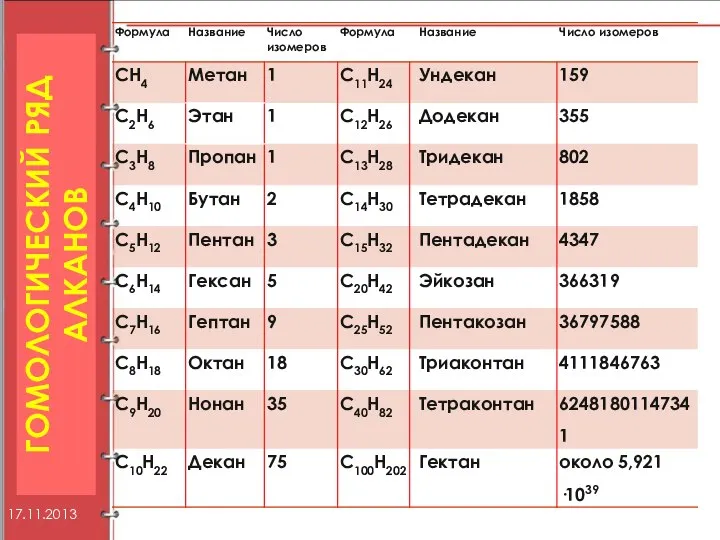
- 7. ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ 17.11.2013
- 8. НОМЕНКЛАТУРА Найти самую длинную цепь; Пронумеровать цепь с того конца где ближе разветвление; Выделить заместители; Место
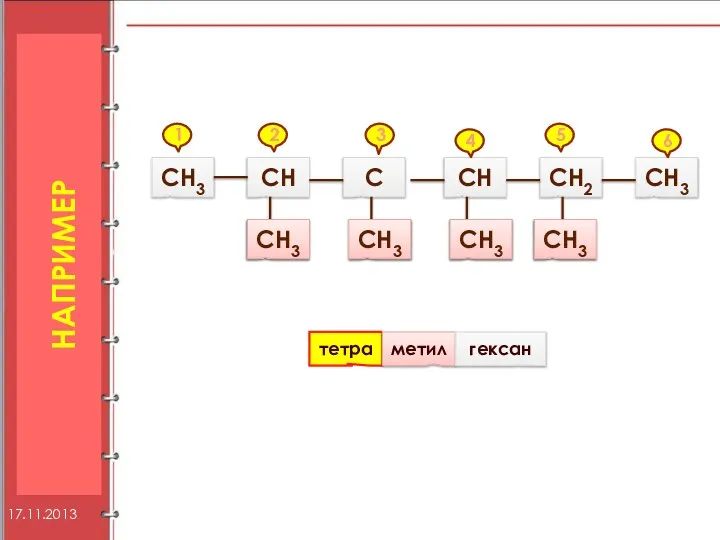
- 9. НАПРИМЕР СН3 СН С СН3 СН3 СН3 СН СН2 СН3 СН3 1 2 3 4 5
- 10. ИЗОМЕРИЯ Изомерия углеродного скелета c C4; 17.11.2013
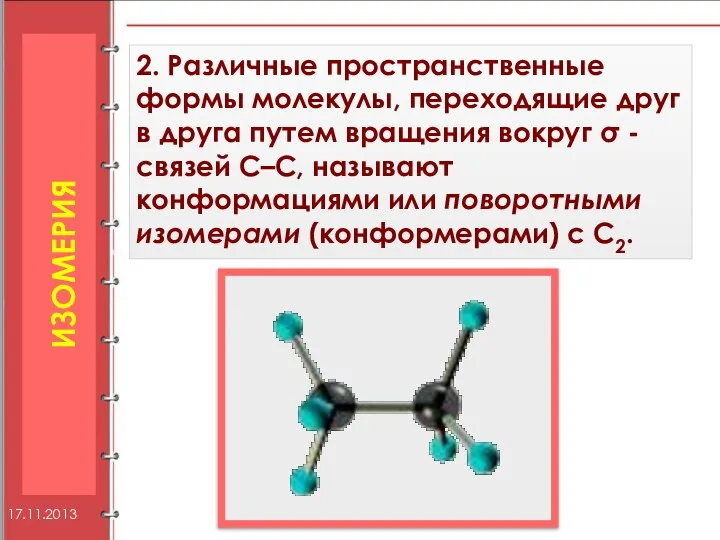
- 11. 2. Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг σ -связей С–С, называют
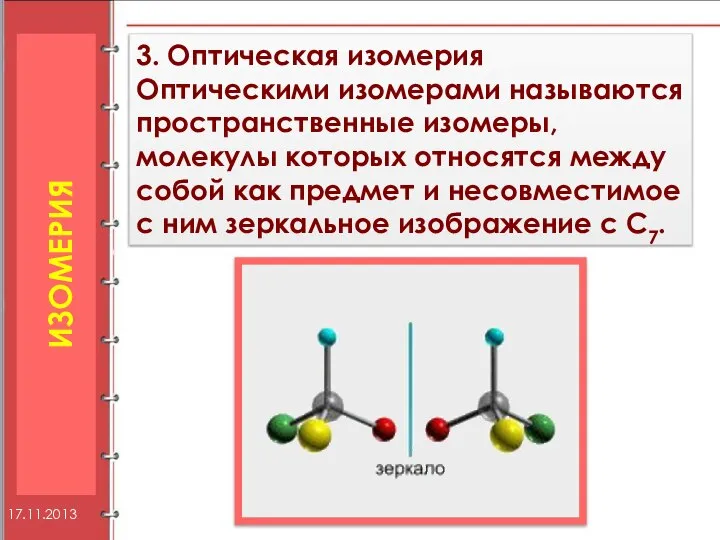
- 12. 3. Оптическая изомерия Оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и
- 13. ПОЛУЧЕНИЕ МЕТАНА Разложение карбида алюминия: Al4C3 + 12H2O = 3CH4↑ + 4Al(OH)3; Синтез из простых веществ
- 14. ПОЛУЧЕНИЕ АЛКАНОВ Промышленные способы: Выделение из природного газа, нефти, твердых парафинов; Химическая переработка угля; Получение на
- 15. ПОЛУЧЕНИЕ АЛКАНОВ В ПРОМЫШЛЕННОАСТИ 1. Природные источники углеводородов: нефть, уголь, природный и попутный нефтяной газ. Содержание
- 16. ПОЛУЧЕНИЕ АЛКАНОВ В ПРОМЫШЛЕННОСТИ 2. Получение на основе «синтез-газа» nCO + (2n+1)H2 t(170-320°) kat CnH2n+2 «синтез-газ»
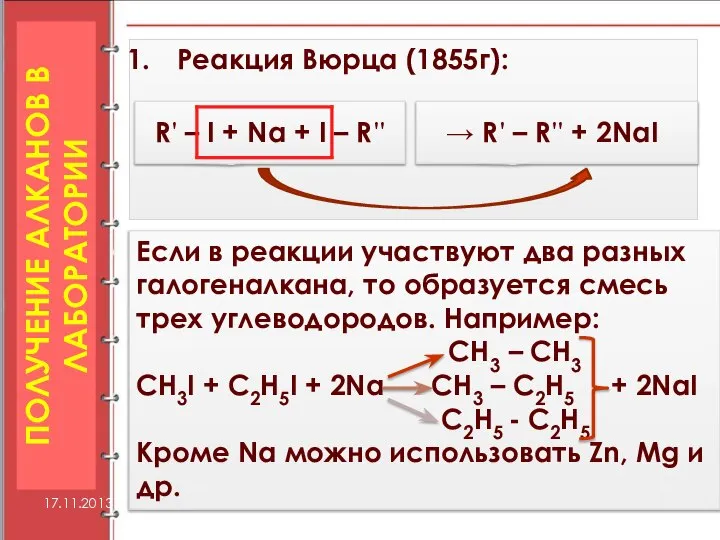
- 17. ПОЛУЧЕНИЕ АЛКАНОВ В ЛАБОРАТОРИИ Реакция Вюрца (1855г): 17.11.2013 R' – I + Na + I –
- 18. 2. Электролиз солей одноосновный карбоновых кислот. Реакция Кольбе (Ме - одновалентный) 2R-COONa + H2O → R
- 19. 3. Декарбоксилирование солей одноосновный карбоновых кислот реакция Дюма: 17.11.2013 ПОЛУЧЕНИЕ АЛКАНОВ В ЛАБОРАТОРИИ R-COONa + NaOH
- 20. 4. Каталитическое гидрирование (гидрогенизация) непредельных углеводородов (катализаторы Ni, Pt, Pd, t и P) СnH2n + 2H2
- 21. 5. Получение из производных алканов. R-Mg-X + H-OH → R – H + Mg(OH)X CH3-Mg-Cl +
- 22. С1 – С4 – газы без запаха и цвета; С5 – С17 – жидкости без цвета
- 23. ХИМИЧЕСКИЕ СВОЙСТВА 17.11.2013
- 24. Реакции радикального замещения (SR). 17.11.2013
- 25. Галогенирование CH4 + Cl2 → HCl + CH3Cl (хлорметан или хлористый метил) CH3Cl + Cl2 →
- 26. Реакционная способность убывает в рядах: F2 > Cl2 > Br2 > I2 R3C – H >
- 27. Инициирование (зарождение цепи) Cl2 → 2Cl · 2. Рост (развитие) цепи CH4 + Cl· → ·CH3
- 28. 2. Нитрование (реакция Коновалова), при температуре 140°С, 13% азотной кислотой CnH2n+2 + HO – NO2 →
- 29. РЕАКЦИИ ОКИСЛЕНИЯ 17.11.2013
- 30. 1. Горение или полное окисление СН4 + 2О2 → СО2 + Н2О +880кДж Общее уравнение: CnH2n+2
- 31. 2. Неполное окисление: А) метана: 2CH4 + O2 → 2CH3OH +3H2 (kat, t) b) 2CH4 +
- 32. Термические превращения 17.11.2013
- 33. А) Термическое разложение метана при сильном нагревании (выше 1000°С) без доступа воздуха (пиролиз) СН4 → 2С
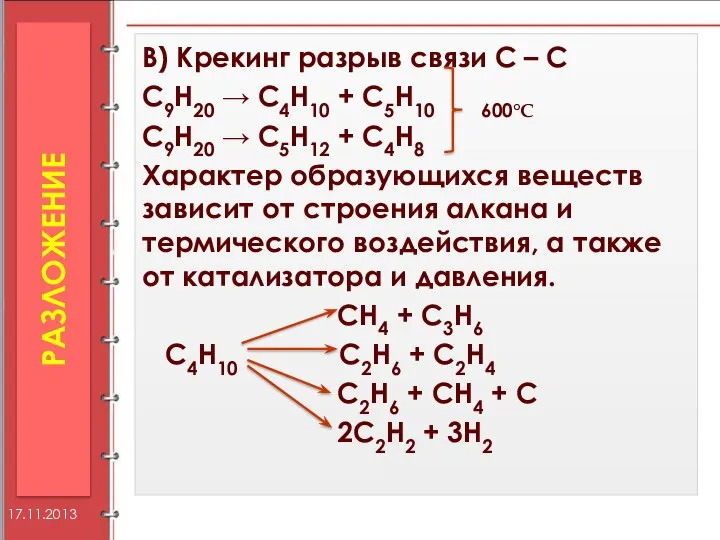
- 34. В) Крекинг разрыв связи С – С С9Н20 → С4Н10 + С5Н10 600°С С9Н20 → С5Н12
- 35. Г ) Дегидрирование C2H6 → C2H4 + H2 (300°, Cr2O3, Р) Д) Дегидроциклизация (ароматизация) характерна для
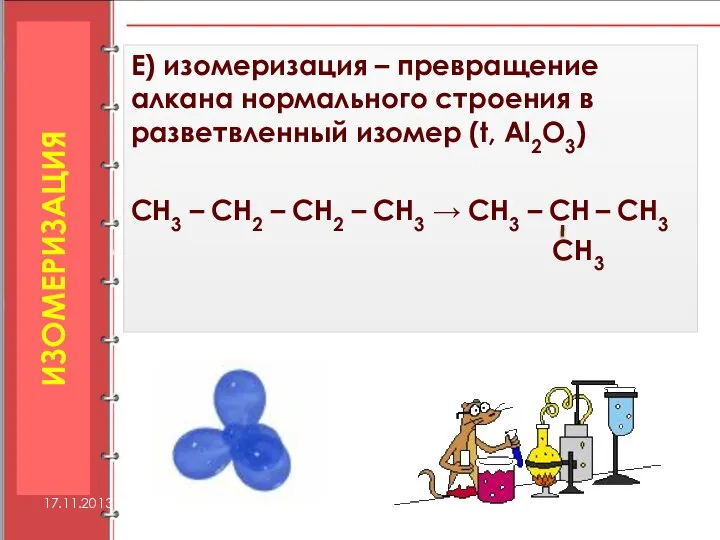
- 36. Е) изомеризация – превращение алкана нормального строения в разветвленный изомер (t, Al2O3) СН3 – СН2 –
- 37. Процесс конверсии протекает при высокой температуре (800 - 900°) и в присутствии никелевого катализатора. В этих
- 39. Скачать презентацию






















 Солі амонію
Солі амонію  Роль лабораторного практикума в изучении предмета химии ГОУ школа №338 Учитель биологии и химии высшей квалификационной категори
Роль лабораторного практикума в изучении предмета химии ГОУ школа №338 Учитель биологии и химии высшей квалификационной категори Рафинирование металлических расплавов
Рафинирование металлических расплавов Гидроксид натрия
Гидроксид натрия Хімія і екологія
Хімія і екологія  Мийна дія мила Степанова Євстаф’єва
Мийна дія мила Степанова Євстаф’єва  Биохимические механизмы регуляции численности. (Лекция 3)
Биохимические механизмы регуляции численности. (Лекция 3) Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Презентация по Химии "Колообіг Оксигену, Нітрогену, Карбону в природі" - скачать смотреть бесплатно
Презентация по Химии "Колообіг Оксигену, Нітрогену, Карбону в природі" - скачать смотреть бесплатно Ш. Мәрҗани исемендәге Комыргуҗа урта мәктәбе Физика укытучысы Шәрәфетдинова Р.З. 2012 ел
Ш. Мәрҗани исемендәге Комыргуҗа урта мәктәбе Физика укытучысы Шәрәфетдинова Р.З. 2012 ел Ионообменные материалы для сорбции биологически активных веществ
Ионообменные материалы для сорбции биологически активных веществ Аттестационная работа. Проектные работы учащихся по химии. Эссе
Аттестационная работа. Проектные работы учащихся по химии. Эссе Некоторые примеры использования Ферментов в промышленности
Некоторые примеры использования Ферментов в промышленности Применение неметаллов и их соединений
Применение неметаллов и их соединений Нуклеиновые кислоты
Нуклеиновые кислоты Презентация по Химии "«Атомы химических элементов»." - скачать смотреть бесплатно
Презентация по Химии "«Атомы химических элементов»." - скачать смотреть бесплатно Инертные газы
Инертные газы Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Органическое топливо. Теплота сгорания топлива
Органическое топливо. Теплота сгорания топлива Химические свойства кислот
Химические свойства кислот Химическое равновесие
Химическое равновесие IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат
IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат Химические свойства бензола Савенков Сергей 10 «Б» кл.
Химические свойства бензола Савенков Сергей 10 «Б» кл.  Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Синтез и изучение свойств фоточувствительного холестерического жидкого кристалла
Синтез и изучение свойств фоточувствительного холестерического жидкого кристалла Углеводы. Глюкоза-представитель моносахаридов
Углеводы. Глюкоза-представитель моносахаридов  Методические рекомендации по изучению темы «Азот как простое вещество»
Методические рекомендации по изучению темы «Азот как простое вещество» Термические процессы нефтепереработки
Термические процессы нефтепереработки