Содержание
- 2. Поверхностные явления – процессы, протекающие на границе раздела фаз и обусловленные особенностями состава и структуры поверхностей.
- 3. Поверхностное натяжение [Дж/м2] Физический смысл σ: Энергия (Дж/м2) Сила (Н/м) σН2О = 72,75⋅10-3 Дж/м2 при 298о
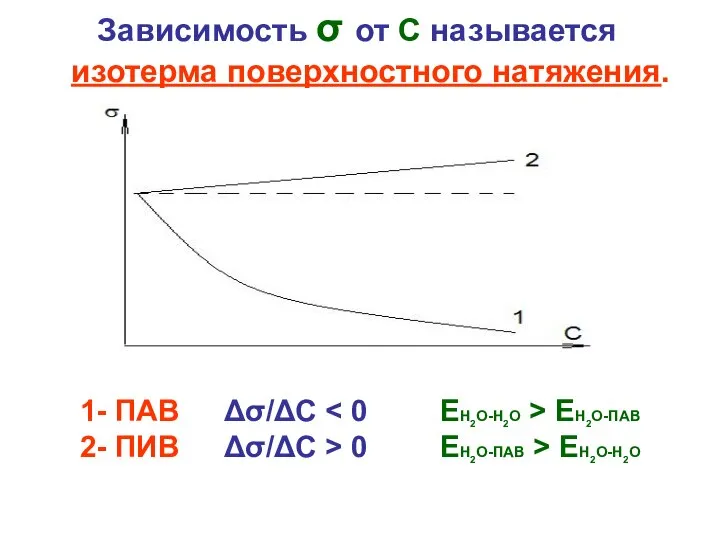
- 4. Зависимость σ от С называется изотерма поверхностного натяжения. 1- ПАВ Δσ/ΔС ЕН2О-ПАВ 2- ПИВ Δσ/ΔС >
- 5. Поверхностная активность – способность растворенных веществ изменять поверхностное натяжение. Мера поверхностной активности - (dσ/dC) или -
- 6. Уравнение Шишковского σ = σо – В ln(1+AC), С – концентрация ПАВ Определение σ: 1) статические
- 7. Правило Дюкло-Траубе: β = Gn+1 / Gn = 3 ÷ 3,5 (для спиртов и карбоновых кислот)
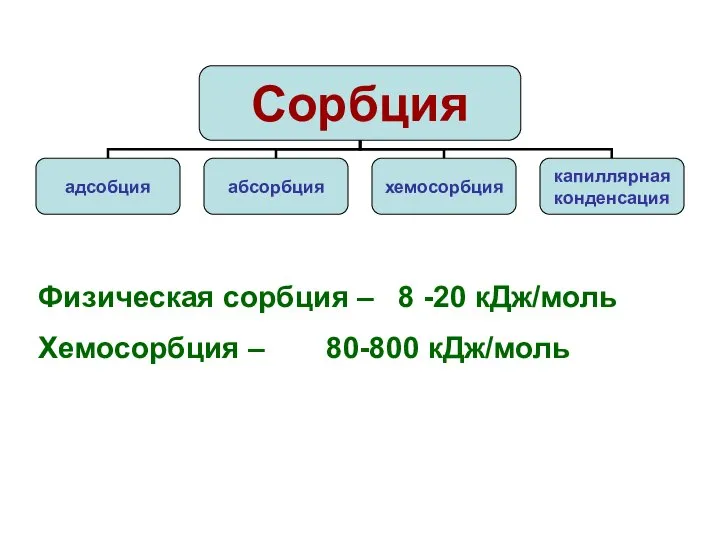
- 8. Физическая сорбция – 8 -20 кДж/моль Хемосорбция – 80-800 кДж/моль
- 9. Уравнение Гиббса [моль/м2]
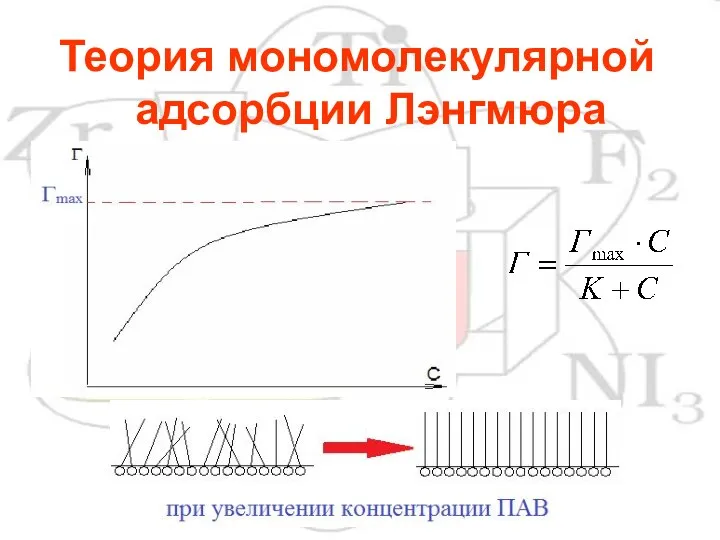
- 10. Теория мономолекулярной адсорбции Лэнгмюра
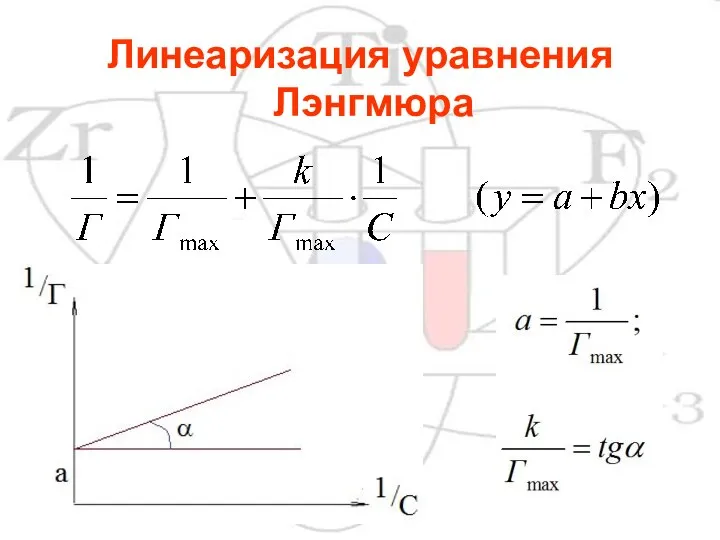
- 11. Линеаризация уравнения Лэнгмюра
- 12. По величине Гmax можно рассчитать So и l молекул ПАВ в мономолекулярном слое
- 13. Адсорбция на твердых сорбентах Уравнение Фрейндлиха
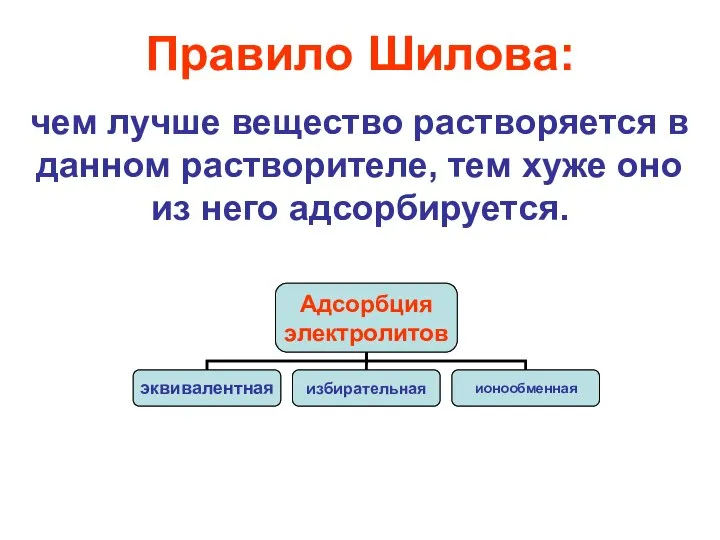
- 15. Правило Шилова: чем лучше вещество растворяется в данном растворителе, тем хуже оно из него адсорбируется.
- 16. Правило Панета-Фаянса: из всех ионов в растворе в первую очередь адсорбируются те, которые входят в состав
- 17. Обменная емкость ионита - ммоль ионов на 1 г сухого и 1 мл набухшего ионита
- 18. Адсорбция лежит в основе важнейших биологических процессов: с адсорбции начинается поглощение различных веществ клетками и тканями
- 19. Адсорбция лежит в основе важнейших биологических процессов: 4) удаление из крови различных токсических веществ, вирусов, бактерий
- 20. Типы сорбентов, использующихся для удаления различных веществ
- 21. Для очистки крови больных спидом применяют силикатную матрицу с введенными в ее структуру амино- или карбоксильными
- 22. Хроматография – область науки, изучающая процессы, основанные на перемещении зоны вещества вдоль слоя сорбента в потоке
- 23. «Хроматография – цветозапись» 1903 г. М.С. Цвет г. Воронеж. Экскурсия у могилы основателя хроматографии М.С. Цвета
- 24. Эксперимент М.С. Цвета по разделению хлорофилла (адсорбент СаСО3) 1 – бесцветная зона (коллоидное примеси) 2 –
- 25. Подвижная фаза (ПФ) – газ или жидкость. Неподвижная фаза (стационарная фаза) (НФ) – твердое тело, жидкость
- 26. Необходимые условия: 1. Наличие ПФ и НФ. 2. Многократные повторения актов сорбции и десорбции. 3. Равновесие
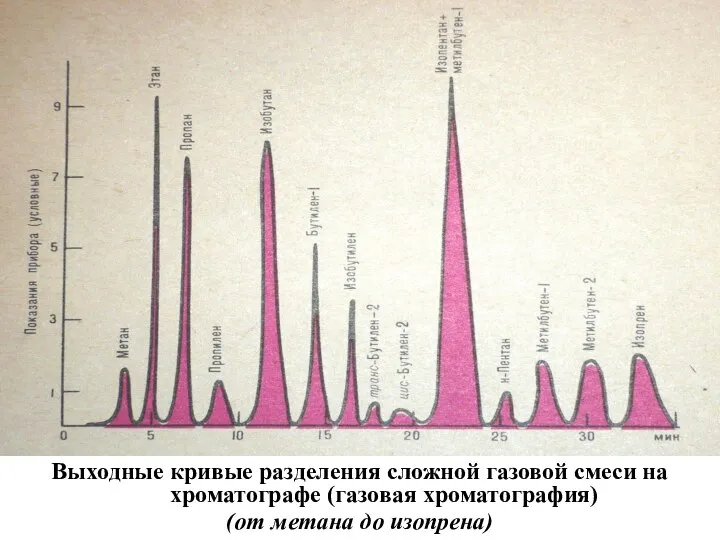
- 27. Выходные кривые разделения сложной газовой смеси на хроматографе (газовая хроматография) (от метана до изопрена)
- 28. Хроматограмма образцов героина а- и б- идентичные образцы, в- другой источник приобретения 1 – кофеин, 2
- 29. Жидкостный хроматограф фирмы «Кнауэр» (Германия)
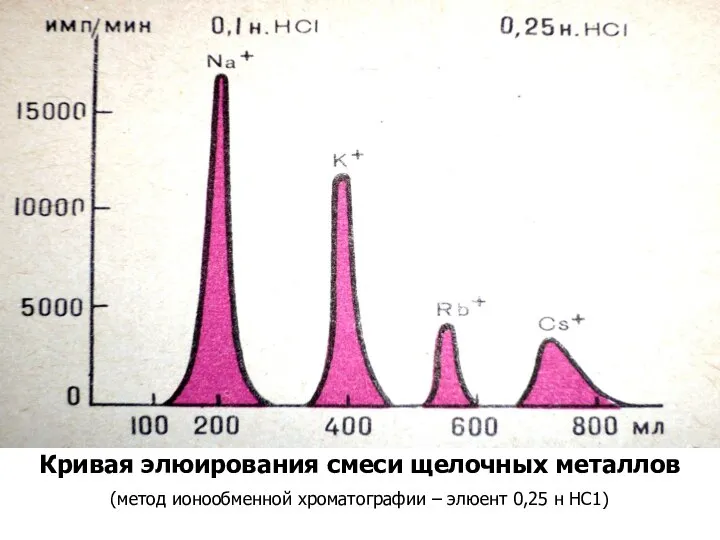
- 30. Кривая элюирования смеси щелочных металлов (метод ионообменной хроматографии – элюент 0,25 н НС1)
- 31. Ионный хроматограф «Цвет – 3006» (СССР)
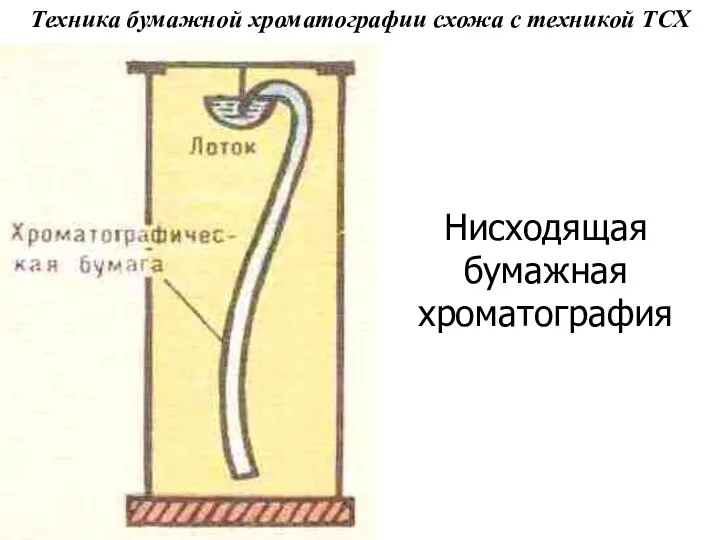
- 32. Техника бумажной хроматографии схожа с техникой ТСХ Нисходящая бумажная хроматография
- 34. Скачать презентацию

![Поверхностное натяжение [Дж/м2] Физический смысл σ: Энергия (Дж/м2) Сила (Н/м) σН2О](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394735/slide-2.jpg)



![Уравнение Гиббса [моль/м2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394735/slide-8.jpg)

















 Концентрация. Растворы
Концентрация. Растворы Алюминий. Нахождение алюминия в природе. Физические и химические свойства
Алюминий. Нахождение алюминия в природе. Физические и химические свойства Роль химии в сохранении окружающей среды
Роль химии в сохранении окружающей среды Правила техники безопасности. Приемы обращения с лабораторным оборудованием
Правила техники безопасности. Приемы обращения с лабораторным оборудованием Презентация по Химии "Кристаллические решетки" - скачать смотреть
Презентация по Химии "Кристаллические решетки" - скачать смотреть  Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации
Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации I закон термодинамики, его применение для расчёта тепловых эффектов
I закон термодинамики, его применение для расчёта тепловых эффектов Аминокислоты. Классификация
Аминокислоты. Классификация Каучуки. Гума
Каучуки. Гума Влияние состава вещества на эффективность таяния льда и замерзания водных растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных растворов Химическая промышленность
Химическая промышленность Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Основні типи невпорядкованості напівпровідникових кристалів. (Лекція 1)
Основні типи невпорядкованості напівпровідникових кристалів. (Лекція 1) Интересные факты о химии
Интересные факты о химии Алкалоидтар
Алкалоидтар Алкины. Свойства, получение и применение
Алкины. Свойства, получение и применение Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Первоначальные химические понятия
Первоначальные химические понятия Жизнь есть способ существования белковых тел
Жизнь есть способ существования белковых тел Химическая номенклатура
Химическая номенклатура Теоретические основы химической технологии
Теоретические основы химической технологии Переработка углеводородных газов. Поточные схемы завода
Переработка углеводородных газов. Поточные схемы завода Каталитический риформинг
Каталитический риформинг Өсімдіктердегі су алмасу физиологиясы. Судың өсiмдiк тiршiлiгiндеri маңызы
Өсімдіктердегі су алмасу физиологиясы. Судың өсiмдiк тiршiлiгiндеri маңызы Понятие «Эффективность». Принцип Ле-Шателье
Понятие «Эффективность». Принцип Ле-Шателье Полістирол. Визначення, фізичні властивості
Полістирол. Визначення, фізичні властивості Комплексті қосылыстар және олардың биологиялық маңызы
Комплексті қосылыстар және олардың биологиялық маңызы Алканы. Гомологический ряд предельных углеводородов
Алканы. Гомологический ряд предельных углеводородов