Содержание
- 2. Содержание Основные понятия Закон действующих масс Влияние температуры на константу химического равновесия Влияние различных факторов на
- 3. Необратимые и обратимые реакции Необратимые реакции – реакции, проходящие только в одном направлении − до конца,
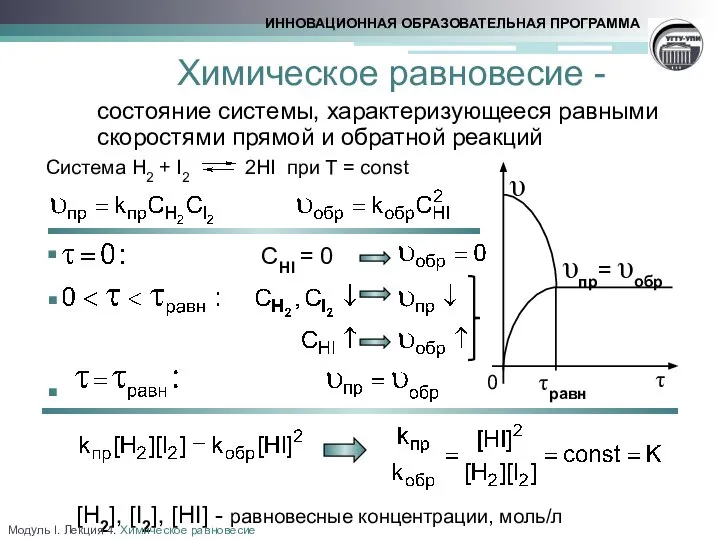
- 4. Химическое равновесие - состояние системы, характеризующееся равными скоростями прямой и обратной реакций Система H2 + I2
- 5. Закон действующих масс В закрытой системе в состоянии равновесия при постоянных температуре и давлении отношение произведений
- 6. Константы равновесий в гомогенных и гетерогенных системах Гомогенная система N2(г) + 3H2(г) 2NH3(г) Гетерогенная система MgCO3(к)
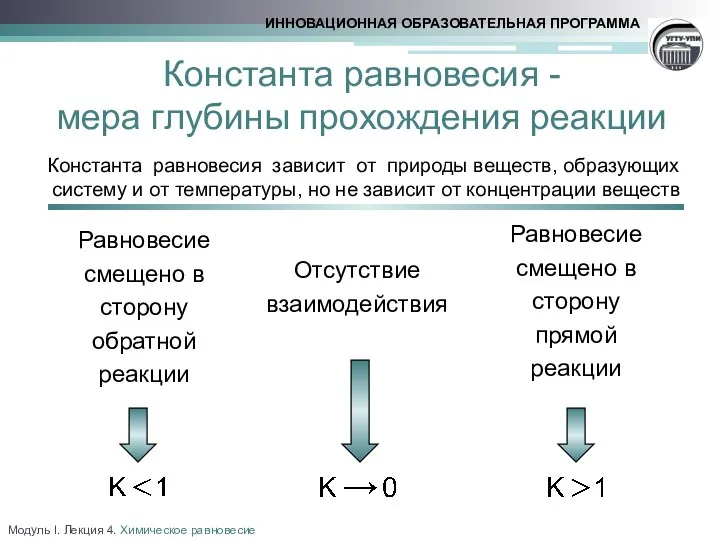
- 7. Константа равновесия - мера глубины прохождения реакции Отсутствие взаимодействия Равновесие смещено в сторону прямой реакции Равновесие
- 8. Расчет равновесных концентраций реагентов по известным исходным концентрациям CO(г) + H2O(г) CO2(г) + H2(г) КС =
- 9. Определение возможного направления реакции при известном значении константы равновесия 2SO2(г) + O2(г) 2SO3(г) При Т =
- 10. Влияние температуры на константу химического равновесия зависимость lnK = f(T) близка к линейной При увеличении температуры
- 11. Модуль I. Лекция 4. Химическое равновесие Расчет ΔН0 и ∆S0 реакции 4NO(г) 2N2O(г) + O2(г) ΔН0
- 12. Модуль I. Лекция 4. Химическое равновесие Расчет и K298 реакции 4NO(г) 2N2O(г) + O2(г) Стандартная энергия
- 13. Модуль I. Лекция 4. Химическое равновесие Расчет и K1500 реакции 4NO(г) 2N2O(г) + O2(г) Энергия Гиббса
- 14. Модуль I. Лекция 4. Химическое равновесие График зависимости для реакции 4NO(г) 2N2O(г) + O2(г) Температура, при
- 15. Модуль I. Лекция 4. Химическое равновесие Температурная зависимость константы равновесия реакции 4NO(г) 2N2O(г) + O2(г) 298
- 16. Влияние различных факторов на состояние химического равновесия. Принцип Ле Шателье Если на систему, находящуюся в равновесии,
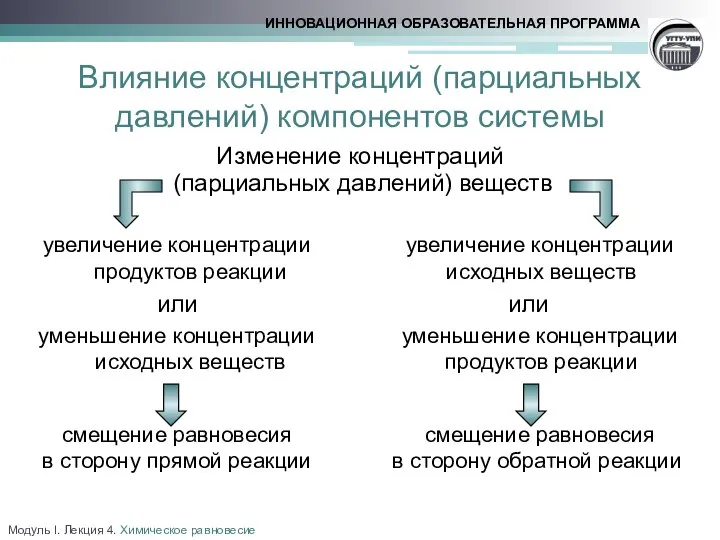
- 17. Изменение концентраций (парциальных давлений) веществ Влияние концентраций (парциальных давлений) компонентов системы увеличение концентрации продуктов реакции или
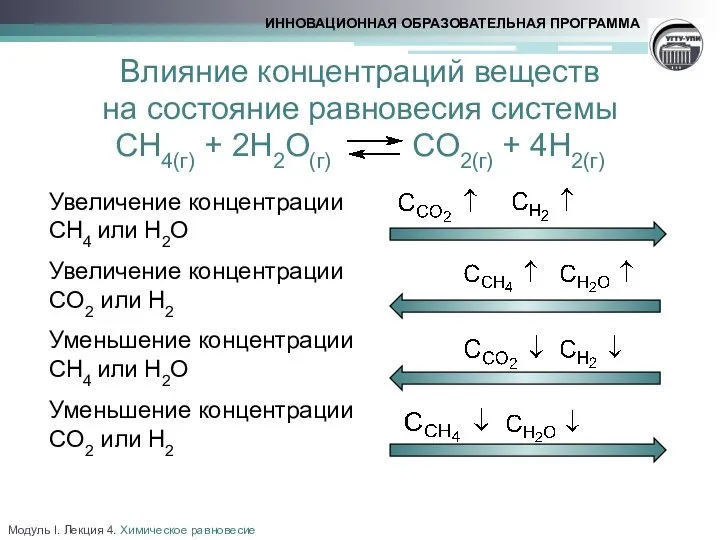
- 18. Влияние концентраций веществ на состояние равновесия системы CH4(г) + 2H2O(г) CO2(г) + 4H2(г) Увеличение концентрации CH4
- 19. Влияние общего давления в системе Давление оказывает влияние на равновесие реакций, сопровождающихся изменением количеств газообразных веществ
- 20. Влияние температуры на состояние равновесия Нагревание смещение равновесия в сторону эндотермических реакций Охлаждение смещение равновесия в
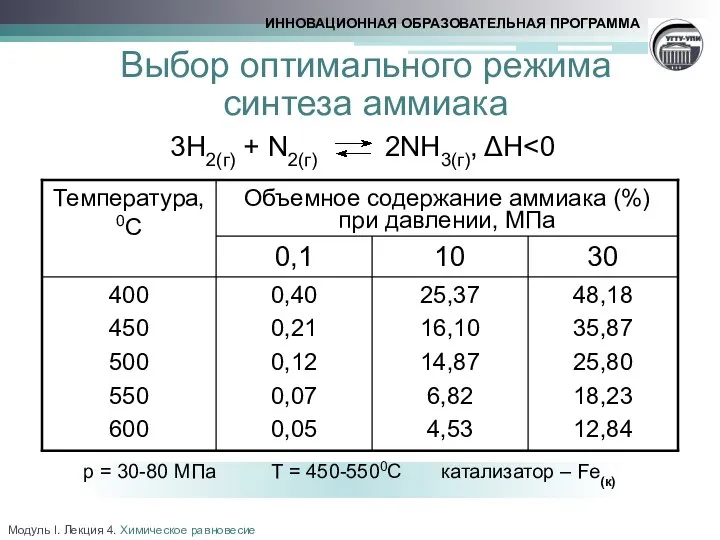
- 21. Выбор оптимального режима синтеза аммиака 3Н2(г) + N2(г) 2NH3(г), ΔH Модуль I. Лекция 4. Химическое равновесие
- 22. Заключение Все самопроизвольные реакции можно разделить на необратимые (идущие в одном направлении) и обратимые (идущие в
- 24. Скачать презентацию
















 Алканы. Аминокислоты
Алканы. Аминокислоты Благородные металлы
Благородные металлы Сера. Свойства серы
Сера. Свойства серы Переосаждение. (Глава 4. § 20. Задача 13)
Переосаждение. (Глава 4. § 20. Задача 13) Жиры. История открытия жиров
Жиры. История открытия жиров Основные разделы химии
Основные разделы химии Интоксикация пестицидами
Интоксикация пестицидами Defect in solid
Defect in solid Основы общей химии
Основы общей химии Биологическое окисление
Биологическое окисление Качественный химический анализ воды на определение металлов
Качественный химический анализ воды на определение металлов Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк
Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк Производные пиррола и индола. (Лекция 4)
Производные пиррола и индола. (Лекция 4) Массообменные процессы
Массообменные процессы Фенолдар. Анықтама
Фенолдар. Анықтама Презентация по Химии "ПЛАСТМАССА" - скачать смотреть
Презентация по Химии "ПЛАСТМАССА" - скачать смотреть  Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Висмут Bi
Висмут Bi Строение и устойчивость дисперсий льда, стабилизированных гидрофобизированным нанокремнеземом
Строение и устойчивость дисперсий льда, стабилизированных гидрофобизированным нанокремнеземом Серная кислота и её свойства
Серная кислота и её свойства Материаловедение. Теория сплавов. (Тема 6)
Материаловедение. Теория сплавов. (Тема 6) Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних
Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Основы цитологии. Химический состав клетки.
Основы цитологии. Химический состав клетки. Химическая термодинамика биологических процессов
Химическая термодинамика биологических процессов Металлические яды, изоляция минерализацией. Применение металлов и их соединений в клинической фармации
Металлические яды, изоляция минерализацией. Применение металлов и их соединений в клинической фармации